高中化学人教版(2019)选择性必修1- 4.1原电池(共17张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修1- 4.1原电池(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-11 21:04:40 | ||
图片预览



文档简介
(共17张PPT)
1
原电池
理解原电池原理
了解原电池应用
稀硫酸
Zn
Cu
A
单液原电池
1、电子总是自发的从低电势流向高电势
2、金属的电极电势
金属的性质
溶液环境
金属越活泼,
电极电势越低
越易给出电子
e-
e-
e-
e-
e-
e-
H+
H2
3、把氧还反应拆开
电子流出
失电子、氧化反应
电子流入
得电子、还原反应
负极
正极
Zn+ 2H+ = Zn2++ H2↑
Zn片 Zn - 2e- = Zn2+
Cu片 2H+ + 2e- = H2↑
在两个电极上
分别发生
负极
正极
Zn2+
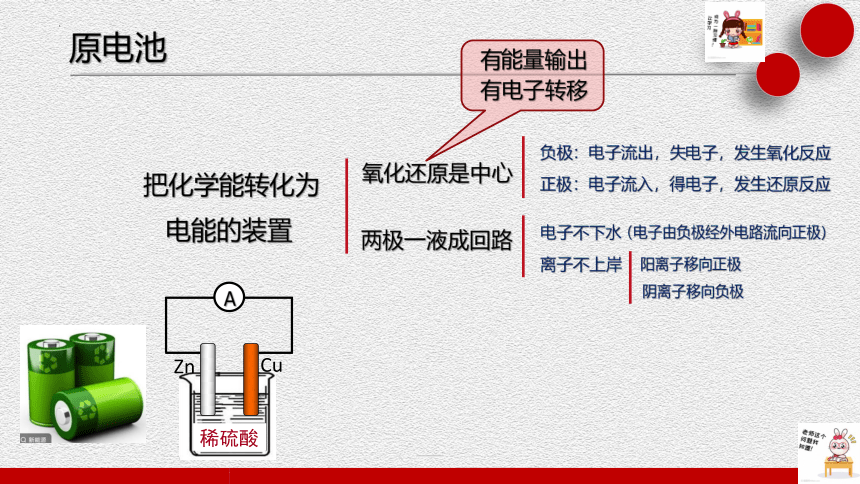
原电池
把化学能转化为
电能的装置
氧化还原是中心
两极一液成回路
负极:电子流出,失电子,发生氧化反应
正极:电子流入,得电子,发生还原反应
(电子由负极经外电路流向正极)
电子不下水
离子不上岸
阳离子移向正极
阴离子移向负极
稀硫酸
Cu
Zn
A
有能量输出
有电子转移
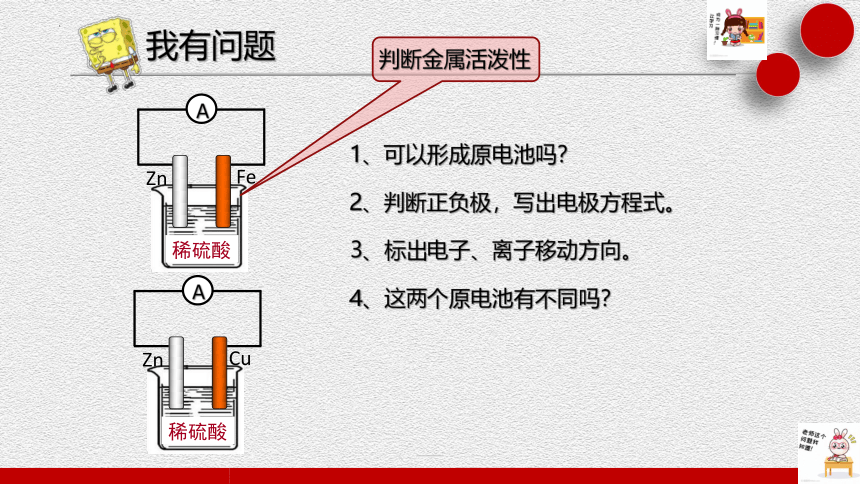
我有问题
稀硫酸
Fe
Zn
A
1、可以形成原电池吗?
2、判断正负极,写出电极方程式。
3、标出电子、离子移动方向。
稀硫酸
Cu
Zn
A
4、这两个原电池有不同吗?
判断金属活泼性
练习二
把化学能转化为
电能的装置
氧化还原是中心
两极一液成回路
负极:失电子,发生氧化反应
正极:得电子,发生还原反应
(电子由负极经外电路流向正极)
电子不下水
离子不上岸
阳离子移向正极
阴离子移向负极
稀硫酸
Cu
Zn
A
练习:课时活页P160、1、2、3、7
稀硫酸
Zn
稀硫酸
Cu
Zn
A
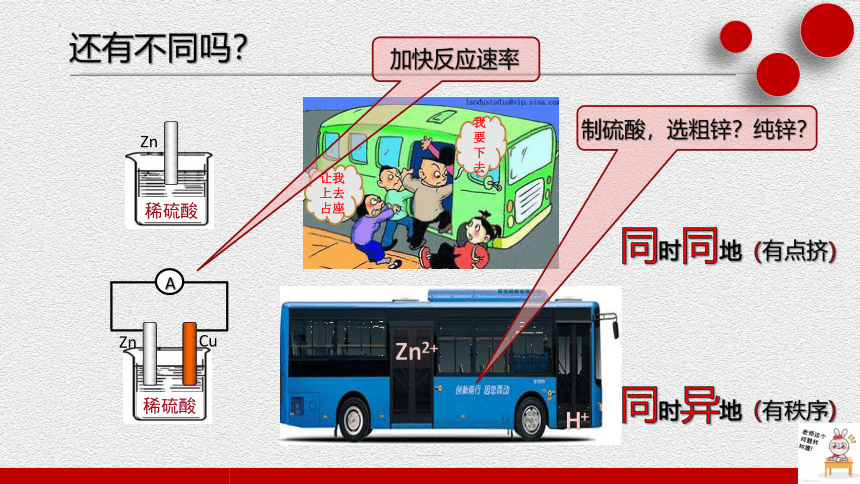
我要下去
让我上去占座
同时同地(有点挤)
同时异地(有秩序)
加快反应速率
还有不同吗?
H+
Zn2+
制硫酸,选粗锌?纯锌?
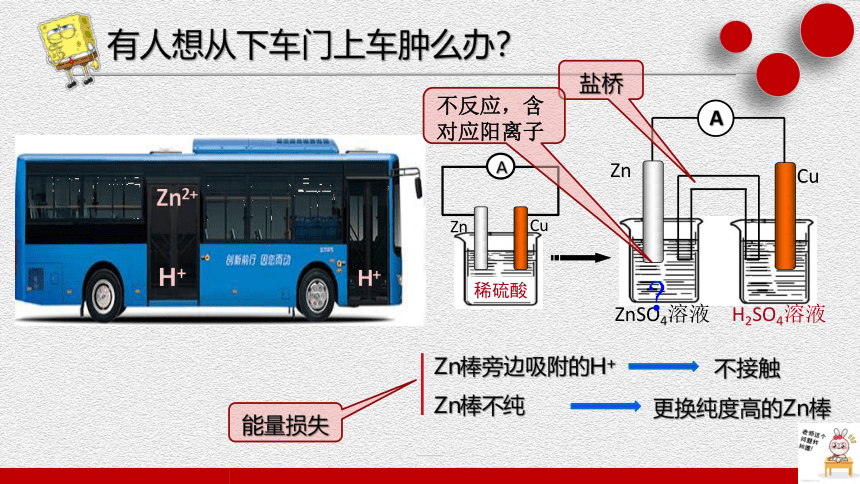
有人想从下车门上车肿么办?
H+
Zn2+
H+
稀硫酸
Cu
Zn
A
Zn棒旁边吸附的H+
Zn棒不纯
更换纯度高的Zn棒
不接触
ZnSO4溶液
H2SO4溶液
A
?
Zn
Cu
能量损失
盐桥
不反应,含对应阳离子
盐桥?
固定作用
组成:由琼脂和饱和氯化钾或饱和硝酸钾溶液构成的。
作用:形成闭合回路; 平衡电荷;
盐桥中离子定向移动
阳离子移向正极
阴离子移向负极
电池进化之路
稀硫酸
Cu
Zn
A
能量利用率高,
电压和电流稳定
练习三
练习三
双液原电池电流弱?
稀硫酸
Cu
Zn
A
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
电池进化之路
稀硫酸
Cu
Zn
A
离子交换膜
阳离子交换膜:只允许阳离子通过
质子交换膜:只允许H+通过
阴离子交换膜:只允许阴离子通过
练习四
小结
把化学能转化为
电能的装置
氧化还原是中心
两极一液成回路
负极:失电子,发生氧化反应
正极:得电子,发生还原反应
(电子由负极经外电路流向正极)
电子不下水
离子不上岸
阳离子移向正极
阴离子移向负极
判断金属活泼性
稀硫酸
Cu
Zn
A
加快反应速率
课时活页P161-14
练习五:设计原电池
根据原电池工作原理,将下列氧化还原反应设计成原电池:
(1)分别写出氧化反应和还原反应。
2Fe3+ + 2I- ==2Fe2+ + I2
氧化反应: 2I- - 2e- ==I2
还原反应: 2Fe3+ + 2e- ===2Fe2+
只允许K+或Cl-通过的隔膜
(2)根据原电池构成要素,选择合适的物质或材料,并画出原电池的工作原理示意图。
1
原电池
理解原电池原理
了解原电池应用
稀硫酸
Zn
Cu
A
单液原电池
1、电子总是自发的从低电势流向高电势
2、金属的电极电势
金属的性质
溶液环境
金属越活泼,
电极电势越低
越易给出电子
e-
e-
e-
e-
e-
e-
H+
H2
3、把氧还反应拆开
电子流出
失电子、氧化反应
电子流入
得电子、还原反应
负极
正极
Zn+ 2H+ = Zn2++ H2↑
Zn片 Zn - 2e- = Zn2+
Cu片 2H+ + 2e- = H2↑
在两个电极上
分别发生
负极
正极
Zn2+
原电池
把化学能转化为
电能的装置
氧化还原是中心
两极一液成回路
负极:电子流出,失电子,发生氧化反应
正极:电子流入,得电子,发生还原反应
(电子由负极经外电路流向正极)
电子不下水
离子不上岸
阳离子移向正极
阴离子移向负极
稀硫酸
Cu
Zn
A
有能量输出
有电子转移
我有问题
稀硫酸
Fe
Zn
A
1、可以形成原电池吗?
2、判断正负极,写出电极方程式。
3、标出电子、离子移动方向。
稀硫酸
Cu
Zn
A
4、这两个原电池有不同吗?
判断金属活泼性
练习二
把化学能转化为
电能的装置
氧化还原是中心
两极一液成回路
负极:失电子,发生氧化反应
正极:得电子,发生还原反应
(电子由负极经外电路流向正极)
电子不下水
离子不上岸
阳离子移向正极
阴离子移向负极
稀硫酸
Cu
Zn
A
练习:课时活页P160、1、2、3、7
稀硫酸
Zn
稀硫酸
Cu
Zn
A
我要下去
让我上去占座
同时同地(有点挤)
同时异地(有秩序)
加快反应速率
还有不同吗?
H+
Zn2+
制硫酸,选粗锌?纯锌?
有人想从下车门上车肿么办?
H+
Zn2+
H+
稀硫酸
Cu
Zn
A
Zn棒旁边吸附的H+
Zn棒不纯
更换纯度高的Zn棒
不接触
ZnSO4溶液
H2SO4溶液
A
?
Zn
Cu
能量损失
盐桥
不反应,含对应阳离子
盐桥?
固定作用
组成:由琼脂和饱和氯化钾或饱和硝酸钾溶液构成的。
作用:形成闭合回路; 平衡电荷;
盐桥中离子定向移动
阳离子移向正极
阴离子移向负极
电池进化之路
稀硫酸
Cu
Zn
A
能量利用率高,
电压和电流稳定
练习三
练习三
双液原电池电流弱?
稀硫酸
Cu
Zn
A
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
电池进化之路
稀硫酸
Cu
Zn
A
离子交换膜
阳离子交换膜:只允许阳离子通过
质子交换膜:只允许H+通过
阴离子交换膜:只允许阴离子通过
练习四
小结
把化学能转化为
电能的装置
氧化还原是中心
两极一液成回路
负极:失电子,发生氧化反应
正极:得电子,发生还原反应
(电子由负极经外电路流向正极)
电子不下水
离子不上岸
阳离子移向正极
阴离子移向负极
判断金属活泼性
稀硫酸
Cu
Zn
A
加快反应速率
课时活页P161-14
练习五:设计原电池
根据原电池工作原理,将下列氧化还原反应设计成原电池:
(1)分别写出氧化反应和还原反应。
2Fe3+ + 2I- ==2Fe2+ + I2
氧化反应: 2I- - 2e- ==I2
还原反应: 2Fe3+ + 2e- ===2Fe2+
只允许K+或Cl-通过的隔膜
(2)根据原电池构成要素,选择合适的物质或材料,并画出原电池的工作原理示意图。
