人教版选择性必修3 4.1糖类 课件(70张)
文档属性
| 名称 | 人教版选择性必修3 4.1糖类 课件(70张) |  | |
| 格式 | pptx | ||
| 文件大小 | 128.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-12 14:25:16 | ||
图片预览










文档简介
(共70张PPT)
网
学
第一节 糖类
4.1.1 糖类的组成和分类 单糖
第四章 生物大分子
重点:葡萄糖的组成、结构、典型性质和应用
难点:从官能团的角度认识葡萄糖的结构与性质的关系
1.了解糖类的概念、分类及结构特点。(宏观辨识与与微观探析)
2.熟知葡萄糖的结构和性质,学会葡萄糖的检验方法。(变化观念与科学探究)
植物茎叶中的纤维素
粮食中的淀粉
日常食用的蔗糖
你吃过这些吗?
常见的糖类
葡萄糖
蔗糖
麦芽糖
淀粉
纤维素
甜味
无甜味
C6H12O6
C12H22O11
C12H22O11
(C6H10O5)n
(C6H10O5)n
【环节一】认识糖类物质
1.阅读教材79页第1、2段
和资料卡片,回答下列问题:
(1)什么是糖,由哪几种元素
组成?
(2)糖是怎样分类的?
(3)糖类就是碳水化合物吗?
(4)糖都是甜的吗?
1.组成:
糖类是绿色植物光合作用的产物,是生命活动的主要能量来源。一般含碳、氢、氧三种元素。
因此将糖类称为碳水化合物是
有甜味的不一定是糖。如:某些食品添加剂、甘油。
糖不一定都有甜味。淀粉、纤维素就没有甜味。
糖类
碳水化合物
甜味物质
糖类
符合Cm(H2O)n通式的不一定是糖。例如:乙酸C2H4O2、乳酸C3H6O3。
有的糖不一定符合Cm(H2O)n通式。例如:脱氧核糖C5H10O4、鼠李糖C6H12O5
不科学的
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
根据能否水解以及水解后的的产物划分
(多糖属于天然高分子化合物)
2、定义
3、分类
(1)单糖(不能水解成更简单的糖)葡萄糖、果糖、半乳糖、山梨糖) ,它们的分子式都为C6H12O6
(2)寡糖或低聚糖( 1mol 水解产生 2 mol 单糖) (低聚糖)中最重要的是二糖:蔗糖、麦芽糖、纤维二糖和乳糖,它们的分子式都是C12H22O11
(3)多糖( 1 mol 水解产生许多摩单糖)淀粉、纤维素
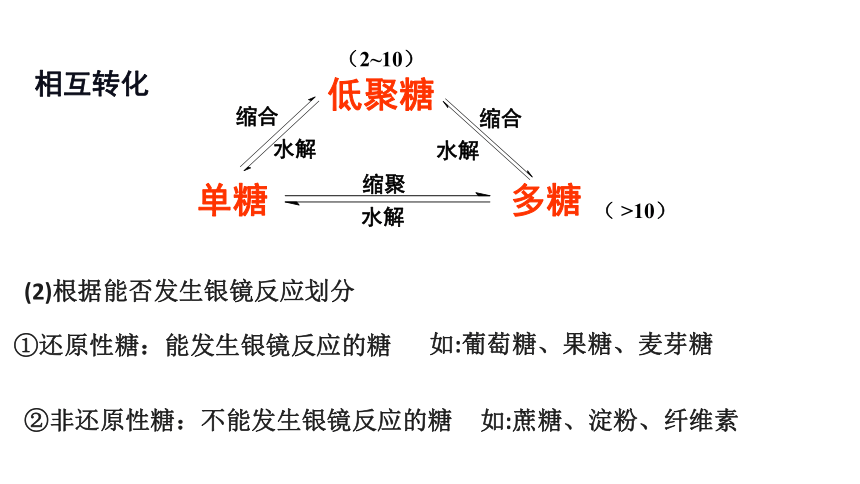
相互转化
低聚糖
单糖
多糖
水解
缩合
水解
缩聚
水解
缩合
(2~10)
( >10)
(2)根据能否发生银镜反应划分
①还原性糖:能发生银镜反应的糖
②非还原性糖:不能发生银镜反应的糖
如:葡萄糖、果糖、麦芽糖
如:蔗糖、淀粉、纤维素
需要掌握的各类糖的代表
同分异构体
同分异构体
没有关系,n值不同。
葡萄糖
有甜味
白色晶体
易溶于水
最甜的糖:
果糖
常为粘稠状液体,纯净的为无色晶体,易溶于水。
1.葡萄糖
(1)存在:
(3)组成和结构:
C6H12O6
(2)物理性质:
易溶于水的无色晶体, 熔点146℃,有甜味,但甜度不如蔗糖
葡萄糖是自然界中分布最广的单糖,因最初是从葡萄汁中分离得到而得名。葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
分子式:
【环节二】认识单糖及其化学性质
活动1 请根据葡萄糖的分子式,推测其可能具有的结构。
活动2 依据实验事实,确定葡萄糖的分子结构
序号 实验事实
1 葡萄糖在一定的条件下,可以被还原为直链己六醇
2 葡萄糖与足量的乙酸反应,生成葡萄糖五乙酸酯
3 葡萄糖可以被溴水氧化,生成五羟基酸
4 在有机化合物分子中,若同一个碳原子上连有两个或两个以上羟基,这种结构不稳定
葡萄糖分子中含有由6个碳原子构成的直链结构。
1个葡萄糖分子中含有5个羟基。
葡萄糖分子中含有醛基。
葡萄糖分子中的5个羟基分别连在5个不同的碳原子上。
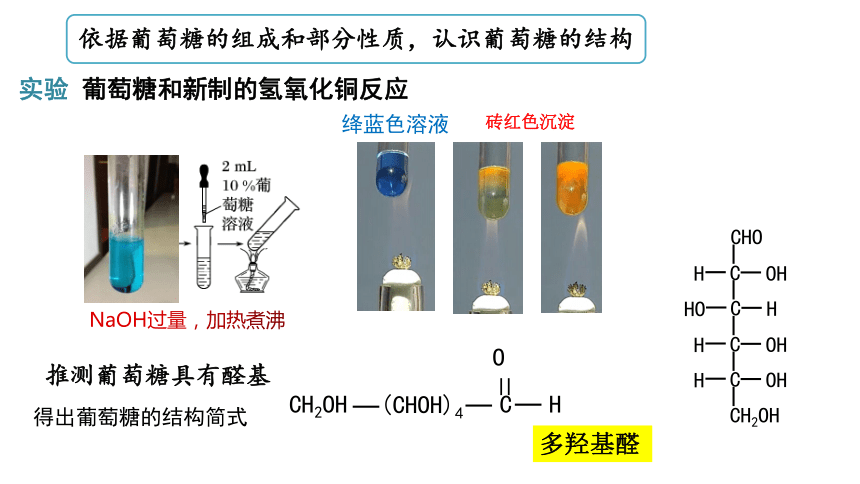
依据葡萄糖的组成和部分性质,认识葡萄糖的结构
实验 葡萄糖和新制的氢氧化铜反应
配制
氢氧化铜
加入葡萄糖溶液
生成绛蓝色溶液
甘油与新制氢氧化铜反应,生成绛蓝色溶液
乙醇与新制氢氧化铜反应,不出现绛蓝色
依据以上实验现象,推测葡萄糖结构中,具有怎样的结构?
葡萄糖具有与甘油相似的性质,推测其具有多个羟基
实验 葡萄糖和新制的氢氧化铜反应
推测葡萄糖具有醛基
得出葡萄糖的结构简式
依据葡萄糖的组成和部分性质,认识葡萄糖的结构
CHO
CH2OH
C
H
HO
C
OH
H
C
OH
H
C
OH
H
(CHOH)4
C
H
O
Ⅱ
CH2OH
多羟基醛
NaOH过量,加热煮沸
绛蓝色溶液
砖红色沉淀
活动3 实验验证葡萄糖的氧化反应
通过结构分析葡萄糖的化学性质,并进行实验验证
实验I ①葡萄糖的银镜反应
配制
银氨溶液
滴加
葡萄糖溶液
水浴加热
银镜
CH2OH(CHOH)4CHO + 2Ag(NH3)2OH
△
+ 2Ag↓+ 3NH3 + H2O
CH2OH(CHOH)4COONH4
② 葡萄糖和新制的氢氧化铜反应
CH2OH(CHOH)4CHO + 2Cu(OH)2 + NaOH
△
+ Cu2O↓ + 3H2O
CH2OH(CHOH)4COONa
(4)葡萄糖的结构特点
(5)化学性质
① 银镜反应
②与新制Cu(OH)2悬浊液反应
醛基
加成反应
CH2OH(CHOH)4CHO+H2
CH2OH(CHOH)4CH2OH
氧化反应
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
Ni
③ 与高锰酸钾、溴水等强氧化剂反应
④催化加氢
医学用于检验尿糖
羟基
⑥使高锰酸钾褪色
⑤ 与Na反应
⑦酯化反应
置换反应
氧化反应
取代反应
消去反应
⑧与HX反应
⑨分子间脱水
1mol葡萄糖完全酯化,参加反应的乙酸为5mol,证明葡萄糖分子中有5个羟基
(5)化学性质
⑩生理氧化
葡萄糖易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维持生命活动所需要的能量。低血糖的患者可利用静脉注射葡萄糖溶液的方式来迅速补充营养。
C6H12O6+ 6O2 6CO2 + 6H2O
酶
氧化反应
在体内生理反应
无氧分解生成乳酸
有氧时的氧化反应
分解生成乙醇(酿酒)
C6H12O6
2C2H5OH+2CO2↑
酒曲酶
C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)
CH2OH(CHOH)4CHO 2CH3CH(OH)COOH
(6)用途
①生活上-----糖类;
②工业上-----制镜;
③医药上-----迅速补充营养、制葡萄糖酸钙等。
营养物质
镀银工业
制药工业
制酒工业
小常识:尿糖的检验
出现红色沉淀:有大量Cu2O生成,尿液中葡萄糖含量较高,病情较重,用“++++”表示;
出现土黄色:含糖量为中等,用“+++”表示;
出现黄绿色:含糖量为少量,用“++”表示;
出现绿色:含糖量为微量,用“+”表示;
如仍保持原来的蓝色:证明尿液中不含葡萄糖,用“—”表示。
资料卡片
葡萄糖的环状结构
α D 吡喃葡萄糖
链状葡萄糖
β D 吡喃葡萄糖
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖中的单糖单元多以环状结构的形式存在。
2、果糖
阅读教材80页果糖,了解果糖的结构、存在和物理性质。
果糖在水果和蜂蜜中含量较高,它比蔗糖的甜度高,广泛应用于食品和医药的生产中, 最甜的糖
(1)分子式:
C6H12O6
(2)结构简式:
CH2OH-CHOH-CHOH-CHOH-CO-CH2OH
或CH2OH-(CHOH)3-CO-CH2OH
(3)官能团:
羟基:-OH
羰基:
-C-
O
Ⅱ
多羟基酮
(4)存在:
蜂蜜、水果中
(5)物理性质:
教材80页,无色晶体,熔点103~105℃,最甜的糖,不易结晶,通常为液体,易溶于水、乙醇和乙醚。
(6)化学性质:
羟基的性质,羰基的加成。
拓展提升
酮糖具有酮羰基,但在碱性条件下易转化为烯二醇中间体,它可异构化为醛式,所以酮糖也易被吐伦试剂、菲林试剂氧化。(碱性条件)
3.核糖与脱氧核糖
核糖与脱氧核糖分别是生物体的遗传物质 与 ______ _____的重要组成部分。
核糖核酸(RNA)
脱氧核糖核酸(DNA)
醛
二者都含有醛基,
均属于 糖,
均具有还原性,
属于 糖
它们都是含有5个碳原子的单糖——戊糖。
还原
核糖
脱氧核糖
4.糖类分子与手性
象人的两只手,由于五指的构型不同,左手和右手互为实物和镜像关系,但不能完全重叠,称为手性。
(1)手性碳原子:
在分子中连有4个不同的原子或原子团的碳原子叫做不对称碳原子,也叫手性碳原子。
例如:乳酸分子
CH3 C COOH
H
OH
*
的中间碳原子就是手性碳原子。
(2)手性分子:含有手性碳原子存在不能重叠、互为镜像的对映异构体的分子称手性分子:如 为手性分子。
H— C —OH
CHO
CH2—OH
L-甘油醛
HO—C —H
CHO
CH2—OH
它在空间的构型有两种:(呈镜像对称,但不能完全重叠。)
课堂小结
糖类
组成:
定义:
分类
C、H、O
多羟基醛,多羟基酮和它们的脱水缩合物
单糖:葡萄糖、果糖、核糖
低聚糖:麦芽糖、蔗糖、乳糖
多糖:淀粉、纤维素
葡萄糖
果糖:
CH2OH(CHOH )3COCH2OH
同分异构体
分子式:
结构简式:
官能团:
C6H12O6
CH2OH(CHOH )4CHO
醛基、醇羟基
化学性质
醛基的性质
醇羟基的性质
第四章 生物大分子
第一节 糖类
第2课时 二糖 多糖
三、二糖:
麦芽糖
C12H22O11
蔗糖
C12H22O11
1.定义:1mol糖能水解成2mol单糖。又叫双糖
乳糖
C12H22O11
它们互为同分异构体
1.蔗糖
蔗糖是最常用的甜味剂,也是在自然界中分布最广的二糖。
分子式:C12H22O11
存在于大多数植物体中(甘蔗、甜菜中含量最高)
生活中食用的白糖、冰糖、红糖的主要成分都是蔗糖。
1.蔗糖
⑴物理性质
无色晶体,熔点186℃,易溶于水,较难溶于乙醇。甜味仅次于果糖。
⑵化学性质
在酸或酶的作用下,可以水解生成葡萄糖和果糖
C6H12O6 + C6H12O6
酸或酶
C12H22O11 + H2O
葡萄糖 果糖
蔗糖
注意:糖类水解写的是分子式,必须在下面注明物质名称。
2.麦芽糖
分子式:C12H22O11
麦芽糖主要存在中发芽的谷粒和麦芽中,是淀粉水解过程中的一种中间产物
使用含淀粉酶的麦芽作用于淀粉可制得饴糖(麦芽糖)
发芽的小麦
2.麦芽糖
⑴物理性质
无色晶体,易溶于水,有甜味,但甜味不如蔗糖。
⑵化学性质
在酸或酶催化下,麦芽糖可以水解生成葡萄糖。
2 C6H12O6
酸或酶
C12H22O11 + H2O
葡萄糖
麦芽糖
探究1:
蔗糖、麦芽糖是否属于还原糖?怎样设计实验?
无砖红色沉淀
蔗糖分子无醛基,不属于还原糖
有砖红色沉淀生成
麦芽糖分子有醛基,属于还原糖
探究2:
蔗糖蔗糖的水解实验,怎样设计实验?
?
探究2:
蔗糖蔗糖的水解实验,怎样设计实验?
无明显现象
有砖红色沉淀生成
蔗糖
水解液
中和液
↓
1.麦芽糖主要存在于发芽的谷粒中,其α-D-(+)-麦芽糖的结构如图所示,下列相关说法中正确的是( )
A.麦芽糖是一种常见的寡糖
B.如图麦芽糖分子结构中无醛基,因此属于非还原糖
C.麦芽糖由一分子葡萄糖和一分子果糖脱水缩合形成
D.将麦芽糖水解液调至碱性后,可发生银镜反应,证明部分麦芽糖发生了水解
A
蔗糖 麦芽糖
相似性 ①组成相同,分子式均为C12H22O11,互为同分异构体; ②都属于二糖,1mol二糖水解后生成2mol单糖 不同点 官能团 不含醛基,是非还原糖 含有醛基,是还原糖
化学性质 不能与银氨溶液、新制Cu(OH)2反应 能与银氨溶液、新制Cu(OH)2反应
水解产物 葡萄糖和果糖 葡萄糖
蔗糖、麦芽糖总结:
四、多糖
四、多糖
淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连接组成的,属于天然有机高分子,淀粉的相对分子质量可达到几十万,纤维素可达到几百万。
淀粉和纤维素的分子式可以表示为(C6H10O5)n
其中的葡萄糖单元中一般仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n
但二者的n值不同,二者不是同分异构体。
1.淀粉
绿色植物光合作用的产物;
存在:植物种子或块根中,如大米、小麦、马铃薯等。
天然淀粉由直链淀粉和支链淀粉组成。支链淀粉含量很高的一些谷物,如糯米、糯玉米等有比较黏的口感。
①淀粉的物理性质:
白色粉末状物质,没有甜味,不溶于冷水。
在热水中淀粉会部分溶解,形成胶状的淀粉糊。
淀粉遇单质碘变蓝
淀粉
(C6H10O5)n
淀粉有直链淀粉和支链淀粉两类。前者为无分支的螺旋结构;后者以24~30个葡萄糖残基以α-1,4-糖苷键首尾相连而成,在支链处为α-1,6-糖苷键。
直链淀粉遇碘呈蓝色,支链淀粉遇碘呈紫红色。这并非是淀粉与碘发生了化学反应,产生相互作用,而是淀粉螺旋中央空穴恰能容下碘分子,通过范德华力,两者形成一种蓝黑色络合物。具有可逆热色性
实验证明,单独的碘分子不能使淀粉变蓝,实际上使淀粉变蓝的是碘分子离子。
②淀粉的化学性质:
●淀粉不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
●在淀粉中葡萄糖单元存在醇羟基,可以发生酯化反应。
●在酸或酶催化下,淀粉最终生成葡萄糖。
淀粉水解反应
淀粉水解反应
有砖红色沉淀生成
淀粉水解生成的葡萄糖,与新制的Cu(OH)2共热生成氧化亚铜(Cu2O)
(C6H10O5)n + nH2O
淀粉
n C6H12O6
葡萄糖
催化剂
思考:
滴加碘水
现象A
如何检验淀粉的水解程度?
银氨溶液
水浴加热
现象B
溶液变蓝色 未出现银镜
溶液变蓝色 出现银镜
溶液不变蓝色 出现银镜
淀粉尚未水解
淀粉部分水解
淀粉完全水解
③淀粉用途:
淀粉是食物的一种重要成分,也是重要的工业原料。以淀粉或淀粉水解生成的葡萄糖等为原料,经发酵可以得到多种产品,如燃料乙醇、白酒、食醋、味精,以及氨基酸、抗生素等药物。淀粉经酯化后可用于生产食品添加剂、表面活性剂和可降解塑料等。
2.纤维素
⑴自然界中分布最广泛的一种多糖,参与构成了植物的细胞壁,起着保护和支持作用。如自然界中的棉、麻、木材、秸秆中存在大量纤维素。
⑵物理性质:纤维素是白色纤维状物质,没有甜味,不溶于水,也不溶于一般的有机溶剂。
植物纤维素
(C6H10O5)n
⑶化学性质:
(C6H10O5)n + nH2O
纤维素
n C6H12O6
葡萄糖
酸或酶
2.纤维素
①在酸或酶催化下最终水解成葡萄糖
②不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
③纤维素的葡萄糖单元仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n,能发生酯化(或硝化)。
⑶化学性质:
2.纤维素
+ 3n CH3COOH
纤维素醋酸酯(俗称醋酸纤维)
3nH2O
+
③纤维素的葡萄糖单元仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n,能发生酯化(或硝化)。
⑶化学性质:
2.纤维素
+ 3n HO—NO2
纤维素硝酸酯(俗称硝酸纤维)
3nH2O
+
⑷用途:
2.纤维素
①棉和麻的纤维大量用于纺织工业。
②一些富含纤维素的物质,如木材、秸秆等是造纸的原料。
③用来制造纤维素硝酸酯、纤维素乙酸酯和黏胶纤维等。
通过纺丝而制成的再生纤维。
黏胶纤维中的长纤维一般称为人造丝,
短纤维称为人造棉
黏胶纤维是用木材、秸秆等富含纤维素的物质经化学处理后
淀粉、纤维素的化学性质比较
淀粉 纤维素
分子结构 分子通式 (C6H10O5)n 相对分子质量 几万到几十万 几十万到几百万
分子结 构关系 都是由葡萄糖结构单元(C6H10O5)构成的天然有机高分子,但分子内葡萄糖结构单元数目不同,分子结构不同 化学性质 共性 无还原性;水解最终生成葡萄糖。 特性 淀粉遇单质碘变蓝;分子中含有醇羟基,能与醋酸、硝酸等发生酯化反应 1.淀粉、纤维素的分子式均可表示为(C6H10O5)n,但二者的n值不同,二者不属于同分异构体。
易错提醒
2.蔗糖、淀粉、纤维素水解的催化剂为稀硫酸,在检验其水解产物之前需加NaOH溶液中和硫酸,因为葡萄糖与新制Cu(OH)2悬浊液、银氨溶液的反应都必须在碱性环境中进行。
3.糖类的结构式比较复杂,一般用分子式表示,为了区别,一般在分子式下面标上糖类的名称,防止混淆。
(1)可以用新制Cu(OH)2悬浊液鉴别蔗糖和葡萄糖( )
(2)淀粉水解的最终产物为二氧化碳和水( )
(3)淀粉和纤维素在人体内都能被消化和吸收( )
(4)可以用碘水检验淀粉的存在( )
(5)为检验淀粉的水解产物,可向水解后的溶液中加入新制Cu(OH)2悬浊液,加热,如没有砖红色沉淀,则没有葡萄糖生成( )
(6)富含纤维素的生物质在生产中可生产燃料乙醇( )
判断正误
×
×
×
√
√
√
1.某学生设计了如下实验方案用以检验淀粉水解的情况:
下列结论正确的是( )
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
D.淀粉已发生水解,但不知是否完全水解
D
2.糖类是生命的基础能源,关于糖类的说法中,正确的是
A.糖类都可以水解
B.糖类是具有甜味的物质
C.糖类都含有C、H、O元素
D.糖类都符合Cn(H2O)m的通式
3.葡萄糖(C6H12O6)是一种重要的营养物质,下列关于葡萄糖的说法正确的是
A.葡萄糖是一种单糖
B.葡萄糖分子中有6个碳原子、6个水分子
C.常温下,葡萄糖可与新制的氢氧化铜悬浊液反应
D.1 mol葡萄糖完全燃烧需要9 mol氧气
4.近几年一种新型的甜味剂木糖醇悄悄地进入人们的视野,木糖醇是一种理想的蔗糖替代品,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者食用的优点。木糖醇是一种白色粉末状的晶体,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH。下列有关木糖醇的叙述中不正确的是
A.木糖醇与葡萄糖、果糖等一样,
属于多羟基醛或酮,是一种单糖
B.木糖醇可发生取代反应
C.木糖醇是一种五元醇
D.木糖醇是一种无糖型甜味剂
1
2
3
5
4
6
5.以淀粉为基本原料可制备许多物质,如
下列有关说法中正确的是
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
不如意的时候不要尽往悲伤里钻,想想有笑声的日子吧!
网
学
第一节 糖类
4.1.1 糖类的组成和分类 单糖
第四章 生物大分子
重点:葡萄糖的组成、结构、典型性质和应用
难点:从官能团的角度认识葡萄糖的结构与性质的关系
1.了解糖类的概念、分类及结构特点。(宏观辨识与与微观探析)
2.熟知葡萄糖的结构和性质,学会葡萄糖的检验方法。(变化观念与科学探究)
植物茎叶中的纤维素
粮食中的淀粉
日常食用的蔗糖
你吃过这些吗?
常见的糖类
葡萄糖
蔗糖
麦芽糖
淀粉
纤维素
甜味
无甜味
C6H12O6
C12H22O11
C12H22O11
(C6H10O5)n
(C6H10O5)n
【环节一】认识糖类物质
1.阅读教材79页第1、2段
和资料卡片,回答下列问题:
(1)什么是糖,由哪几种元素
组成?
(2)糖是怎样分类的?
(3)糖类就是碳水化合物吗?
(4)糖都是甜的吗?
1.组成:
糖类是绿色植物光合作用的产物,是生命活动的主要能量来源。一般含碳、氢、氧三种元素。
因此将糖类称为碳水化合物是
有甜味的不一定是糖。如:某些食品添加剂、甘油。
糖不一定都有甜味。淀粉、纤维素就没有甜味。
糖类
碳水化合物
甜味物质
糖类
符合Cm(H2O)n通式的不一定是糖。例如:乙酸C2H4O2、乳酸C3H6O3。
有的糖不一定符合Cm(H2O)n通式。例如:脱氧核糖C5H10O4、鼠李糖C6H12O5
不科学的
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
根据能否水解以及水解后的的产物划分
(多糖属于天然高分子化合物)
2、定义
3、分类
(1)单糖(不能水解成更简单的糖)葡萄糖、果糖、半乳糖、山梨糖) ,它们的分子式都为C6H12O6
(2)寡糖或低聚糖( 1mol 水解产生 2 mol 单糖) (低聚糖)中最重要的是二糖:蔗糖、麦芽糖、纤维二糖和乳糖,它们的分子式都是C12H22O11
(3)多糖( 1 mol 水解产生许多摩单糖)淀粉、纤维素
相互转化
低聚糖
单糖
多糖
水解
缩合
水解
缩聚
水解
缩合
(2~10)
( >10)
(2)根据能否发生银镜反应划分
①还原性糖:能发生银镜反应的糖
②非还原性糖:不能发生银镜反应的糖
如:葡萄糖、果糖、麦芽糖
如:蔗糖、淀粉、纤维素
需要掌握的各类糖的代表
同分异构体
同分异构体
没有关系,n值不同。
葡萄糖
有甜味
白色晶体
易溶于水
最甜的糖:
果糖
常为粘稠状液体,纯净的为无色晶体,易溶于水。
1.葡萄糖
(1)存在:
(3)组成和结构:
C6H12O6
(2)物理性质:
易溶于水的无色晶体, 熔点146℃,有甜味,但甜度不如蔗糖
葡萄糖是自然界中分布最广的单糖,因最初是从葡萄汁中分离得到而得名。葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
分子式:
【环节二】认识单糖及其化学性质
活动1 请根据葡萄糖的分子式,推测其可能具有的结构。
活动2 依据实验事实,确定葡萄糖的分子结构
序号 实验事实
1 葡萄糖在一定的条件下,可以被还原为直链己六醇
2 葡萄糖与足量的乙酸反应,生成葡萄糖五乙酸酯
3 葡萄糖可以被溴水氧化,生成五羟基酸
4 在有机化合物分子中,若同一个碳原子上连有两个或两个以上羟基,这种结构不稳定
葡萄糖分子中含有由6个碳原子构成的直链结构。
1个葡萄糖分子中含有5个羟基。
葡萄糖分子中含有醛基。
葡萄糖分子中的5个羟基分别连在5个不同的碳原子上。
依据葡萄糖的组成和部分性质,认识葡萄糖的结构
实验 葡萄糖和新制的氢氧化铜反应
配制
氢氧化铜
加入葡萄糖溶液
生成绛蓝色溶液
甘油与新制氢氧化铜反应,生成绛蓝色溶液
乙醇与新制氢氧化铜反应,不出现绛蓝色
依据以上实验现象,推测葡萄糖结构中,具有怎样的结构?
葡萄糖具有与甘油相似的性质,推测其具有多个羟基
实验 葡萄糖和新制的氢氧化铜反应
推测葡萄糖具有醛基
得出葡萄糖的结构简式
依据葡萄糖的组成和部分性质,认识葡萄糖的结构
CHO
CH2OH
C
H
HO
C
OH
H
C
OH
H
C
OH
H
(CHOH)4
C
H
O
Ⅱ
CH2OH
多羟基醛
NaOH过量,加热煮沸
绛蓝色溶液
砖红色沉淀
活动3 实验验证葡萄糖的氧化反应
通过结构分析葡萄糖的化学性质,并进行实验验证
实验I ①葡萄糖的银镜反应
配制
银氨溶液
滴加
葡萄糖溶液
水浴加热
银镜
CH2OH(CHOH)4CHO + 2Ag(NH3)2OH
△
+ 2Ag↓+ 3NH3 + H2O
CH2OH(CHOH)4COONH4
② 葡萄糖和新制的氢氧化铜反应
CH2OH(CHOH)4CHO + 2Cu(OH)2 + NaOH
△
+ Cu2O↓ + 3H2O
CH2OH(CHOH)4COONa
(4)葡萄糖的结构特点
(5)化学性质
① 银镜反应
②与新制Cu(OH)2悬浊液反应
醛基
加成反应
CH2OH(CHOH)4CHO+H2
CH2OH(CHOH)4CH2OH
氧化反应
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
Ni
③ 与高锰酸钾、溴水等强氧化剂反应
④催化加氢
医学用于检验尿糖
羟基
⑥使高锰酸钾褪色
⑤ 与Na反应
⑦酯化反应
置换反应
氧化反应
取代反应
消去反应
⑧与HX反应
⑨分子间脱水
1mol葡萄糖完全酯化,参加反应的乙酸为5mol,证明葡萄糖分子中有5个羟基
(5)化学性质
⑩生理氧化
葡萄糖易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维持生命活动所需要的能量。低血糖的患者可利用静脉注射葡萄糖溶液的方式来迅速补充营养。
C6H12O6+ 6O2 6CO2 + 6H2O
酶
氧化反应
在体内生理反应
无氧分解生成乳酸
有氧时的氧化反应
分解生成乙醇(酿酒)
C6H12O6
2C2H5OH+2CO2↑
酒曲酶
C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)
CH2OH(CHOH)4CHO 2CH3CH(OH)COOH
(6)用途
①生活上-----糖类;
②工业上-----制镜;
③医药上-----迅速补充营养、制葡萄糖酸钙等。
营养物质
镀银工业
制药工业
制酒工业
小常识:尿糖的检验
出现红色沉淀:有大量Cu2O生成,尿液中葡萄糖含量较高,病情较重,用“++++”表示;
出现土黄色:含糖量为中等,用“+++”表示;
出现黄绿色:含糖量为少量,用“++”表示;
出现绿色:含糖量为微量,用“+”表示;
如仍保持原来的蓝色:证明尿液中不含葡萄糖,用“—”表示。
资料卡片
葡萄糖的环状结构
α D 吡喃葡萄糖
链状葡萄糖
β D 吡喃葡萄糖
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖中的单糖单元多以环状结构的形式存在。
2、果糖
阅读教材80页果糖,了解果糖的结构、存在和物理性质。
果糖在水果和蜂蜜中含量较高,它比蔗糖的甜度高,广泛应用于食品和医药的生产中, 最甜的糖
(1)分子式:
C6H12O6
(2)结构简式:
CH2OH-CHOH-CHOH-CHOH-CO-CH2OH
或CH2OH-(CHOH)3-CO-CH2OH
(3)官能团:
羟基:-OH
羰基:
-C-
O
Ⅱ
多羟基酮
(4)存在:
蜂蜜、水果中
(5)物理性质:
教材80页,无色晶体,熔点103~105℃,最甜的糖,不易结晶,通常为液体,易溶于水、乙醇和乙醚。
(6)化学性质:
羟基的性质,羰基的加成。
拓展提升
酮糖具有酮羰基,但在碱性条件下易转化为烯二醇中间体,它可异构化为醛式,所以酮糖也易被吐伦试剂、菲林试剂氧化。(碱性条件)
3.核糖与脱氧核糖
核糖与脱氧核糖分别是生物体的遗传物质 与 ______ _____的重要组成部分。
核糖核酸(RNA)
脱氧核糖核酸(DNA)
醛
二者都含有醛基,
均属于 糖,
均具有还原性,
属于 糖
它们都是含有5个碳原子的单糖——戊糖。
还原
核糖
脱氧核糖
4.糖类分子与手性
象人的两只手,由于五指的构型不同,左手和右手互为实物和镜像关系,但不能完全重叠,称为手性。
(1)手性碳原子:
在分子中连有4个不同的原子或原子团的碳原子叫做不对称碳原子,也叫手性碳原子。
例如:乳酸分子
CH3 C COOH
H
OH
*
的中间碳原子就是手性碳原子。
(2)手性分子:含有手性碳原子存在不能重叠、互为镜像的对映异构体的分子称手性分子:如 为手性分子。
H— C —OH
CHO
CH2—OH
L-甘油醛
HO—C —H
CHO
CH2—OH
它在空间的构型有两种:(呈镜像对称,但不能完全重叠。)
课堂小结
糖类
组成:
定义:
分类
C、H、O
多羟基醛,多羟基酮和它们的脱水缩合物
单糖:葡萄糖、果糖、核糖
低聚糖:麦芽糖、蔗糖、乳糖
多糖:淀粉、纤维素
葡萄糖
果糖:
CH2OH(CHOH )3COCH2OH
同分异构体
分子式:
结构简式:
官能团:
C6H12O6
CH2OH(CHOH )4CHO
醛基、醇羟基
化学性质
醛基的性质
醇羟基的性质
第四章 生物大分子
第一节 糖类
第2课时 二糖 多糖
三、二糖:
麦芽糖
C12H22O11
蔗糖
C12H22O11
1.定义:1mol糖能水解成2mol单糖。又叫双糖
乳糖
C12H22O11
它们互为同分异构体
1.蔗糖
蔗糖是最常用的甜味剂,也是在自然界中分布最广的二糖。
分子式:C12H22O11
存在于大多数植物体中(甘蔗、甜菜中含量最高)
生活中食用的白糖、冰糖、红糖的主要成分都是蔗糖。
1.蔗糖
⑴物理性质
无色晶体,熔点186℃,易溶于水,较难溶于乙醇。甜味仅次于果糖。
⑵化学性质
在酸或酶的作用下,可以水解生成葡萄糖和果糖
C6H12O6 + C6H12O6
酸或酶
C12H22O11 + H2O
葡萄糖 果糖
蔗糖
注意:糖类水解写的是分子式,必须在下面注明物质名称。
2.麦芽糖
分子式:C12H22O11
麦芽糖主要存在中发芽的谷粒和麦芽中,是淀粉水解过程中的一种中间产物
使用含淀粉酶的麦芽作用于淀粉可制得饴糖(麦芽糖)
发芽的小麦
2.麦芽糖
⑴物理性质
无色晶体,易溶于水,有甜味,但甜味不如蔗糖。
⑵化学性质
在酸或酶催化下,麦芽糖可以水解生成葡萄糖。
2 C6H12O6
酸或酶
C12H22O11 + H2O
葡萄糖
麦芽糖
探究1:
蔗糖、麦芽糖是否属于还原糖?怎样设计实验?
无砖红色沉淀
蔗糖分子无醛基,不属于还原糖
有砖红色沉淀生成
麦芽糖分子有醛基,属于还原糖
探究2:
蔗糖蔗糖的水解实验,怎样设计实验?
?
探究2:
蔗糖蔗糖的水解实验,怎样设计实验?
无明显现象
有砖红色沉淀生成
蔗糖
水解液
中和液
↓
1.麦芽糖主要存在于发芽的谷粒中,其α-D-(+)-麦芽糖的结构如图所示,下列相关说法中正确的是( )
A.麦芽糖是一种常见的寡糖
B.如图麦芽糖分子结构中无醛基,因此属于非还原糖
C.麦芽糖由一分子葡萄糖和一分子果糖脱水缩合形成
D.将麦芽糖水解液调至碱性后,可发生银镜反应,证明部分麦芽糖发生了水解
A
蔗糖 麦芽糖
相似性 ①组成相同,分子式均为C12H22O11,互为同分异构体; ②都属于二糖,1mol二糖水解后生成2mol单糖 不同点 官能团 不含醛基,是非还原糖 含有醛基,是还原糖
化学性质 不能与银氨溶液、新制Cu(OH)2反应 能与银氨溶液、新制Cu(OH)2反应
水解产物 葡萄糖和果糖 葡萄糖
蔗糖、麦芽糖总结:
四、多糖
四、多糖
淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连接组成的,属于天然有机高分子,淀粉的相对分子质量可达到几十万,纤维素可达到几百万。
淀粉和纤维素的分子式可以表示为(C6H10O5)n
其中的葡萄糖单元中一般仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n
但二者的n值不同,二者不是同分异构体。
1.淀粉
绿色植物光合作用的产物;
存在:植物种子或块根中,如大米、小麦、马铃薯等。
天然淀粉由直链淀粉和支链淀粉组成。支链淀粉含量很高的一些谷物,如糯米、糯玉米等有比较黏的口感。
①淀粉的物理性质:
白色粉末状物质,没有甜味,不溶于冷水。
在热水中淀粉会部分溶解,形成胶状的淀粉糊。
淀粉遇单质碘变蓝
淀粉
(C6H10O5)n
淀粉有直链淀粉和支链淀粉两类。前者为无分支的螺旋结构;后者以24~30个葡萄糖残基以α-1,4-糖苷键首尾相连而成,在支链处为α-1,6-糖苷键。
直链淀粉遇碘呈蓝色,支链淀粉遇碘呈紫红色。这并非是淀粉与碘发生了化学反应,产生相互作用,而是淀粉螺旋中央空穴恰能容下碘分子,通过范德华力,两者形成一种蓝黑色络合物。具有可逆热色性
实验证明,单独的碘分子不能使淀粉变蓝,实际上使淀粉变蓝的是碘分子离子。
②淀粉的化学性质:
●淀粉不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
●在淀粉中葡萄糖单元存在醇羟基,可以发生酯化反应。
●在酸或酶催化下,淀粉最终生成葡萄糖。
淀粉水解反应
淀粉水解反应
有砖红色沉淀生成
淀粉水解生成的葡萄糖,与新制的Cu(OH)2共热生成氧化亚铜(Cu2O)
(C6H10O5)n + nH2O
淀粉
n C6H12O6
葡萄糖
催化剂
思考:
滴加碘水
现象A
如何检验淀粉的水解程度?
银氨溶液
水浴加热
现象B
溶液变蓝色 未出现银镜
溶液变蓝色 出现银镜
溶液不变蓝色 出现银镜
淀粉尚未水解
淀粉部分水解
淀粉完全水解
③淀粉用途:
淀粉是食物的一种重要成分,也是重要的工业原料。以淀粉或淀粉水解生成的葡萄糖等为原料,经发酵可以得到多种产品,如燃料乙醇、白酒、食醋、味精,以及氨基酸、抗生素等药物。淀粉经酯化后可用于生产食品添加剂、表面活性剂和可降解塑料等。
2.纤维素
⑴自然界中分布最广泛的一种多糖,参与构成了植物的细胞壁,起着保护和支持作用。如自然界中的棉、麻、木材、秸秆中存在大量纤维素。
⑵物理性质:纤维素是白色纤维状物质,没有甜味,不溶于水,也不溶于一般的有机溶剂。
植物纤维素
(C6H10O5)n
⑶化学性质:
(C6H10O5)n + nH2O
纤维素
n C6H12O6
葡萄糖
酸或酶
2.纤维素
①在酸或酶催化下最终水解成葡萄糖
②不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
③纤维素的葡萄糖单元仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n,能发生酯化(或硝化)。
⑶化学性质:
2.纤维素
+ 3n CH3COOH
纤维素醋酸酯(俗称醋酸纤维)
3nH2O
+
③纤维素的葡萄糖单元仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n,能发生酯化(或硝化)。
⑶化学性质:
2.纤维素
+ 3n HO—NO2
纤维素硝酸酯(俗称硝酸纤维)
3nH2O
+
⑷用途:
2.纤维素
①棉和麻的纤维大量用于纺织工业。
②一些富含纤维素的物质,如木材、秸秆等是造纸的原料。
③用来制造纤维素硝酸酯、纤维素乙酸酯和黏胶纤维等。
通过纺丝而制成的再生纤维。
黏胶纤维中的长纤维一般称为人造丝,
短纤维称为人造棉
黏胶纤维是用木材、秸秆等富含纤维素的物质经化学处理后
淀粉、纤维素的化学性质比较
淀粉 纤维素
分子结构 分子通式 (C6H10O5)n 相对分子质量 几万到几十万 几十万到几百万
分子结 构关系 都是由葡萄糖结构单元(C6H10O5)构成的天然有机高分子,但分子内葡萄糖结构单元数目不同,分子结构不同 化学性质 共性 无还原性;水解最终生成葡萄糖。 特性 淀粉遇单质碘变蓝;分子中含有醇羟基,能与醋酸、硝酸等发生酯化反应 1.淀粉、纤维素的分子式均可表示为(C6H10O5)n,但二者的n值不同,二者不属于同分异构体。
易错提醒
2.蔗糖、淀粉、纤维素水解的催化剂为稀硫酸,在检验其水解产物之前需加NaOH溶液中和硫酸,因为葡萄糖与新制Cu(OH)2悬浊液、银氨溶液的反应都必须在碱性环境中进行。
3.糖类的结构式比较复杂,一般用分子式表示,为了区别,一般在分子式下面标上糖类的名称,防止混淆。
(1)可以用新制Cu(OH)2悬浊液鉴别蔗糖和葡萄糖( )
(2)淀粉水解的最终产物为二氧化碳和水( )
(3)淀粉和纤维素在人体内都能被消化和吸收( )
(4)可以用碘水检验淀粉的存在( )
(5)为检验淀粉的水解产物,可向水解后的溶液中加入新制Cu(OH)2悬浊液,加热,如没有砖红色沉淀,则没有葡萄糖生成( )
(6)富含纤维素的生物质在生产中可生产燃料乙醇( )
判断正误
×
×
×
√
√
√
1.某学生设计了如下实验方案用以检验淀粉水解的情况:
下列结论正确的是( )
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
D.淀粉已发生水解,但不知是否完全水解
D
2.糖类是生命的基础能源,关于糖类的说法中,正确的是
A.糖类都可以水解
B.糖类是具有甜味的物质
C.糖类都含有C、H、O元素
D.糖类都符合Cn(H2O)m的通式
3.葡萄糖(C6H12O6)是一种重要的营养物质,下列关于葡萄糖的说法正确的是
A.葡萄糖是一种单糖
B.葡萄糖分子中有6个碳原子、6个水分子
C.常温下,葡萄糖可与新制的氢氧化铜悬浊液反应
D.1 mol葡萄糖完全燃烧需要9 mol氧气
4.近几年一种新型的甜味剂木糖醇悄悄地进入人们的视野,木糖醇是一种理想的蔗糖替代品,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者食用的优点。木糖醇是一种白色粉末状的晶体,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH。下列有关木糖醇的叙述中不正确的是
A.木糖醇与葡萄糖、果糖等一样,
属于多羟基醛或酮,是一种单糖
B.木糖醇可发生取代反应
C.木糖醇是一种五元醇
D.木糖醇是一种无糖型甜味剂
1
2
3
5
4
6
5.以淀粉为基本原料可制备许多物质,如
下列有关说法中正确的是
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
不如意的时候不要尽往悲伤里钻,想想有笑声的日子吧!
