镁 铝及其化合物
图片预览

文档简介
化学学科复习导学学案
-------------镁 铝及其化合物
知识点一
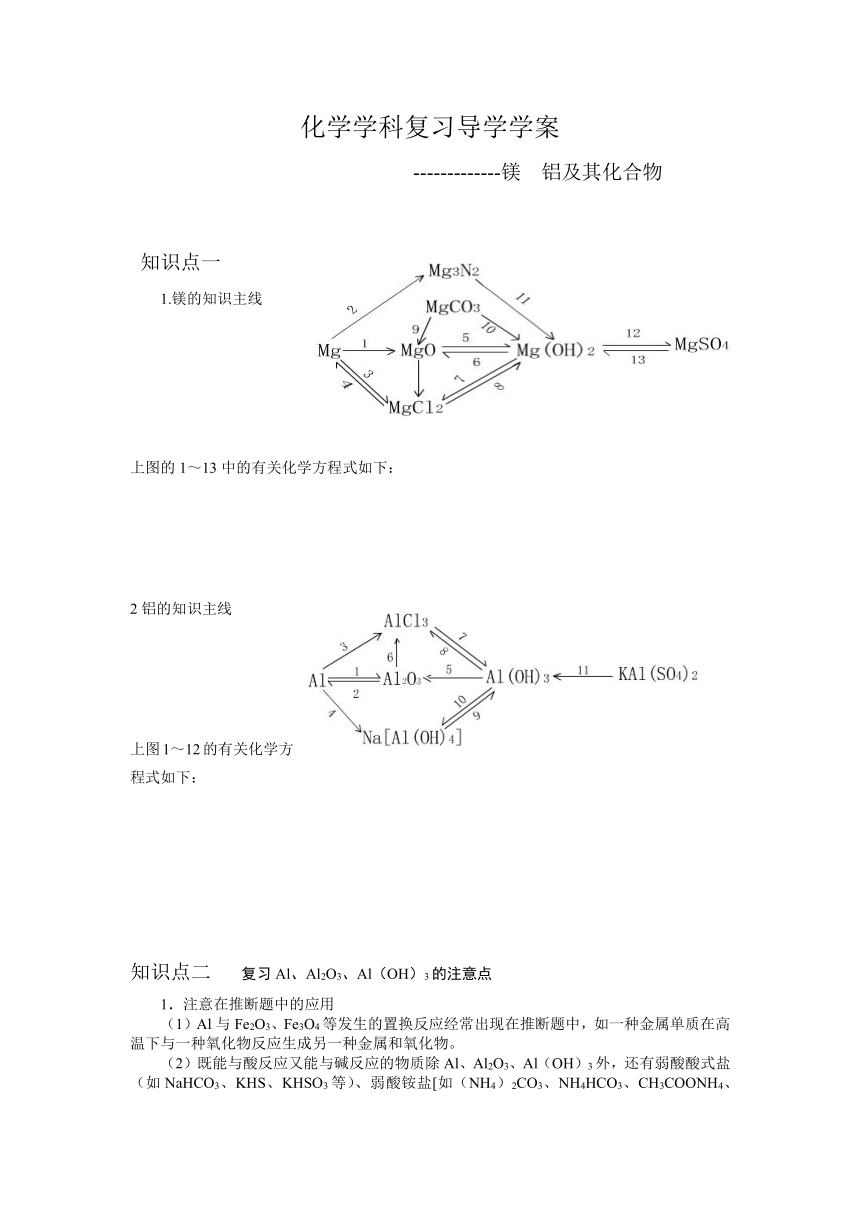
1.镁的知识主线
上图的1~13中的有关化学方程式如下:
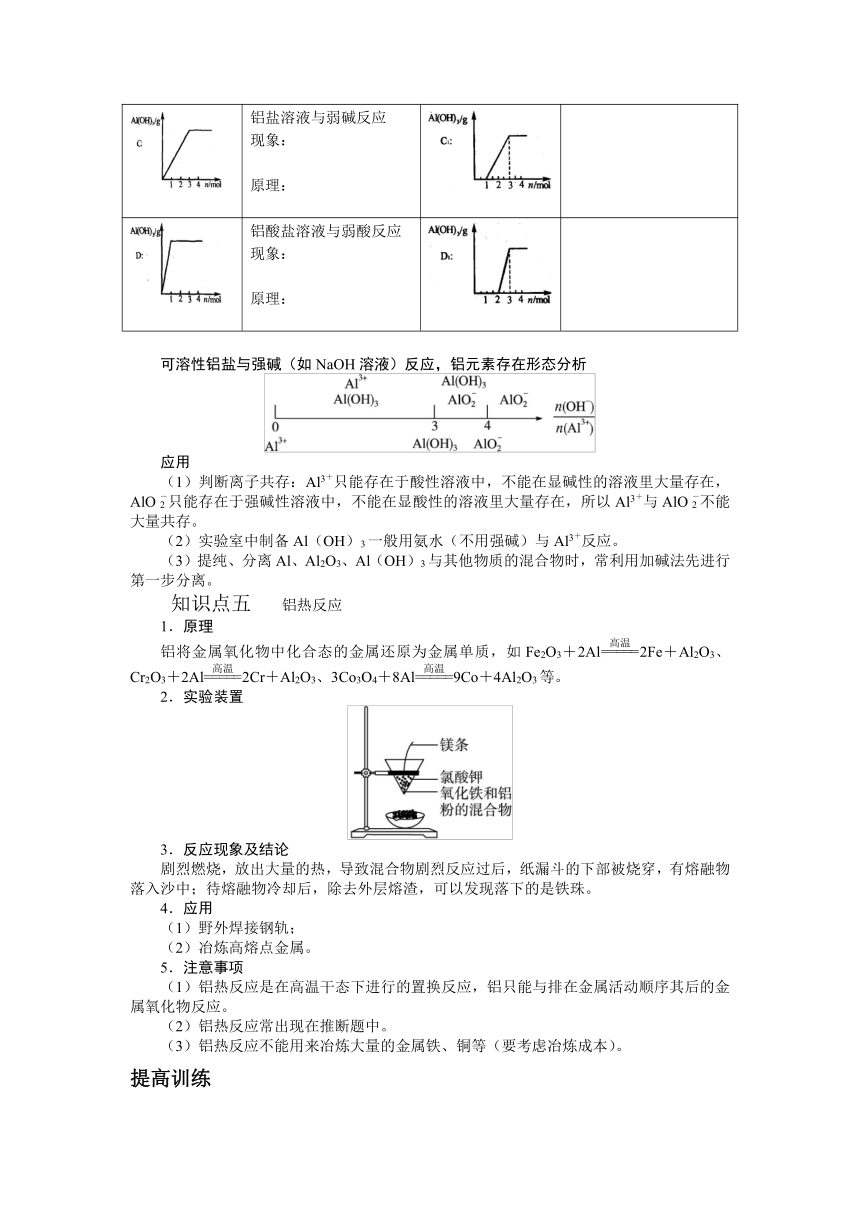
2铝的知识主线
上图1~12的有关化学方程式如下:
知识点二 复习Al、Al2O3、Al(OH)3的注意点
1.注意在推断题中的应用
(1)Al与Fe2O3、Fe3O4等发生的置换反应经常出现在推断题中,如一种金属单质在高温下与一种氧化物反应生成另一种金属和氧化物。
(2)既能与酸反应又能与碱反应的物质除Al、Al2O3、Al(OH)3外,还有弱酸酸式盐(如NaHCO3、KHS、KHSO3等)、弱酸铵盐[如(NH4)2CO3、NH4HCO3、CH3COONH4、(NH4)2S等]等。
2.注意在计算题中的应用
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1 mol Al不论与H+反应还是与OH-反应均生成3 g( mol)H2。
不同点:1 mol Al与H+反应消耗3 mol H+,而与OH-反应只消耗1 mol OH-,所以含有等物质的量溶质的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。
3.Al、Al2O3、Al(OH)3与酸碱反应的共同点
Al3+AlO
Al、Al2O3、Al(OH)3既溶于酸又溶于强碱溶液,与酸反应均生成Al3+,且每生成1 mol Al3+均耗3 mol H+;与碱反应均生成AlO,且每生成1 mol AlO均耗1 mol OH-,记住上述关系,书写有关离子方程式就比较容易。
4.注意酸碱性强弱
Al2O3、Al(OH)3与强酸或强碱反应,但不溶于CO2水溶液或氨水。
知识点三 “铝三角”的转化关系
知识点四 镁、铝的图像
基本坐标图像 实验现象及反应原理 衍生坐标图像 化学反应原理
铝盐溶液与强碱反应现象:原理:
铝酸盐溶液与强酸反应现象:原理:
铝盐溶液与弱碱反应现象:原理:
铝酸盐溶液与弱酸反应现象:原理:
可溶性铝盐与强碱(如NaOH溶液)反应,铝元素存在形态分析
应用
(1)判断离子共存:Al3+只能存在于酸性溶液中,不能在显碱性的溶液里大量存在,AlO只能存在于强碱性溶液中,不能在显酸性的溶液里大量存在,所以Al3+与AlO不能大量共存。
(2)实验室中制备Al(OH)3一般用氨水(不用强碱)与Al3+反应。
(3)提纯、分离Al、Al2O3、Al(OH)3与其他物质的混合物时,常利用加碱法先进行第一步分离。
知识点五 铝热反应
1.原理
铝将金属氧化物中化合态的金属还原为金属单质,如Fe2O3+2Al2Fe+Al2O3、Cr2O3+2Al2Cr+Al2O3、3Co3O4+8Al9Co+4Al2O3等。
2.实验装置
3.反应现象及结论
剧烈燃烧,放出大量的热,导致混合物剧烈反应过后,纸漏斗的下部被烧穿,有熔融物落入沙中;待熔融物冷却后,除去外层熔渣,可以发现落下的是铁珠。
4.应用
(1)野外焊接钢轨;
(2)冶炼高熔点金属。
5.注意事项
(1)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动顺序其后的金属氧化物反应。
(2)铝热反应常出现在推断题中。
(3)铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
提高训练
1 。下列图像表示Al3+与AlO物质的量变化的曲线,实线表示Al3+,虚线表示AlO,其中正确的是( )。
2 。 下列各组物质,不能按(“―→”表示反应一步完成)关系转化的是( )。
选项 a b c
A Al2O3 NaAlO2 Al(OH)3
B AlCl3 Al(OH)3 NaAlO2
C Al Al(OH)3 Al2O3
D MgCl2 Mg(OH)2 MgO
3.某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的CO、HCO、AlO、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )。
A.原混合溶液中的CO与AlO的物质的量之比为1∶2
B.V1∶V2=1∶5
C.M点时生成的CO2为0.05 mol
D.a曲线表示的离子方程式为:AlO+H++H2O===Al(OH)3↓
4 现有0.1mol·L-1的AlCl3溶液和0.1mol·L-1的NaOH溶液,进行下面的实验。
(1)在试管中盛有上述AlCl3溶液10mL,向其中逐渐滴入上述的NaOH溶液。
①加入10mlNaOH溶液时的现象是 ;加入30mLNaOH溶液时的现象是 ;加入35mlNaOH溶液时的现象是 。
②生成沉淀质量最多时,需NaOH溶液 mL。
(2)向盛有10mLNaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象是 ,至加入 mLAlCl3溶液时开始出现沉淀,至加入 mLAlCl3溶液产生沉淀达最大值。写出上述过程的离子方程式 。
答案
2Mg+O2=2MgO
3Mg+N2 === Mg3N2
Mg+Cl2 ==== MgCl2、Mg+2HCl=MgCl2+H2↑
MgCl2 ==== Mg+Cl2↑
MgO+H2O === Mg(OH)2
Mg(OH)2 === MgO+H2O
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCO3===MgO+CO2↑
MgCO3+H2O===Mg(OH)2+CO2↑
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg(OH)2+H2SO4=MgSO4+2H2O
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
4Al + 3O2 =2Al2O3
2Al2O3 ==== 4Al +3O2↑
2Al + 6HCl = 2AlCl3 +3H2↑
2Al + 2NaOH + 6H2O= 2Na[Al(OH)4] +3H2↑
2Al(OH)3 ====Al2O3 + 3H2O
Al2O3 +6HCl =2AlCl3 + 3H2O
AlCl3 +3NH3·H2O + Al(OH)3↓ +3NH4Cl
Al(OH)3 +3HCl = AlCl3 + 3H2O
Na[Al(OH)] + CO2 = Al(OH)3↓ + NaHCO3
Al(OH)3 +NaOH = NA[Al(OH)4]
2KAl(SO4)2 + 6NH3·H2O = 2Al(OH)3↓ + K2SO4 +3(NH4)2SO4
镁、铝的图像
基本坐标图像 实验现象及反应原理 衍生坐标图像 化学反应原理
铝盐溶液与强碱反应现象:先产生沉淀,后沉淀消失。原理:Al3++3OH–Al(OH)3 ↓
铝酸盐溶液与强酸反应现象:沉淀不断增多,而后沉淀溶解。原理:Al(OH)3+3H+=Al3++3H2O
铝盐溶液与弱碱反应现象:产生沉淀。原理:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
铝酸盐溶液与弱酸反应现象:产生沉淀。原理:[Al(OH)4]+CO2=Al(OH)3↓+HCO3
1B 2C 3D 4 (1)①逐渐生成白色胶状沉淀;沉淀量达到最大值;沉淀溶解一半。②30
(2)开始看不出有沉淀;2.5;10/3;
Al3++3OH-=Al(OH)3↓ Al3++4OH-=AlO2-+2H2O
6H2O+Al3++3AlO2-=4Al(OH)3↓
点燃
点燃
熔融
△
电解
△
△
△
熔融
电解
加热
-------------镁 铝及其化合物
知识点一
1.镁的知识主线
上图的1~13中的有关化学方程式如下:
2铝的知识主线
上图1~12的有关化学方程式如下:
知识点二 复习Al、Al2O3、Al(OH)3的注意点
1.注意在推断题中的应用
(1)Al与Fe2O3、Fe3O4等发生的置换反应经常出现在推断题中,如一种金属单质在高温下与一种氧化物反应生成另一种金属和氧化物。
(2)既能与酸反应又能与碱反应的物质除Al、Al2O3、Al(OH)3外,还有弱酸酸式盐(如NaHCO3、KHS、KHSO3等)、弱酸铵盐[如(NH4)2CO3、NH4HCO3、CH3COONH4、(NH4)2S等]等。
2.注意在计算题中的应用
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1 mol Al不论与H+反应还是与OH-反应均生成3 g( mol)H2。
不同点:1 mol Al与H+反应消耗3 mol H+,而与OH-反应只消耗1 mol OH-,所以含有等物质的量溶质的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。
3.Al、Al2O3、Al(OH)3与酸碱反应的共同点
Al3+AlO
Al、Al2O3、Al(OH)3既溶于酸又溶于强碱溶液,与酸反应均生成Al3+,且每生成1 mol Al3+均耗3 mol H+;与碱反应均生成AlO,且每生成1 mol AlO均耗1 mol OH-,记住上述关系,书写有关离子方程式就比较容易。
4.注意酸碱性强弱
Al2O3、Al(OH)3与强酸或强碱反应,但不溶于CO2水溶液或氨水。
知识点三 “铝三角”的转化关系
知识点四 镁、铝的图像
基本坐标图像 实验现象及反应原理 衍生坐标图像 化学反应原理
铝盐溶液与强碱反应现象:原理:
铝酸盐溶液与强酸反应现象:原理:
铝盐溶液与弱碱反应现象:原理:
铝酸盐溶液与弱酸反应现象:原理:
可溶性铝盐与强碱(如NaOH溶液)反应,铝元素存在形态分析
应用
(1)判断离子共存:Al3+只能存在于酸性溶液中,不能在显碱性的溶液里大量存在,AlO只能存在于强碱性溶液中,不能在显酸性的溶液里大量存在,所以Al3+与AlO不能大量共存。
(2)实验室中制备Al(OH)3一般用氨水(不用强碱)与Al3+反应。
(3)提纯、分离Al、Al2O3、Al(OH)3与其他物质的混合物时,常利用加碱法先进行第一步分离。
知识点五 铝热反应
1.原理
铝将金属氧化物中化合态的金属还原为金属单质,如Fe2O3+2Al2Fe+Al2O3、Cr2O3+2Al2Cr+Al2O3、3Co3O4+8Al9Co+4Al2O3等。
2.实验装置
3.反应现象及结论
剧烈燃烧,放出大量的热,导致混合物剧烈反应过后,纸漏斗的下部被烧穿,有熔融物落入沙中;待熔融物冷却后,除去外层熔渣,可以发现落下的是铁珠。
4.应用
(1)野外焊接钢轨;
(2)冶炼高熔点金属。
5.注意事项
(1)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动顺序其后的金属氧化物反应。
(2)铝热反应常出现在推断题中。
(3)铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
提高训练
1 。下列图像表示Al3+与AlO物质的量变化的曲线,实线表示Al3+,虚线表示AlO,其中正确的是( )。
2 。 下列各组物质,不能按(“―→”表示反应一步完成)关系转化的是( )。
选项 a b c
A Al2O3 NaAlO2 Al(OH)3
B AlCl3 Al(OH)3 NaAlO2
C Al Al(OH)3 Al2O3
D MgCl2 Mg(OH)2 MgO
3.某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的CO、HCO、AlO、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )。
A.原混合溶液中的CO与AlO的物质的量之比为1∶2
B.V1∶V2=1∶5
C.M点时生成的CO2为0.05 mol
D.a曲线表示的离子方程式为:AlO+H++H2O===Al(OH)3↓
4 现有0.1mol·L-1的AlCl3溶液和0.1mol·L-1的NaOH溶液,进行下面的实验。
(1)在试管中盛有上述AlCl3溶液10mL,向其中逐渐滴入上述的NaOH溶液。
①加入10mlNaOH溶液时的现象是 ;加入30mLNaOH溶液时的现象是 ;加入35mlNaOH溶液时的现象是 。
②生成沉淀质量最多时,需NaOH溶液 mL。
(2)向盛有10mLNaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象是 ,至加入 mLAlCl3溶液时开始出现沉淀,至加入 mLAlCl3溶液产生沉淀达最大值。写出上述过程的离子方程式 。
答案
2Mg+O2=2MgO
3Mg+N2 === Mg3N2
Mg+Cl2 ==== MgCl2、Mg+2HCl=MgCl2+H2↑
MgCl2 ==== Mg+Cl2↑
MgO+H2O === Mg(OH)2
Mg(OH)2 === MgO+H2O
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCO3===MgO+CO2↑
MgCO3+H2O===Mg(OH)2+CO2↑
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg(OH)2+H2SO4=MgSO4+2H2O
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
4Al + 3O2 =2Al2O3
2Al2O3 ==== 4Al +3O2↑
2Al + 6HCl = 2AlCl3 +3H2↑
2Al + 2NaOH + 6H2O= 2Na[Al(OH)4] +3H2↑
2Al(OH)3 ====Al2O3 + 3H2O
Al2O3 +6HCl =2AlCl3 + 3H2O
AlCl3 +3NH3·H2O + Al(OH)3↓ +3NH4Cl
Al(OH)3 +3HCl = AlCl3 + 3H2O
Na[Al(OH)] + CO2 = Al(OH)3↓ + NaHCO3
Al(OH)3 +NaOH = NA[Al(OH)4]
2KAl(SO4)2 + 6NH3·H2O = 2Al(OH)3↓ + K2SO4 +3(NH4)2SO4
镁、铝的图像
基本坐标图像 实验现象及反应原理 衍生坐标图像 化学反应原理
铝盐溶液与强碱反应现象:先产生沉淀,后沉淀消失。原理:Al3++3OH–Al(OH)3 ↓
铝酸盐溶液与强酸反应现象:沉淀不断增多,而后沉淀溶解。原理:Al(OH)3+3H+=Al3++3H2O
铝盐溶液与弱碱反应现象:产生沉淀。原理:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
铝酸盐溶液与弱酸反应现象:产生沉淀。原理:[Al(OH)4]+CO2=Al(OH)3↓+HCO3
1B 2C 3D 4 (1)①逐渐生成白色胶状沉淀;沉淀量达到最大值;沉淀溶解一半。②30
(2)开始看不出有沉淀;2.5;10/3;
Al3++3OH-=Al(OH)3↓ Al3++4OH-=AlO2-+2H2O
6H2O+Al3++3AlO2-=4Al(OH)3↓
点燃
点燃
熔融
△
电解
△
△
△
熔融
电解
加热
