2022-2023学年上学期高一化学人教版(2019)必修第一册第三章第二节 金属材料课件(共3课时)(67张ppt)
文档属性
| 名称 | 2022-2023学年上学期高一化学人教版(2019)必修第一册第三章第二节 金属材料课件(共3课时)(67张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-12 15:28:26 | ||
图片预览











文档简介
(共67张PPT)
2019人教版
第三章 铁 金属材料
第二节 金属材料
第一课时 合 金
学习目标
1.金属具有许多共同的物理性质,如不透明、有金属光泽、易导电、易导热、有延展性。
2.生产、生活中应用较多的合金是生铁和钢,历史上应用最早的金属是铜。
课前自主学习
提前下发预习问题,让学生自主学习,完成下列内容,并把问题
归纳整理,交给课代表。
二、合金的概念和特性
一、金属 的共性
【微思考1】为什么合金硬度比成分金属大
提示:纯金属所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金硬度变大。
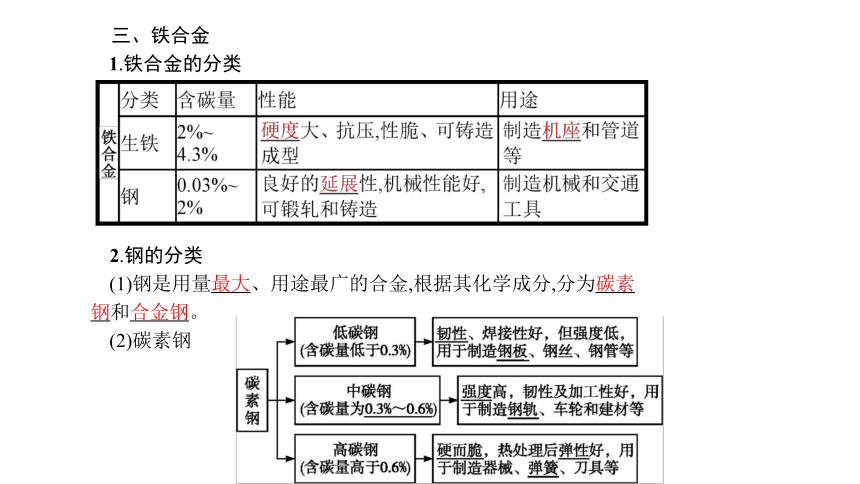
三、铁合金
1.铁合金的分类
2.钢的分类
(1)钢是用量最大、用途最广的合金,根据其化学成分,分为碳素钢和合金钢。
(2)碳素钢
(3)合金钢
①又叫特种钢,特殊性能:强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等。
②不锈钢
四、铝和铝合金
1.铝单质
(1)与氧气反应:铝较活泼,常温下就能与空气中的氧气反应,表面生成一层致密的氧化铝薄膜。
【微思考2】铝是一种活泼金属,为何铝制品可在空气中稳定存在
(2)与酸(盐酸)反应:2Al+6HCl=2AlCl3+3H2↑。
(3)与强碱(NaOH)溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
提示铝制品表面覆盖着致密的氧化铝薄膜,这层膜起到保护内部金属的作用。
2.氧化铝
(1)与酸(盐酸)反应:Al2O3+6HCl=2AlCl3+3H2O。
(2)与强碱(NaOH)溶液反应:Al2O3+2NaOH=2NaAlO2+H2O。
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3。
【微思考3】
(1)日常生活中铝制餐具能否用来长期存放酸性或碱性食物
提示不能,因Al和Al2O3均能与酸、碱反应。
提示多数金属氧化物属于碱性氧化物,如Na2O、CaO等;少数金属氧化物属于两性氧化物,如Al2O3、ZnO等,个别金属氧化物属于酸性氧化物,如Mn2O7。
(2)金属氧化物与碱性氧化物、酸性氧化物、两性氧化物间有何关系
3.铝合金
(1)铝合金中的合金元素有Cu、Mg、Si、Mn、Zn及稀土元素等。
(2)硬铝
(3)稀土元素
包含元素:镧系元素(从镧到镥,原子序数从57~71的15种元素)及钪、钇共17种元素。
【微思考4】稀土元素为何被称为“冶金工业的维生素”
提示在合金中加入适量稀土金属,能大大改善合金的性能。
四、新型合金
1.新型合金:储氢合金、钛合金、耐热合金(如由镍、铁、碳和钴组成的镍钴合金等)和形状记忆合金等。
2.储氢合金:是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。
1.合金的组成及性质
(1)合金中一定含有金属元素,可能含有非金属元素。
(2)合金是混合物,没有固定的熔点。
(3)合金具有金属特性,如导电、传热等。
(4)合金形成后会影响各成分金属的物理性质,如合金的熔点一般比成分金属低,而硬度、机械强度一般比成分金属高;但一般来说各成分金属均保持了其原有的化学性质。
课堂重难解疑
问题一 合金的组成、性质及作用
2.合金的形成条件
(1)金属与金属形成合金时:合金是金属在熔化状态时相互混合形成的,熔化时的温度需达到成分金属中熔点最高的金属的熔点,但又不能超出成分金属中沸点最低的金属的沸点。一种金属的熔点高于另一种金属的沸点时则不能形成合金。
(2)金属与非金属形成合金时:部分不活泼非金属与金属可形成合金,活泼非金属与活泼金属则不能形成合金
3.金属材料选择的依据
某种金属能不能成为一种应用广泛的材料主要取决于该金属的储量、冶炼成本、市场价格以及所具有的性能和是否易于加工等。
(2)化学性质:对水的作用、耐腐蚀性等,这些性质决定金属材料的日常维护和环境对其的影响。
(1)物理性质:密度、硬度、强度、导电性和导热性等,这些性质决定金属材料的加工难易程度。
(1)列举生活中的合金材料,并简述选择该材料时利用了该合金的哪些优异性能。
提示:①铝合金门窗:质轻、耐腐蚀;②易拉罐:质轻、易回收利用。
(2)为什么航空工业中铝合金比铁合金应用更广泛
提示:铝合金比铁合金密度小且耐高温、耐腐蚀。
思考讨论
课堂重难解疑
问题二 常见的几种合金
1.合金钢
2.铜合金
3.铝合金
4.钛合金
2019年1月3日上午10点26分,中国嫦娥四号探测器成功在月球背面软着陆,成为人类首次在月球背面软着陆的探测器。玉兔二号月球车实现了对月球背面的巡视。
情景思考
(1)月球在白天时的地面温度高达150度,而到了夜晚,温度又跌落到零下180度!嫦娥四号探测器、玉兔二号月球车均使用了大量合金材料,试分析这些合金材料应具有哪些性质。
提示:密度小、强度大、既耐高温又耐低温等。
(2)形状记忆合金是一种在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前原始形状的合金材料。中国嫦娥四号探测器,使用了记忆合金制作天线,试分析其好处。
提示:嫦娥四号探测器天线使用记忆合金制作,天线折叠起来装进探测器内,工作时只需加温,折叠的卫星天线因具有“记忆”功能而自然展开,恢复设计形状。
课堂重难解疑
问题三、铝与盐酸、NaOH溶液反应比较
【实验探究】铝分别与盐酸、NaOH溶液反应的对比实验
1.铝与酸、碱、盐溶液反应的实质
(1)厨房中能够用铝制容器长时间存放食醋吗
提示:不能。铝能与醋酸反应。
(2)如何除去镁粉中的铝粉
提示将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
(3)等量的铝分别与足量的稀盐酸、氢氧化钠溶液反应,生成氢气的量有什么关系
提示相同。
(4)等浓度、等体积的NaOH溶液和稀盐酸与足量铝反应,生成H2的质量有什么关系
提示3∶1。
(4)Al与等浓度的NaOH溶液、稀盐酸反应生成等质量的H2,所需NaOH溶液、稀盐酸的体积比为多少
提示1∶3。
思考讨论
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量之比为3∶1。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶3。
分析下列两个反应:2Al+6H+====2Al3++3H2↑ (1)
2Al+2OH-+2H2O====2Al +3H2↑ (2)
2.铝与盐酸或氢氧化钠溶液反应中四种“量”的关系
4.一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为1∶3②铝与氢氧化钠溶液反应,铝不足而氢氧化钠溶液过量。
1.铝既能与非氧化性酸反应产生氢气,也能与碱反应产生氢气,前者是置换反应,后者不是置换反应。
2.铝与盐酸、氢氧化钠的反应中,还原剂都是铝,还原产物都是氢气,故铝与产生氢气的关系式是相同的。
【注意】
甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL 4.0 mol·L-1 的NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为 ( )
A.1∶1 B.2∶3 C.3∶2 D.3∶1
典例解析
【解析】选B。甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 mol,根据化学方程式2Al+6HCl==== 2AlCl3+3H2↑、2Al+2NaOH+2H2O====2NaAlO2+3H2↑可知,5.4 g(即0.2 mol)Al分别与盐酸和NaOH溶液反应时,盐酸不足量而NaOH过量,故Al与盐酸反应生成H2 0.2 mol,与NaOH溶液反应生成H2 0.3 mol,其体积比为2∶3。
1)如果将两份各5.4 g的铝粉分别加入足量的盐酸和NaOH溶液,在相同状况下产生气体的体积比是多少
提示:1∶1。
2)如果题目中盐酸浓度是2.0 mol·L-1,在相同状况下产生气体的体积比是多少
提示:1∶3。
【母题追问】
达标检测2.有资料显示,铝元素在人体内的残留积累量过多后对大脑发育有不良影响,建议多用不锈钢代替铝合金作为材料制作餐厨等日用品。下列说法中不正确的是( )
A.不锈钢中含有铁元素、镍元素、铬元素
B.不锈钢属于铁合金
C.不锈钢是无腐蚀性的
D.不锈钢是绝对不能被腐蚀的
解析D 不锈钢是含有镍、铬元素的铁合金,主要成分是铁。不锈钢本身无腐蚀性,耐腐蚀性也很强,但不锈钢也并不是绝对不能被腐蚀的。
3.对于铝和烧碱溶液的反应,下列说法不正确的是( )
A.铝是还原剂
B.该反应是氧化还原反应
C.该反应说明所有金属都能与碱反应
D.H2为还原产物
解析C
铝与烧碱溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,分析元素化合价变化可知反应为氧化还原反应,铝是还原剂,H2为还原产物,A、B、D正确。铝能与烧碱溶液反应,并不能说明所有金属都能与碱反应,如镁、铁、铜等均不与碱溶液反应。
课堂小结
2019人教版
第三章 铁 金属材料
第二节 金属材料
第一课时 物质的量在化学方程式 计算中的应用(一)
学习目标
课前自主预习
一、物质的量与各物理量之间的关系
1.图示关系
2.计算公式
(1)已知物质的质量:n(B)=_______;
(2)已知标准状况时的气体体积:n(B)=_________;
(3)已知物质的粒子数:n(B)=_______;
(4)已知溶液中的物质的量浓度:n(B)= _______________。
c(B)·V[B(aq)]
2∶1∶2
2∶1∶2
2∶1∶2
2∶1∶2
物质的量
体积
1 mol H2与1 mol Cl2在点燃的条件下完全反
应生成2 mol HCl
2Na + 2H2O====2NaOH + H2↑
计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
物质的量之比: 2 mol∶2 mol ∶ 2 mol ∶ 1 mol
质量之比: 46 g ∶ 36 g ∶ 80 g ∶ 2 g
课堂重难解疑
结论:化学方程式中化学计量数之比等于_________之比,
也等于_________之比,对于有气体参与的反应还等于_____之比。
粒子个数
物质的量
体积
进一步加深理解
问题一、化学方程式中化学计量数与各化学计量间的关系
2.计算类型
观察下面的化学方程式,及各物质对应的物理量,思考并回答相关问题。
2Na + 2H2O====2NaOH + H2↑
2×23 g 2 mol 2 mol 22.4 L
m(Na) n(H2O) n(NaOH) V(H2)
则有
思考讨论
(2)上述反应是在常温常压下发生的吗 说明你的判断理由。
提示:不是。因为在计算中1 mol氢气的体积是22.4 L,说明一定不是在常温常压下进行的。
(1)为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一
提示:同一种物质用不同的物理量表示时,比例是相同的。例如1 mol钠和23 g钠完全相同。
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
问题三、计算过程中的注意事项
(2)单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据不足量的物质进行计算。
活学活用,素养提升
达标检测
1.0.56 g氧化钙恰好与20 mL盐酸反应,则此盐酸的物质的量浓度是 ( )
A.0.10 mol·L-1 B.0.20 mol·L-1
C.0.50 mol·L-1 D.1.00 mol·L-1
【解析】选D。CaO+2HCl====CaCl2+H2O
56 g 2 mol
0.56 g c(HCl)×20×10-3 L
则: 解得c(HCl)=1.00 mol·L-1。
课堂小结
2019人教版
第三章 铁 金属材料
第二节 金属材料
第一课时 物质的量在化学方程式 计算中的应用(二)
学习目标
化学计算的常用方法重点解析1.关系式法——解答连续反应类型计算题的捷径 典例解析
【典例2】硫黄制硫酸时发生的反应有
S+O2 == SO2 2SO2+O2 === 2SO3
SO3+H2O====H2SO4
由硫黄制取硫酸的关系式是________。假设64 g硫黄完全反应,可制取硫酸的质量是________。
【解析】据题中化学方程式(或根据硫原子守恒)可关系式S~H2SO4。制取硫酸的质量为 ×98 g· mol-1=196 g。
答案:S~H2SO4 196 g
2.差量法——化学方程式计算中的巧思妙解
【典例4】已知:①碳酸钠高温下不分解;②碳酸氢钠受
热发生分解反应:2NaHCO3 Na2CO3+H2O+CO2↑。充
分加热碳酸钠和碳酸氢钠的混合物19 g,完全反应后固
体质量减轻了3.1 g,求
(1)原混合物中碳酸钠的质量是________ g。
(2)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)是________ L。
【解析】(1)设混合物中碳酸氢钠的质量为m,则:
2NaHCO3 Na2CO3+H2O+CO2↑ Δm
168 g 106 g 62 g
m 3.1 g
故m= ×168 g=8.4 g, 则碳酸钠的质量为19 g-8.4 g=10.6 g。
(2)剩余固体为碳酸钠,质量为19 g-3.1 g=15.9 g,物质的量为 =0.15 mol,根据碳原子守恒可知,生成二氧化碳的物质的量为0.15 mol,标准状况下的体积为0.15 mol×22.4 L·mol-1=3.36 L 。
答案:(1)10.6 (2)3.36
1).质量守恒:反应前后元素质量、原子个数不变。
2).得失电子守恒:还原剂失电子总数=氧化剂得电子总数。
3).电荷守恒:阳离子所带正电荷总数=阴离子所带负电荷总数。
3.守恒法-----守恒思想在化学方程式计算中的巧用
【典例5】在体积为V L的密闭容器中通入a mol一氧化碳和b mol 氧气,点燃充分反应后容器内碳原子与氧原子
数之比为 ( )
A.a∶b B.a∶2b
C.a∶(a+2b) D.a∶[2(a+b)]
【解析】选C。根据反应前后原子守恒可知,n(C)∶n(O) =a∶(a+2b)。
【典例6】 0.3 mol氯气和足量的金属M反应,生成0.2 mol MCln,则n等于 ( )
A.1 B.2 C.3 D.4
【解析】选C。根据氯原子守恒,可知0.3 mol Cl2和0.2 mol MCln均含0.6 mol Cl。
达标检测
达标检测课堂小结
2019人教版
第三章 铁 金属材料
第二节 金属材料
第一课时 合 金
学习目标
1.金属具有许多共同的物理性质,如不透明、有金属光泽、易导电、易导热、有延展性。
2.生产、生活中应用较多的合金是生铁和钢,历史上应用最早的金属是铜。
课前自主学习
提前下发预习问题,让学生自主学习,完成下列内容,并把问题
归纳整理,交给课代表。
二、合金的概念和特性
一、金属 的共性
【微思考1】为什么合金硬度比成分金属大
提示:纯金属所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金硬度变大。
三、铁合金
1.铁合金的分类
2.钢的分类
(1)钢是用量最大、用途最广的合金,根据其化学成分,分为碳素钢和合金钢。
(2)碳素钢
(3)合金钢
①又叫特种钢,特殊性能:强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等。
②不锈钢
四、铝和铝合金
1.铝单质
(1)与氧气反应:铝较活泼,常温下就能与空气中的氧气反应,表面生成一层致密的氧化铝薄膜。
【微思考2】铝是一种活泼金属,为何铝制品可在空气中稳定存在
(2)与酸(盐酸)反应:2Al+6HCl=2AlCl3+3H2↑。
(3)与强碱(NaOH)溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
提示铝制品表面覆盖着致密的氧化铝薄膜,这层膜起到保护内部金属的作用。
2.氧化铝
(1)与酸(盐酸)反应:Al2O3+6HCl=2AlCl3+3H2O。
(2)与强碱(NaOH)溶液反应:Al2O3+2NaOH=2NaAlO2+H2O。
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3。
【微思考3】
(1)日常生活中铝制餐具能否用来长期存放酸性或碱性食物
提示不能,因Al和Al2O3均能与酸、碱反应。
提示多数金属氧化物属于碱性氧化物,如Na2O、CaO等;少数金属氧化物属于两性氧化物,如Al2O3、ZnO等,个别金属氧化物属于酸性氧化物,如Mn2O7。
(2)金属氧化物与碱性氧化物、酸性氧化物、两性氧化物间有何关系
3.铝合金
(1)铝合金中的合金元素有Cu、Mg、Si、Mn、Zn及稀土元素等。
(2)硬铝
(3)稀土元素
包含元素:镧系元素(从镧到镥,原子序数从57~71的15种元素)及钪、钇共17种元素。
【微思考4】稀土元素为何被称为“冶金工业的维生素”
提示在合金中加入适量稀土金属,能大大改善合金的性能。
四、新型合金
1.新型合金:储氢合金、钛合金、耐热合金(如由镍、铁、碳和钴组成的镍钴合金等)和形状记忆合金等。
2.储氢合金:是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。
1.合金的组成及性质
(1)合金中一定含有金属元素,可能含有非金属元素。
(2)合金是混合物,没有固定的熔点。
(3)合金具有金属特性,如导电、传热等。
(4)合金形成后会影响各成分金属的物理性质,如合金的熔点一般比成分金属低,而硬度、机械强度一般比成分金属高;但一般来说各成分金属均保持了其原有的化学性质。
课堂重难解疑
问题一 合金的组成、性质及作用
2.合金的形成条件
(1)金属与金属形成合金时:合金是金属在熔化状态时相互混合形成的,熔化时的温度需达到成分金属中熔点最高的金属的熔点,但又不能超出成分金属中沸点最低的金属的沸点。一种金属的熔点高于另一种金属的沸点时则不能形成合金。
(2)金属与非金属形成合金时:部分不活泼非金属与金属可形成合金,活泼非金属与活泼金属则不能形成合金
3.金属材料选择的依据
某种金属能不能成为一种应用广泛的材料主要取决于该金属的储量、冶炼成本、市场价格以及所具有的性能和是否易于加工等。
(2)化学性质:对水的作用、耐腐蚀性等,这些性质决定金属材料的日常维护和环境对其的影响。
(1)物理性质:密度、硬度、强度、导电性和导热性等,这些性质决定金属材料的加工难易程度。
(1)列举生活中的合金材料,并简述选择该材料时利用了该合金的哪些优异性能。
提示:①铝合金门窗:质轻、耐腐蚀;②易拉罐:质轻、易回收利用。
(2)为什么航空工业中铝合金比铁合金应用更广泛
提示:铝合金比铁合金密度小且耐高温、耐腐蚀。
思考讨论
课堂重难解疑
问题二 常见的几种合金
1.合金钢
2.铜合金
3.铝合金
4.钛合金
2019年1月3日上午10点26分,中国嫦娥四号探测器成功在月球背面软着陆,成为人类首次在月球背面软着陆的探测器。玉兔二号月球车实现了对月球背面的巡视。
情景思考
(1)月球在白天时的地面温度高达150度,而到了夜晚,温度又跌落到零下180度!嫦娥四号探测器、玉兔二号月球车均使用了大量合金材料,试分析这些合金材料应具有哪些性质。
提示:密度小、强度大、既耐高温又耐低温等。
(2)形状记忆合金是一种在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前原始形状的合金材料。中国嫦娥四号探测器,使用了记忆合金制作天线,试分析其好处。
提示:嫦娥四号探测器天线使用记忆合金制作,天线折叠起来装进探测器内,工作时只需加温,折叠的卫星天线因具有“记忆”功能而自然展开,恢复设计形状。
课堂重难解疑
问题三、铝与盐酸、NaOH溶液反应比较
【实验探究】铝分别与盐酸、NaOH溶液反应的对比实验
1.铝与酸、碱、盐溶液反应的实质
(1)厨房中能够用铝制容器长时间存放食醋吗
提示:不能。铝能与醋酸反应。
(2)如何除去镁粉中的铝粉
提示将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
(3)等量的铝分别与足量的稀盐酸、氢氧化钠溶液反应,生成氢气的量有什么关系
提示相同。
(4)等浓度、等体积的NaOH溶液和稀盐酸与足量铝反应,生成H2的质量有什么关系
提示3∶1。
(4)Al与等浓度的NaOH溶液、稀盐酸反应生成等质量的H2,所需NaOH溶液、稀盐酸的体积比为多少
提示1∶3。
思考讨论
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量之比为3∶1。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶3。
分析下列两个反应:2Al+6H+====2Al3++3H2↑ (1)
2Al+2OH-+2H2O====2Al +3H2↑ (2)
2.铝与盐酸或氢氧化钠溶液反应中四种“量”的关系
4.一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为1∶3
1.铝既能与非氧化性酸反应产生氢气,也能与碱反应产生氢气,前者是置换反应,后者不是置换反应。
2.铝与盐酸、氢氧化钠的反应中,还原剂都是铝,还原产物都是氢气,故铝与产生氢气的关系式是相同的。
【注意】
甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL 4.0 mol·L-1 的NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为 ( )
A.1∶1 B.2∶3 C.3∶2 D.3∶1
典例解析
【解析】选B。甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 mol,根据化学方程式2Al+6HCl==== 2AlCl3+3H2↑、2Al+2NaOH+2H2O====2NaAlO2+3H2↑可知,5.4 g(即0.2 mol)Al分别与盐酸和NaOH溶液反应时,盐酸不足量而NaOH过量,故Al与盐酸反应生成H2 0.2 mol,与NaOH溶液反应生成H2 0.3 mol,其体积比为2∶3。
1)如果将两份各5.4 g的铝粉分别加入足量的盐酸和NaOH溶液,在相同状况下产生气体的体积比是多少
提示:1∶1。
2)如果题目中盐酸浓度是2.0 mol·L-1,在相同状况下产生气体的体积比是多少
提示:1∶3。
【母题追问】
达标检测2.有资料显示,铝元素在人体内的残留积累量过多后对大脑发育有不良影响,建议多用不锈钢代替铝合金作为材料制作餐厨等日用品。下列说法中不正确的是( )
A.不锈钢中含有铁元素、镍元素、铬元素
B.不锈钢属于铁合金
C.不锈钢是无腐蚀性的
D.不锈钢是绝对不能被腐蚀的
解析D 不锈钢是含有镍、铬元素的铁合金,主要成分是铁。不锈钢本身无腐蚀性,耐腐蚀性也很强,但不锈钢也并不是绝对不能被腐蚀的。
3.对于铝和烧碱溶液的反应,下列说法不正确的是( )
A.铝是还原剂
B.该反应是氧化还原反应
C.该反应说明所有金属都能与碱反应
D.H2为还原产物
解析C
铝与烧碱溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,分析元素化合价变化可知反应为氧化还原反应,铝是还原剂,H2为还原产物,A、B、D正确。铝能与烧碱溶液反应,并不能说明所有金属都能与碱反应,如镁、铁、铜等均不与碱溶液反应。
课堂小结
2019人教版
第三章 铁 金属材料
第二节 金属材料
第一课时 物质的量在化学方程式 计算中的应用(一)
学习目标
课前自主预习
一、物质的量与各物理量之间的关系
1.图示关系
2.计算公式
(1)已知物质的质量:n(B)=_______;
(2)已知标准状况时的气体体积:n(B)=_________;
(3)已知物质的粒子数:n(B)=_______;
(4)已知溶液中的物质的量浓度:n(B)= _______________。
c(B)·V[B(aq)]
2∶1∶2
2∶1∶2
2∶1∶2
2∶1∶2
物质的量
体积
1 mol H2与1 mol Cl2在点燃的条件下完全反
应生成2 mol HCl
2Na + 2H2O====2NaOH + H2↑
计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
物质的量之比: 2 mol∶2 mol ∶ 2 mol ∶ 1 mol
质量之比: 46 g ∶ 36 g ∶ 80 g ∶ 2 g
课堂重难解疑
结论:化学方程式中化学计量数之比等于_________之比,
也等于_________之比,对于有气体参与的反应还等于_____之比。
粒子个数
物质的量
体积
进一步加深理解
问题一、化学方程式中化学计量数与各化学计量间的关系
2.计算类型
观察下面的化学方程式,及各物质对应的物理量,思考并回答相关问题。
2Na + 2H2O====2NaOH + H2↑
2×23 g 2 mol 2 mol 22.4 L
m(Na) n(H2O) n(NaOH) V(H2)
则有
思考讨论
(2)上述反应是在常温常压下发生的吗 说明你的判断理由。
提示:不是。因为在计算中1 mol氢气的体积是22.4 L,说明一定不是在常温常压下进行的。
(1)为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一
提示:同一种物质用不同的物理量表示时,比例是相同的。例如1 mol钠和23 g钠完全相同。
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
问题三、计算过程中的注意事项
(2)单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据不足量的物质进行计算。
活学活用,素养提升
达标检测
1.0.56 g氧化钙恰好与20 mL盐酸反应,则此盐酸的物质的量浓度是 ( )
A.0.10 mol·L-1 B.0.20 mol·L-1
C.0.50 mol·L-1 D.1.00 mol·L-1
【解析】选D。CaO+2HCl====CaCl2+H2O
56 g 2 mol
0.56 g c(HCl)×20×10-3 L
则: 解得c(HCl)=1.00 mol·L-1。
课堂小结
2019人教版
第三章 铁 金属材料
第二节 金属材料
第一课时 物质的量在化学方程式 计算中的应用(二)
学习目标
化学计算的常用方法重点解析1.关系式法——解答连续反应类型计算题的捷径 典例解析
【典例2】硫黄制硫酸时发生的反应有
S+O2 == SO2 2SO2+O2 === 2SO3
SO3+H2O====H2SO4
由硫黄制取硫酸的关系式是________。假设64 g硫黄完全反应,可制取硫酸的质量是________。
【解析】据题中化学方程式(或根据硫原子守恒)可关系式S~H2SO4。制取硫酸的质量为 ×98 g· mol-1=196 g。
答案:S~H2SO4 196 g
2.差量法——化学方程式计算中的巧思妙解
【典例4】已知:①碳酸钠高温下不分解;②碳酸氢钠受
热发生分解反应:2NaHCO3 Na2CO3+H2O+CO2↑。充
分加热碳酸钠和碳酸氢钠的混合物19 g,完全反应后固
体质量减轻了3.1 g,求
(1)原混合物中碳酸钠的质量是________ g。
(2)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)是________ L。
【解析】(1)设混合物中碳酸氢钠的质量为m,则:
2NaHCO3 Na2CO3+H2O+CO2↑ Δm
168 g 106 g 62 g
m 3.1 g
故m= ×168 g=8.4 g, 则碳酸钠的质量为19 g-8.4 g=10.6 g。
(2)剩余固体为碳酸钠,质量为19 g-3.1 g=15.9 g,物质的量为 =0.15 mol,根据碳原子守恒可知,生成二氧化碳的物质的量为0.15 mol,标准状况下的体积为0.15 mol×22.4 L·mol-1=3.36 L 。
答案:(1)10.6 (2)3.36
1).质量守恒:反应前后元素质量、原子个数不变。
2).得失电子守恒:还原剂失电子总数=氧化剂得电子总数。
3).电荷守恒:阳离子所带正电荷总数=阴离子所带负电荷总数。
3.守恒法-----守恒思想在化学方程式计算中的巧用
【典例5】在体积为V L的密闭容器中通入a mol一氧化碳和b mol 氧气,点燃充分反应后容器内碳原子与氧原子
数之比为 ( )
A.a∶b B.a∶2b
C.a∶(a+2b) D.a∶[2(a+b)]
【解析】选C。根据反应前后原子守恒可知,n(C)∶n(O) =a∶(a+2b)。
【典例6】 0.3 mol氯气和足量的金属M反应,生成0.2 mol MCln,则n等于 ( )
A.1 B.2 C.3 D.4
【解析】选C。根据氯原子守恒,可知0.3 mol Cl2和0.2 mol MCln均含0.6 mol Cl。
达标检测
达标检测课堂小结
