2022-2023学年上学期高一化学鲁科版(2019)必修第一册1.3.2.气体摩尔体积及物质的量浓度课件(33张ppt)
文档属性
| 名称 | 2022-2023学年上学期高一化学鲁科版(2019)必修第一册1.3.2.气体摩尔体积及物质的量浓度课件(33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-12 15:29:28 | ||
图片预览










文档简介
第2讲
气体摩尔体积及物质的量的浓度
Contents
气体摩尔体积
01
物质的量浓度
02
目录
NA----建立了粒子数和物质的量的联系
摩尔质量----建立了质量和物质的量的联系
为化学计算提供了很大的方便。
对于方便测量物质体积的气体和液体而言,我们又将引入一个怎样的物理量,建立体积和物质的量的联系呢?
1mol不同固、液的质量和体积
物质
状态
粒子数
质量(g)
密度(g/cm3)
体积
20℃(cm3)
Fe
固体
6.02×1023
56
7.8
7.2
Al
固体
6.02×1023
27
2.7
10
H2O
液体
6.02×1023
18
1
18
H2SO4
液体
6.02×1023
98
1.83
53.6
模块一、气体摩尔体积
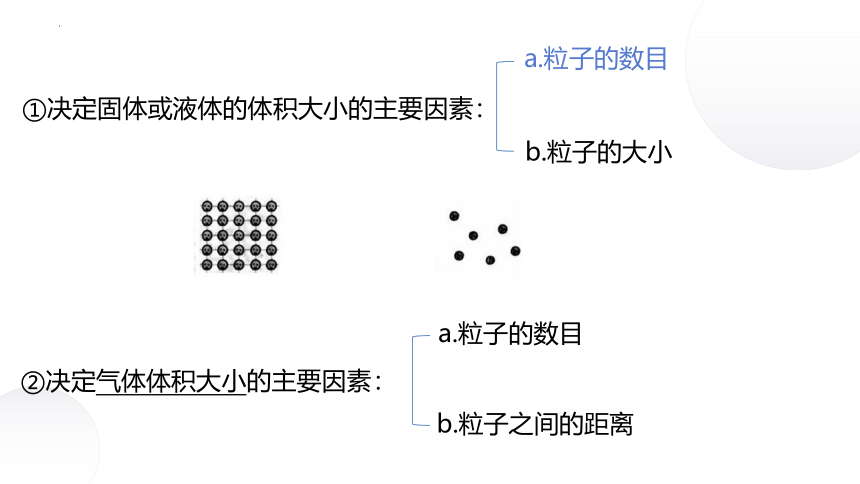
1.影响体积的因素
结论:1mol不同的固态或液态物质,体积不同。
1mol不同气体的质量和体积(STP)
物质
状态
粒子数
质量(g)
密度(g/cm3)
体积
STP(L)
H2
气体
6.02×1023
2.016
0.0899
22.4
O2
气体
6.02×1023
32.00
1.429
22.4
CO2
气体
6.02×1023
44.01
1.977
22.3
Cl2
气体
6.02×1023
71.00
3.168
22.4
结论:1 mol不同的气态物质,在温度、压强相同时,体积相同。
1、1mol不同的固态或液态物质,体积不同。
思考
2、1mol不同的气体物质,在相同状态下,体积基本相同
Why?
①微粒数目的多少
②微粒大小
③微粒间距
1.影响体积的因素
①决定固体或液体的体积大小的主要因素:
②决定气体体积大小的主要因素:
b.粒子的大小
b.粒子之间的距离
a.粒子的数目
a.粒子的数目
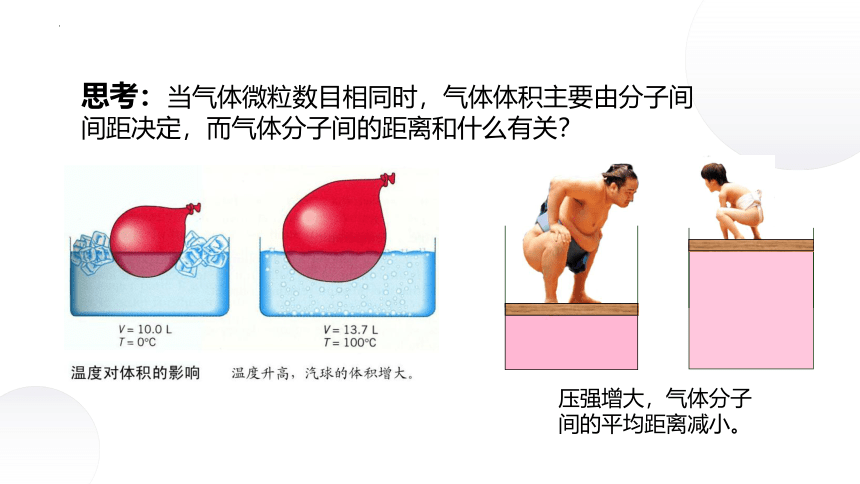
思考:当气体微粒数目相同时,气体体积主要由分子间间距决定,而气体分子间的距离和什么有关?
压强增大,气体分子间的平均距离减小。
决定气体物质体积大小的因素
1. 粒子的数目
2. 粒子间的距离
⑴温度
⑵压强
思考:当气体的物质的量为1mol,温度和压强一定是,气体的体积是否是个定值呢???
2.气体摩尔体积
(1)概念:单位物质的量的任何气体在相同条件下应占有相同的体积
(2)定义式: Vm = ????气体????气体
?
符号:Vm
单位:升/摩尔(L/mol或L·mol-1)
①通常将温度为0℃时,压强为101 kPa的状况称为标准状态,根据大量实验事实证明,在标准状况下,1 mol任何气体的体积都约是22.4 L。
即在标准状况下(0 ℃, 101 kPa),气体的摩尔体积约是22.4 L/mol
③气体的体积受温度、压强的影响很大,因此,说到气体的体积时,必须指明外界条件,否则就没有意义
注意事项:
②研究对象:任何气体,可以是单一气体也可以是混合气体
④相同条件下,任何气体的Vm都相同,但不一定等于22.4L/mol。
1 mol CO的体积为22.4 L
在20℃,101 kPa 下,1 mol CO的体积约为22.4 L
标准状况下,1 mol CO和CO2混合气体的总体积约为22.4 L
判断:
×
×
√
在标准状况下,1 mol H2O的体积约为22.4 L
×
(3)物质的量(n)构建质量(m)、体积(V)、粒子数(N)之间的关系:
练习1、标准状况下,11.2L的O2质量是多少g?
练习2、标准状况下,5.6升O2中有多少个O2分子?
3.阿伏伽德罗定律
决定粒子间距离的主要因素是温度和压强(有何影响?)
在相同温度和压强下,相同体积的任何气体应含有相同数目的粒子
——阿伏加德罗定律
不同气体
在相同温度和压强条件下
分子间距离视为相同
若气体粒子数相同
体积近似相同
在相同条件下
1.气体的体积主要由以下什么因素决定( )
①气体的分子多少 ②气体分子的大小
③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
B
【典例精讲】
2.一定温度和压强下,2体积AB2(气)和1体积B2(气)化合生成2体积气态化合物,则该化合物的化学式为( )
A.AB3 B.AB2 C.A3B D.A2B3
A
3. 在标准状况下,由0.5 g H2、11 g CO2和4 g O2组成的混合气体,其体积约为( )
C
A.8.4 L B.11.2 L C.14.0 L D.16.8 L
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为__________,R的相对原子质量为__________;
(1)在标准状况下,1.7 g氨气所占的体积为________L,它与标准状况下________L硫化氢含有相同数目的氢原子;
2.24
4.填空
3.36
32
64 g/mol
(4)同温同压下,SO2与氦气的密度之比为________;若质量相同,两种气体的体积比为___________。
(3)已知CO、CO2的混合气体质量共16.0 g,标准状况下体积为8.96 L,则可推知该混合气体中含CO__________g,所含CO2在标准状况下的体积为__________;
2.8
6.72 L
16:1
1:16
模块二、物质的量浓度
用质量分数表示 用体积分数表示
用质量—体积浓度 表示用物质的量浓度表示
1.概念:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度
2 .表达式:
符号为cB,单位为mol/L(或mol·L-1)。
如1 L NaCl溶液中含有1 mol NaCl,则该NaCl溶液的物质的量浓度就是1 mol/L。
CB= ????溶质????溶液
?
3 .使用物质的量浓度的注意事项
① CB= ????溶质????溶液中体积指溶液的体积(且以升为单位),不是溶剂的体积
?
② 溶质的量是指物质的量,而不能用质量表示
③溶液具有均一稳定性
将1 mol NaCl溶于1 L水中,是否可得到物质的量浓度为1 mol/L的 NaCl溶液?
100 mL 1 mol/L的稀盐酸溶液,取出5 mL后剩余溶液的浓度为?
⑤ 用结晶水合物配制溶液时,其溶质不应包含结晶水。例如,25 g胆矾(CuSO4·5H2O)溶于水后形成的溶液,溶质是CuSO4,而不是CuSO4·5H2O
④ 若物质的量浓度相同,体积不同时,则所含溶质物质的量也不同
2 L 1 mol/L的 MgCl2溶液中Mg2+的浓度?Cl-的浓度?两种离子的物质的量分别为?
a mol/L AnBm含有的c(Am+)的浓度为a×n mol/L
c(Bn+)的浓度为a×m mol/L
eg: 2 mol/L Fe2(SO4)3
Fe3+的浓度为4 mol/L;SO42-的浓度为6 mol/L
4.物质的量浓度的计算
(1)离子浓度的计算
(2)根据物质的量进行求算
练习1、0.5L的MgCl2溶液中含有1mol MgCl2,MgCl2溶液的浓度是多少?
练习2、练习2、从100mL的浓度为0.5mol/L的NaOH溶液中取出20mL,则取出来的溶液中含溶质物质的量是多少?
(2)通过物质的量构建物质的量浓度和气体体积、质量、粒子数的认知模型。
【例题】将配制500mL0.1mol/LNaOH溶液,需要NaOH的质量是多少?
【典例精讲】
1.下列关于1 mol?L-1的Ba(OH)2溶液的说法正确的是( )
?
A.该溶液中含有1 mol Ba(OH)2
B.将1 mol Ba(OH)2溶于1 L水中可得到该浓度的溶液
C.该溶液中OH-的物质的量浓度为2 mol?L-1
D.1L该溶液中所含Ba2+和OH-的物质的量都是1 mol
?
C
2.下列溶液中c(Cl-)与50 mL 1mol?L-1AlCl3溶液中c(Cl-)相等的是( )
?
A.150 mL 1 mol?L-1的NaCl溶液
B.75 mL 2 mol?L-1的NH4Cl溶液
C.150 mL 2mol?L-1的KCl溶液
D.75 mL 1 mol?L-1的FeCl3溶液
?
D
3.某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比c(Na+):c(Mg2+):c(Cl-)=3:5:5,若Na+浓度为3 mol/L,则SO42-的浓度为( )
A.2 mol/L
B.3 mol/L
C.4 mol/L
D.8 mol/L
C
4.下列说法正确的是( )
A.22.4 L氨气中含氢原子数目为3×6.02×1023
B.1.8 g水中所含质子数为0.1×6.02×1023
C.标准状况下,4.48 L的氧气和氮气的混合物含有的分子数目
为0.2×6.02×1023
D.80 g苛性钠溶于1 L水中,所得溶液的物质的量浓度为2 mol/L
C
(1)NA个HCl分子溶于水配成1 L溶液,其物质的量浓度为_____mol/L;
5.填空
(2)将标准状况下11.2 L HCl溶于水配成500 mL溶液,其物质的量浓度为_____mol/L;
1
(3)物质的量浓度为2 mol/L的硫酸溶液250 mL,含H2SO4的质量为_____g;
(4)100 mL 1 mol/L NaCl溶液加水稀释至200 mL,所得溶液中NaCl的物质的量浓度为_______mol/L,Na+的物质的量为______mol。
1
49
0.5
0.1
下课!
气体摩尔体积及物质的量的浓度
Contents
气体摩尔体积
01
物质的量浓度
02
目录
NA----建立了粒子数和物质的量的联系
摩尔质量----建立了质量和物质的量的联系
为化学计算提供了很大的方便。
对于方便测量物质体积的气体和液体而言,我们又将引入一个怎样的物理量,建立体积和物质的量的联系呢?
1mol不同固、液的质量和体积
物质
状态
粒子数
质量(g)
密度(g/cm3)
体积
20℃(cm3)
Fe
固体
6.02×1023
56
7.8
7.2
Al
固体
6.02×1023
27
2.7
10
H2O
液体
6.02×1023
18
1
18
H2SO4
液体
6.02×1023
98
1.83
53.6
模块一、气体摩尔体积
1.影响体积的因素
结论:1mol不同的固态或液态物质,体积不同。
1mol不同气体的质量和体积(STP)
物质
状态
粒子数
质量(g)
密度(g/cm3)
体积
STP(L)
H2
气体
6.02×1023
2.016
0.0899
22.4
O2
气体
6.02×1023
32.00
1.429
22.4
CO2
气体
6.02×1023
44.01
1.977
22.3
Cl2
气体
6.02×1023
71.00
3.168
22.4
结论:1 mol不同的气态物质,在温度、压强相同时,体积相同。
1、1mol不同的固态或液态物质,体积不同。
思考
2、1mol不同的气体物质,在相同状态下,体积基本相同
Why?
①微粒数目的多少
②微粒大小
③微粒间距
1.影响体积的因素
①决定固体或液体的体积大小的主要因素:
②决定气体体积大小的主要因素:
b.粒子的大小
b.粒子之间的距离
a.粒子的数目
a.粒子的数目
思考:当气体微粒数目相同时,气体体积主要由分子间间距决定,而气体分子间的距离和什么有关?
压强增大,气体分子间的平均距离减小。
决定气体物质体积大小的因素
1. 粒子的数目
2. 粒子间的距离
⑴温度
⑵压强
思考:当气体的物质的量为1mol,温度和压强一定是,气体的体积是否是个定值呢???
2.气体摩尔体积
(1)概念:单位物质的量的任何气体在相同条件下应占有相同的体积
(2)定义式: Vm = ????气体????气体
?
符号:Vm
单位:升/摩尔(L/mol或L·mol-1)
①通常将温度为0℃时,压强为101 kPa的状况称为标准状态,根据大量实验事实证明,在标准状况下,1 mol任何气体的体积都约是22.4 L。
即在标准状况下(0 ℃, 101 kPa),气体的摩尔体积约是22.4 L/mol
③气体的体积受温度、压强的影响很大,因此,说到气体的体积时,必须指明外界条件,否则就没有意义
注意事项:
②研究对象:任何气体,可以是单一气体也可以是混合气体
④相同条件下,任何气体的Vm都相同,但不一定等于22.4L/mol。
1 mol CO的体积为22.4 L
在20℃,101 kPa 下,1 mol CO的体积约为22.4 L
标准状况下,1 mol CO和CO2混合气体的总体积约为22.4 L
判断:
×
×
√
在标准状况下,1 mol H2O的体积约为22.4 L
×
(3)物质的量(n)构建质量(m)、体积(V)、粒子数(N)之间的关系:
练习1、标准状况下,11.2L的O2质量是多少g?
练习2、标准状况下,5.6升O2中有多少个O2分子?
3.阿伏伽德罗定律
决定粒子间距离的主要因素是温度和压强(有何影响?)
在相同温度和压强下,相同体积的任何气体应含有相同数目的粒子
——阿伏加德罗定律
不同气体
在相同温度和压强条件下
分子间距离视为相同
若气体粒子数相同
体积近似相同
在相同条件下
1.气体的体积主要由以下什么因素决定( )
①气体的分子多少 ②气体分子的大小
③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
B
【典例精讲】
2.一定温度和压强下,2体积AB2(气)和1体积B2(气)化合生成2体积气态化合物,则该化合物的化学式为( )
A.AB3 B.AB2 C.A3B D.A2B3
A
3. 在标准状况下,由0.5 g H2、11 g CO2和4 g O2组成的混合气体,其体积约为( )
C
A.8.4 L B.11.2 L C.14.0 L D.16.8 L
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为__________,R的相对原子质量为__________;
(1)在标准状况下,1.7 g氨气所占的体积为________L,它与标准状况下________L硫化氢含有相同数目的氢原子;
2.24
4.填空
3.36
32
64 g/mol
(4)同温同压下,SO2与氦气的密度之比为________;若质量相同,两种气体的体积比为___________。
(3)已知CO、CO2的混合气体质量共16.0 g,标准状况下体积为8.96 L,则可推知该混合气体中含CO__________g,所含CO2在标准状况下的体积为__________;
2.8
6.72 L
16:1
1:16
模块二、物质的量浓度
用质量分数表示 用体积分数表示
用质量—体积浓度 表示用物质的量浓度表示
1.概念:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度
2 .表达式:
符号为cB,单位为mol/L(或mol·L-1)。
如1 L NaCl溶液中含有1 mol NaCl,则该NaCl溶液的物质的量浓度就是1 mol/L。
CB= ????溶质????溶液
?
3 .使用物质的量浓度的注意事项
① CB= ????溶质????溶液中体积指溶液的体积(且以升为单位),不是溶剂的体积
?
② 溶质的量是指物质的量,而不能用质量表示
③溶液具有均一稳定性
将1 mol NaCl溶于1 L水中,是否可得到物质的量浓度为1 mol/L的 NaCl溶液?
100 mL 1 mol/L的稀盐酸溶液,取出5 mL后剩余溶液的浓度为?
⑤ 用结晶水合物配制溶液时,其溶质不应包含结晶水。例如,25 g胆矾(CuSO4·5H2O)溶于水后形成的溶液,溶质是CuSO4,而不是CuSO4·5H2O
④ 若物质的量浓度相同,体积不同时,则所含溶质物质的量也不同
2 L 1 mol/L的 MgCl2溶液中Mg2+的浓度?Cl-的浓度?两种离子的物质的量分别为?
a mol/L AnBm含有的c(Am+)的浓度为a×n mol/L
c(Bn+)的浓度为a×m mol/L
eg: 2 mol/L Fe2(SO4)3
Fe3+的浓度为4 mol/L;SO42-的浓度为6 mol/L
4.物质的量浓度的计算
(1)离子浓度的计算
(2)根据物质的量进行求算
练习1、0.5L的MgCl2溶液中含有1mol MgCl2,MgCl2溶液的浓度是多少?
练习2、练习2、从100mL的浓度为0.5mol/L的NaOH溶液中取出20mL,则取出来的溶液中含溶质物质的量是多少?
(2)通过物质的量构建物质的量浓度和气体体积、质量、粒子数的认知模型。
【例题】将配制500mL0.1mol/LNaOH溶液,需要NaOH的质量是多少?
【典例精讲】
1.下列关于1 mol?L-1的Ba(OH)2溶液的说法正确的是( )
?
A.该溶液中含有1 mol Ba(OH)2
B.将1 mol Ba(OH)2溶于1 L水中可得到该浓度的溶液
C.该溶液中OH-的物质的量浓度为2 mol?L-1
D.1L该溶液中所含Ba2+和OH-的物质的量都是1 mol
?
C
2.下列溶液中c(Cl-)与50 mL 1mol?L-1AlCl3溶液中c(Cl-)相等的是( )
?
A.150 mL 1 mol?L-1的NaCl溶液
B.75 mL 2 mol?L-1的NH4Cl溶液
C.150 mL 2mol?L-1的KCl溶液
D.75 mL 1 mol?L-1的FeCl3溶液
?
D
3.某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比c(Na+):c(Mg2+):c(Cl-)=3:5:5,若Na+浓度为3 mol/L,则SO42-的浓度为( )
A.2 mol/L
B.3 mol/L
C.4 mol/L
D.8 mol/L
C
4.下列说法正确的是( )
A.22.4 L氨气中含氢原子数目为3×6.02×1023
B.1.8 g水中所含质子数为0.1×6.02×1023
C.标准状况下,4.48 L的氧气和氮气的混合物含有的分子数目
为0.2×6.02×1023
D.80 g苛性钠溶于1 L水中,所得溶液的物质的量浓度为2 mol/L
C
(1)NA个HCl分子溶于水配成1 L溶液,其物质的量浓度为_____mol/L;
5.填空
(2)将标准状况下11.2 L HCl溶于水配成500 mL溶液,其物质的量浓度为_____mol/L;
1
(3)物质的量浓度为2 mol/L的硫酸溶液250 mL,含H2SO4的质量为_____g;
(4)100 mL 1 mol/L NaCl溶液加水稀释至200 mL,所得溶液中NaCl的物质的量浓度为_______mol/L,Na+的物质的量为______mol。
1
49
0.5
0.1
下课!
