2022-2023学年上学期高一化学鲁科版(2019)必修第一册1.3.3.物质的量浓度计算课件(30张ppt)
文档属性
| 名称 | 2022-2023学年上学期高一化学鲁科版(2019)必修第一册1.3.3.物质的量浓度计算课件(30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-12 15:31:00 | ||
图片预览










文档简介
(共30张PPT)
鲁科版必修第一册
第三课时
有关物质的量浓度的计算
【学习目标】
物质的量浓度和溶质质量分数之间的换算
溶液稀释或混合的计算
有关物质的量浓度概念的计算
根据化学方程式进行计算常用的方法
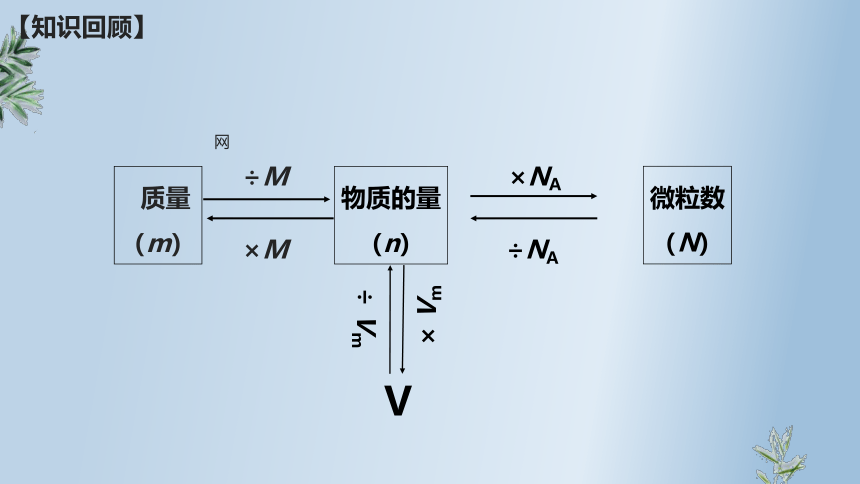
【知识回顾】
质量
(m)
物质的量
(n)
微粒数
(N)
÷M
×M
×NA
÷NA
V
÷ Vm
× Vm
网
质量分数=
溶质的质量
溶液的质量
× 100%
=
溶质的质量
溶质的质量 + 溶剂的质量
×100%
衡量溶液的浓和稀 —— 溶质的质量分数或物质的量浓度
物质的量浓度:单位体积溶液中所含溶质的物质的量
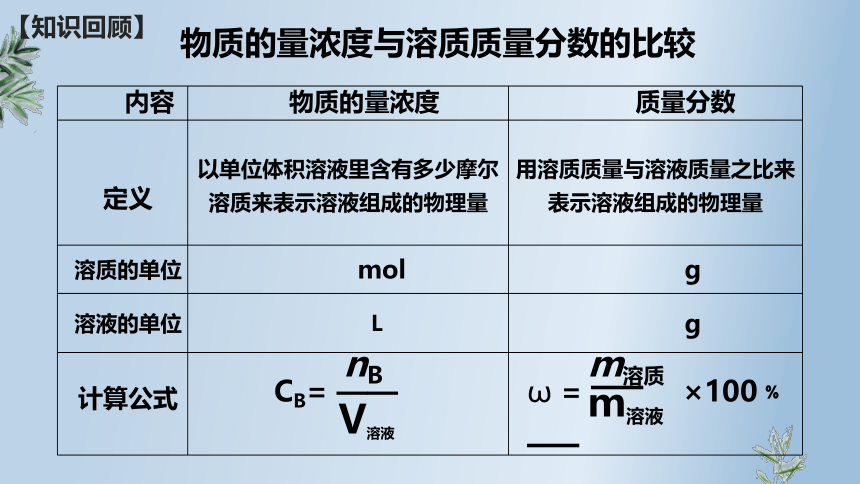
【知识回顾】
内容 物质的量浓度 质量分数
定义 以单位体积溶液里含有多少摩尔溶质来表示溶液组成的物理量 用溶质质量与溶液质量之比来表示溶液组成的物理量
溶质的单位 mol g
溶液的单位 L g
计算公式
物质的量浓度与溶质质量分数的比较
nB
V溶液
CB= ——
m溶质
m溶液
ω = ——
×100﹪
【知识回顾】
(一)、根据定义计算物质的量浓度
物质的量浓度的相关计算
1、将0.5mol NaCl固体溶于水中,配成250 mL溶液,计算所得溶液中溶质的物质的量浓度。
2、200mL含H2SO4 98g的硫酸溶液的物质的量浓度是?
【练习】
3、将3.9 g Na2O2固体溶于水配成200 mL的溶液,计算所得溶液中溶质的物质的量浓度。
Na2O2溶于水生成NaOH,则溶质NaOH的物质的量
【解析】
4、200 mL、2.00 mol/L的Al2(SO4)3溶液中含有 mol Al2(SO4)3,Al3+的物质的量浓度为 ,SO42-的物质的量浓度为 .
5、下列溶液Cl 物质的量浓度最大的是( )
A、50mL 0.5mol/L NaCl B、60mL 0.2mol/L CaCl2
C、10mL 0.2mol/L AlCl3 D、200mL 0.3mol/LHCl
D
0.4
4 mol/L
6 mol/L
6、已知通入1L水中的某气体体积为V L(标准状况),气体的摩尔质量为M g mol-1, 所得溶液的密度为ρ g cm-3 。计算该溶液中溶质的物质的量浓度。
n溶质
V溶液
C溶质= ——
【解析】
( 体积单位不一定用升,相同则可)
(二)、溶液稀释计算
【练习】
1、要配制500mL 0.6mol/L 的NaOH溶液,需6 mol/L 的NaOH溶液多少毫升?
0.6 mol/L×0.5 L= 6 mol/L×V
V (NaOH)= 0.05 L= 50 mL
稀释定律:c浓×V浓=c稀×V稀
1、50 mL物质的量浓度为2 mol/L的NaCl 溶液稀释成100 mL 后,其物质的量浓度为
2、已知 75 ml 2 mol/L NaOH 溶液的质量为 80 g,计算溶液中溶质的质量分数
1 mol/L
7.5%
【练习】
取100 mL 0.3 mol/L的H2SO4溶液和300 mL 0.25mol/L的H2SO4溶液配成500mL溶液,所得溶液中H+的物质的量浓度为( )
A.0.265 mol/L B.0.525 mol/L
C.0.21 mol/L D.0.42 mol/L
D
【练习】
c1V1 + c2V2 = c(混) (V1 + V2)
(1)溶液混合不反应型:
(三)、溶液混合的计算
混合后忽略溶液体积变化,即V混=V1+V2
例:100mL 0.3 mol ·L-1 Na2SO4溶液和50mL 0.2 mol ·L-1 Al2(SO4)3溶液混合后,忽略溶液体积变化,则溶液中SO42-离子的物质的量浓度为 .
(四)、关于物质的量浓度、质量分数的换算
设溶液体积为1L,则
98%的密度为 1. 84 g/cm3 的浓硫酸,其物质的量浓度为多少?
已知常见浓盐酸的质量分数是:37%,密度:1.19g/cm3。求浓盐酸的物质的量浓度是多少?
要配制500mL、1mol/L的H2SO4,需98%的浓硫酸(ρ=1.84g / cm3) mL。
【练习】
1、在NaCl、MgCl2、MgSO4、Na2SO4四种盐配成的混合溶液中,若C(Na+)=0.1mol·L-1、 C(Mg2+)=0.25mol·L-1、 C(Cl-)=0.2mol·L-1 , C(SO42-) =_____________
溶液中微粒之间电荷守恒——即溶液呈电中性,溶液中的正电荷总数=负电荷总数
(五)、溶液中的电荷守恒的相关计算
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+ 、0.4 mol/L Cl , 则 SO42- ( )
A.0.1 mol/L B.0.2 mol/L
C.0.3 mol/L D.0.4 mol/L
在含有AlCl3、KCl、K2SO4三种溶质的溶液中,已知c(Cl-)=3.5mol/L、c(K+)=1.5mol/L、c(SO42- )=0.5mol/L。求c(Al 3+)?
C
(六)、物质的量用以化学方程式的计算
化学方程式:
化学计量数之比:
2 : 1 : 2
分子个数之比:
2 NA : 1NA : 2NA
物质的量之比:
2mol : 1mol : 2mol
1、化学方程式中化学计量数的含义
2、反应中各物质的物理量之间的比例关系
化学计量数之比:
a : b : c : d
质量之比:
aMA : bMB : cMC : dMD
气体体积之比:
a : b : c : d
物质的量之比:
a : b : c : d
现要在实验室里制取一定量的氢气。将0.65g金属锌放入一定体积的2mol/L的盐酸中,它们恰好完全反应,请完成下面的表格。
化学反应 Zn+2HCl===ZnCl2 +H2↑
质量或气体体积(STP) 0.65g
0.73g
1.36g
0.224L
【练习】
Zn+2HCl ZnCl2 +H2↑
1 2 1 1
0.01mol 0.02mol 0.01mol 0.01mol
0.65g 0.02×73g 0.01×136g 0.01×22.4L
【解析】
3、根据化学方程式进行计算的一般步骤
设:设所求物质的物质的量或质量、体积
写:写出相应的化学方程式
标:在化学方程式中有关物质下面标出相关量
列:列出比例式
解:解上述含未知数的比例式
答:简明地写出答案
将1.15 g钠置于足量的水中,充分反应后,生成的NaOH的物质的量是多少?生成的气体在标准状况下占多大体积?
【练习】
【解析】
在标准状况下,将体积均为22.4L的H2和O2的混合气体引燃,充分反应后,生成水的质量为多少克?
【练习】
(2)关系式法
叠加法
高温
}
~
根据原子个数守恒确定关系式
点燃
根据Na原子守恒可确定:2Na Na2CO3
~
46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与足量水反应放出气体的体积(标准状况)是( )
A. 44.8L B.11.2L
C. 22.4L D.5.6L
B
【练习】
解析:通过方程式找出Na和氧气的关系
(3)差量法
依据:差量的大小与反应物的有关量成正比
关键:一是根据化学方程式确定“理论差量”;
二是根据题给信息确定“实际差量”
步骤:
第一步:分析题意。分析化学反应中各物质之间的数量关系以及引起差量的原因
第二步:书写化学方程式,将差量写在化学方程式的右侧,并以此作为关系量
第三步:列式计算。根据“理论差量”与“实际差量”,列式计算,求算未知量
常温常压下,将0.3 mol CO2通入盛有23.4 g Na2O2的容器中,一段时间后排出气体,所得固体的质量为29.0 g,则参加反应的CO2的物质的量与产物Na2CO3的质量分别为( )
【练习】
A. 0.3 mol 29.0 g B. 0.3 mol 21.2 g
C. 0.3 mol 29.0 g D. 0.3 mol 21.2 g
C
N
n
m
÷NA
×M
×NA
÷M
V
(气体)
×22.4
÷22.4
(标准状况)
CB
÷V(aq)
×V(aq)
鲁科版必修第一册
第三课时
有关物质的量浓度的计算
【学习目标】
物质的量浓度和溶质质量分数之间的换算
溶液稀释或混合的计算
有关物质的量浓度概念的计算
根据化学方程式进行计算常用的方法
【知识回顾】
质量
(m)
物质的量
(n)
微粒数
(N)
÷M
×M
×NA
÷NA
V
÷ Vm
× Vm
网
质量分数=
溶质的质量
溶液的质量
× 100%
=
溶质的质量
溶质的质量 + 溶剂的质量
×100%
衡量溶液的浓和稀 —— 溶质的质量分数或物质的量浓度
物质的量浓度:单位体积溶液中所含溶质的物质的量
【知识回顾】
内容 物质的量浓度 质量分数
定义 以单位体积溶液里含有多少摩尔溶质来表示溶液组成的物理量 用溶质质量与溶液质量之比来表示溶液组成的物理量
溶质的单位 mol g
溶液的单位 L g
计算公式
物质的量浓度与溶质质量分数的比较
nB
V溶液
CB= ——
m溶质
m溶液
ω = ——
×100﹪
【知识回顾】
(一)、根据定义计算物质的量浓度
物质的量浓度的相关计算
1、将0.5mol NaCl固体溶于水中,配成250 mL溶液,计算所得溶液中溶质的物质的量浓度。
2、200mL含H2SO4 98g的硫酸溶液的物质的量浓度是?
【练习】
3、将3.9 g Na2O2固体溶于水配成200 mL的溶液,计算所得溶液中溶质的物质的量浓度。
Na2O2溶于水生成NaOH,则溶质NaOH的物质的量
【解析】
4、200 mL、2.00 mol/L的Al2(SO4)3溶液中含有 mol Al2(SO4)3,Al3+的物质的量浓度为 ,SO42-的物质的量浓度为 .
5、下列溶液Cl 物质的量浓度最大的是( )
A、50mL 0.5mol/L NaCl B、60mL 0.2mol/L CaCl2
C、10mL 0.2mol/L AlCl3 D、200mL 0.3mol/LHCl
D
0.4
4 mol/L
6 mol/L
6、已知通入1L水中的某气体体积为V L(标准状况),气体的摩尔质量为M g mol-1, 所得溶液的密度为ρ g cm-3 。计算该溶液中溶质的物质的量浓度。
n溶质
V溶液
C溶质= ——
【解析】
( 体积单位不一定用升,相同则可)
(二)、溶液稀释计算
【练习】
1、要配制500mL 0.6mol/L 的NaOH溶液,需6 mol/L 的NaOH溶液多少毫升?
0.6 mol/L×0.5 L= 6 mol/L×V
V (NaOH)= 0.05 L= 50 mL
稀释定律:c浓×V浓=c稀×V稀
1、50 mL物质的量浓度为2 mol/L的NaCl 溶液稀释成100 mL 后,其物质的量浓度为
2、已知 75 ml 2 mol/L NaOH 溶液的质量为 80 g,计算溶液中溶质的质量分数
1 mol/L
7.5%
【练习】
取100 mL 0.3 mol/L的H2SO4溶液和300 mL 0.25mol/L的H2SO4溶液配成500mL溶液,所得溶液中H+的物质的量浓度为( )
A.0.265 mol/L B.0.525 mol/L
C.0.21 mol/L D.0.42 mol/L
D
【练习】
c1V1 + c2V2 = c(混) (V1 + V2)
(1)溶液混合不反应型:
(三)、溶液混合的计算
混合后忽略溶液体积变化,即V混=V1+V2
例:100mL 0.3 mol ·L-1 Na2SO4溶液和50mL 0.2 mol ·L-1 Al2(SO4)3溶液混合后,忽略溶液体积变化,则溶液中SO42-离子的物质的量浓度为 .
(四)、关于物质的量浓度、质量分数的换算
设溶液体积为1L,则
98%的密度为 1. 84 g/cm3 的浓硫酸,其物质的量浓度为多少?
已知常见浓盐酸的质量分数是:37%,密度:1.19g/cm3。求浓盐酸的物质的量浓度是多少?
要配制500mL、1mol/L的H2SO4,需98%的浓硫酸(ρ=1.84g / cm3) mL。
【练习】
1、在NaCl、MgCl2、MgSO4、Na2SO4四种盐配成的混合溶液中,若C(Na+)=0.1mol·L-1、 C(Mg2+)=0.25mol·L-1、 C(Cl-)=0.2mol·L-1 , C(SO42-) =_____________
溶液中微粒之间电荷守恒——即溶液呈电中性,溶液中的正电荷总数=负电荷总数
(五)、溶液中的电荷守恒的相关计算
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+ 、0.4 mol/L Cl , 则 SO42- ( )
A.0.1 mol/L B.0.2 mol/L
C.0.3 mol/L D.0.4 mol/L
在含有AlCl3、KCl、K2SO4三种溶质的溶液中,已知c(Cl-)=3.5mol/L、c(K+)=1.5mol/L、c(SO42- )=0.5mol/L。求c(Al 3+)?
C
(六)、物质的量用以化学方程式的计算
化学方程式:
化学计量数之比:
2 : 1 : 2
分子个数之比:
2 NA : 1NA : 2NA
物质的量之比:
2mol : 1mol : 2mol
1、化学方程式中化学计量数的含义
2、反应中各物质的物理量之间的比例关系
化学计量数之比:
a : b : c : d
质量之比:
aMA : bMB : cMC : dMD
气体体积之比:
a : b : c : d
物质的量之比:
a : b : c : d
现要在实验室里制取一定量的氢气。将0.65g金属锌放入一定体积的2mol/L的盐酸中,它们恰好完全反应,请完成下面的表格。
化学反应 Zn+2HCl===ZnCl2 +H2↑
质量或气体体积(STP) 0.65g
0.73g
1.36g
0.224L
【练习】
Zn+2HCl ZnCl2 +H2↑
1 2 1 1
0.01mol 0.02mol 0.01mol 0.01mol
0.65g 0.02×73g 0.01×136g 0.01×22.4L
【解析】
3、根据化学方程式进行计算的一般步骤
设:设所求物质的物质的量或质量、体积
写:写出相应的化学方程式
标:在化学方程式中有关物质下面标出相关量
列:列出比例式
解:解上述含未知数的比例式
答:简明地写出答案
将1.15 g钠置于足量的水中,充分反应后,生成的NaOH的物质的量是多少?生成的气体在标准状况下占多大体积?
【练习】
【解析】
在标准状况下,将体积均为22.4L的H2和O2的混合气体引燃,充分反应后,生成水的质量为多少克?
【练习】
(2)关系式法
叠加法
高温
}
~
根据原子个数守恒确定关系式
点燃
根据Na原子守恒可确定:2Na Na2CO3
~
46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与足量水反应放出气体的体积(标准状况)是( )
A. 44.8L B.11.2L
C. 22.4L D.5.6L
B
【练习】
解析:通过方程式找出Na和氧气的关系
(3)差量法
依据:差量的大小与反应物的有关量成正比
关键:一是根据化学方程式确定“理论差量”;
二是根据题给信息确定“实际差量”
步骤:
第一步:分析题意。分析化学反应中各物质之间的数量关系以及引起差量的原因
第二步:书写化学方程式,将差量写在化学方程式的右侧,并以此作为关系量
第三步:列式计算。根据“理论差量”与“实际差量”,列式计算,求算未知量
常温常压下,将0.3 mol CO2通入盛有23.4 g Na2O2的容器中,一段时间后排出气体,所得固体的质量为29.0 g,则参加反应的CO2的物质的量与产物Na2CO3的质量分别为( )
【练习】
A. 0.3 mol 29.0 g B. 0.3 mol 21.2 g
C. 0.3 mol 29.0 g D. 0.3 mol 21.2 g
C
N
n
m
÷NA
×M
×NA
÷M
V
(气体)
×22.4
÷22.4
(标准状况)
CB
÷V(aq)
×V(aq)
