化学人教版(2019)必修第一册2.1.3碳酸钠和碳酸氢钠的性质和用途(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.3碳酸钠和碳酸氢钠的性质和用途(共18张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 31.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第一节 钠及其化合物
第3课时 碳酸钠和碳酸氢钠
学习目标:
1、从物质类别和生活实际,归纳碳酸钠和碳酸氢钠的性质
2、运用变化观念理解并掌握Na2CO3、NaHCO3相互转化的途径
3、认识化学在纯碱生产中的贡献,增强实验探究与创新意识,提升科学精神与社会责任感
【学习任务一】温故知新,发现问题
在初中,我们就已经学过了几种常见的钠盐碳酸钠,碳酸氢钠等它们的性质。此外,我们也知道了他们的一些用途,你还记得都有哪些用途吗?
2、碳酸钠和碳酸氢钠
【思考】性质决定用途,上述用途分别利用了碳酸钠和碳酸氢钠的哪些性质呢?
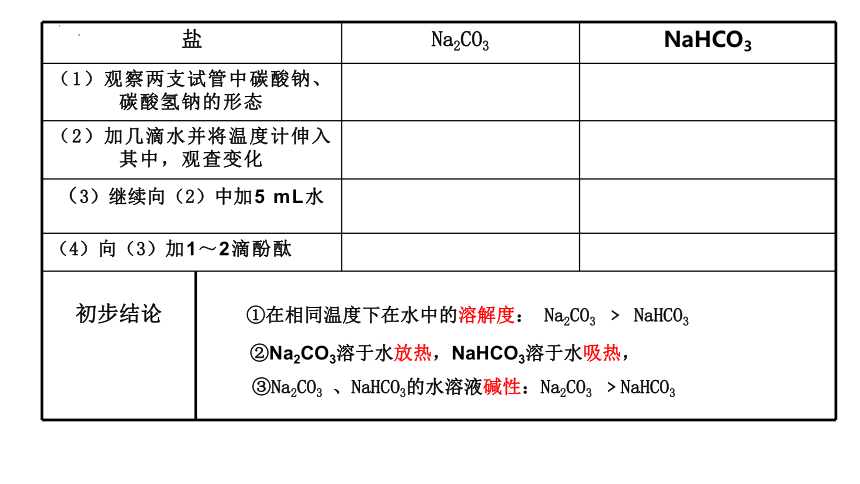
【实验2-4】在两只试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
从碳酸钠、碳酸氢钠的水溶性及酸碱性等方面观察实验现象并记录实验数据。
1.碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究
【二】实验探究,分析解决问题
盐 Na2CO3 NaHCO3
(1)观察两支试管中碳酸钠、碳酸氢钠的形态
(2)加几滴水并将温度计伸入其中,观查变化
(3)继续向(2)中加5 mL水
(4)向(3)加1~2滴酚酞
初步结论 Na2CO3溶于水___热,NaHCO3溶于水___热,
①在相同温度下在水中的溶解度: Na2CO3 ﹥ NaHCO3
③Na2CO3 、NaHCO3的水溶液碱性:Na2CO3 ﹥NaHCO3
②Na2CO3溶于水放热,NaHCO3溶于水吸热,
【实验2-5】如图2-7所示,分别加热Na2CO3和NaHCO3的,观察现象,比较Na2CO3和NaHCO3的热稳定性
2.碳酸钠、碳酸氢钠热稳定性的实验探究
思考:1.碳酸氢钠干粉灭火剂不能用来灭钠起火。为什么?
2.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后体积比原来大了好多。你知道原因是什么吗?请用化学方程式解析。
问题1:在初中我们知道可以用碳酸氢钠治疗胃酸过多,为何不用碳酸钠?
问题2:请根据反应思考能不能用该反应鉴别碳酸钠和碳酸氢钠?
3.碳酸钠、碳酸氢钠与常见物质的反应探究
(1)与盐酸的反应:
问题3:为何碳酸氢钠与盐酸反应更快?
宏观现象对比与微观解析
Na2CO3 NaHCO3
现象
微观解析
反应较剧烈,有气泡产生
反应很剧烈,有气泡产生
(2)与Ca(OH)2溶液的反应:
思考:请根据反应思考能不能用该反应鉴别碳酸钠和碳酸氢钠?是否有其他试剂可以用于 鉴别碳酸钠和碳酸氢钠?
(3)与CaCl2溶液的反应
Na2CO3与NaHCO3的鉴别、除杂与转化
依据 方法
热稳定性
与CaCl2(BaCl2)的反应
固体与盐酸反应的剧烈程度
溶液中逐滴加入盐酸时的现象
混合物 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
Na2CO3
NaHCO3
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名
颜色状态
溶解性
水溶液酸碱性
与盐酸
与澄清石灰水
与氯化钙溶液
热稳定性
课堂小结
(1)碳酸氢钠可用于治疗胃酸过多( )
(2) 在强酸性、强碱性溶液中均不能大量共存( )
(3)Na2CO3固体中的NaHCO3可加热除去( )
(4)Na2CO3、NaHCO3都能与NaOH溶液反应( )
(5)Na2CO3俗称纯碱,所以Na2CO3属于碱( )
同步练习
1、判断正误,正确的打“√”,错误的打“×”。
2、下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
我国化学工程专家侯德榜于1943年创立侯氏制碱法。原料是食盐水、氨气和二氧化碳,产品为纯碱和氯化铵。此方法提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足,曾在全球享有盛誉,得到普遍采用。变换气制碱的联碱工艺,是我国独创,具有显著的节能效果。
侯氏制碱法
了解:
反应原理:
1.将二氧化碳通入氨的氯化钠饱和溶液中,
使溶解度较小的碳酸氢钠从溶液中析出。
2.碳酸氢钠受热分解生成碳酸钠、水和二氧化碳
侯氏制碱法工艺流程图
第4课时 焰色试验
回顾旧知
1、同学们学过很多燃烧实验,都有什么样的共同特点?
2、金属钠进行燃烧时,观察到的火焰的颜色吗?
核心素养发展目标:
1、了解焰色试验的现象及原理,提升自身的实验探究能力与创新意识。
2、能够从宏观角度解释焰色试验,培养“宏观辨识”的核心素养。
三、焰色试验
1、概念
[实验2-6]把熔嵌在玻璃棒上的铂丝(或用光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼烧,等到跟原来的火焰颜色相同时,用铂丝(或铁丝)蘸取碳酸钠溶液,放在外焰上灼烧,观察火焰的颜色。
用稀盐酸洗净铂丝,在火焰上灼烧到火焰颜色相同时,再蘸取碳酸钾溶液做同样的实验,此时要透过蓝色的钻玻璃观察火焰的颜色。
实验现象:
1、焰色试验定义:
根据火焰呈现的特殊颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作
4.应用
(1)检验金属元素的存在,如鉴别NaCl和KCl溶液。
2. 焰色试验操作步骤
3、几种金属的焰色
(2)做焰火材料
节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。
谢谢观看
第一节 钠及其化合物
第3课时 碳酸钠和碳酸氢钠
学习目标:
1、从物质类别和生活实际,归纳碳酸钠和碳酸氢钠的性质
2、运用变化观念理解并掌握Na2CO3、NaHCO3相互转化的途径
3、认识化学在纯碱生产中的贡献,增强实验探究与创新意识,提升科学精神与社会责任感
【学习任务一】温故知新,发现问题
在初中,我们就已经学过了几种常见的钠盐碳酸钠,碳酸氢钠等它们的性质。此外,我们也知道了他们的一些用途,你还记得都有哪些用途吗?
2、碳酸钠和碳酸氢钠
【思考】性质决定用途,上述用途分别利用了碳酸钠和碳酸氢钠的哪些性质呢?
【实验2-4】在两只试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
从碳酸钠、碳酸氢钠的水溶性及酸碱性等方面观察实验现象并记录实验数据。
1.碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究
【二】实验探究,分析解决问题
盐 Na2CO3 NaHCO3
(1)观察两支试管中碳酸钠、碳酸氢钠的形态
(2)加几滴水并将温度计伸入其中,观查变化
(3)继续向(2)中加5 mL水
(4)向(3)加1~2滴酚酞
初步结论 Na2CO3溶于水___热,NaHCO3溶于水___热,
①在相同温度下在水中的溶解度: Na2CO3 ﹥ NaHCO3
③Na2CO3 、NaHCO3的水溶液碱性:Na2CO3 ﹥NaHCO3
②Na2CO3溶于水放热,NaHCO3溶于水吸热,
【实验2-5】如图2-7所示,分别加热Na2CO3和NaHCO3的,观察现象,比较Na2CO3和NaHCO3的热稳定性
2.碳酸钠、碳酸氢钠热稳定性的实验探究
思考:1.碳酸氢钠干粉灭火剂不能用来灭钠起火。为什么?
2.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后体积比原来大了好多。你知道原因是什么吗?请用化学方程式解析。
问题1:在初中我们知道可以用碳酸氢钠治疗胃酸过多,为何不用碳酸钠?
问题2:请根据反应思考能不能用该反应鉴别碳酸钠和碳酸氢钠?
3.碳酸钠、碳酸氢钠与常见物质的反应探究
(1)与盐酸的反应:
问题3:为何碳酸氢钠与盐酸反应更快?
宏观现象对比与微观解析
Na2CO3 NaHCO3
现象
微观解析
反应较剧烈,有气泡产生
反应很剧烈,有气泡产生
(2)与Ca(OH)2溶液的反应:
思考:请根据反应思考能不能用该反应鉴别碳酸钠和碳酸氢钠?是否有其他试剂可以用于 鉴别碳酸钠和碳酸氢钠?
(3)与CaCl2溶液的反应
Na2CO3与NaHCO3的鉴别、除杂与转化
依据 方法
热稳定性
与CaCl2(BaCl2)的反应
固体与盐酸反应的剧烈程度
溶液中逐滴加入盐酸时的现象
混合物 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
Na2CO3
NaHCO3
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名
颜色状态
溶解性
水溶液酸碱性
与盐酸
与澄清石灰水
与氯化钙溶液
热稳定性
课堂小结
(1)碳酸氢钠可用于治疗胃酸过多( )
(2) 在强酸性、强碱性溶液中均不能大量共存( )
(3)Na2CO3固体中的NaHCO3可加热除去( )
(4)Na2CO3、NaHCO3都能与NaOH溶液反应( )
(5)Na2CO3俗称纯碱,所以Na2CO3属于碱( )
同步练习
1、判断正误,正确的打“√”,错误的打“×”。
2、下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
我国化学工程专家侯德榜于1943年创立侯氏制碱法。原料是食盐水、氨气和二氧化碳,产品为纯碱和氯化铵。此方法提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足,曾在全球享有盛誉,得到普遍采用。变换气制碱的联碱工艺,是我国独创,具有显著的节能效果。
侯氏制碱法
了解:
反应原理:
1.将二氧化碳通入氨的氯化钠饱和溶液中,
使溶解度较小的碳酸氢钠从溶液中析出。
2.碳酸氢钠受热分解生成碳酸钠、水和二氧化碳
侯氏制碱法工艺流程图
第4课时 焰色试验
回顾旧知
1、同学们学过很多燃烧实验,都有什么样的共同特点?
2、金属钠进行燃烧时,观察到的火焰的颜色吗?
核心素养发展目标:
1、了解焰色试验的现象及原理,提升自身的实验探究能力与创新意识。
2、能够从宏观角度解释焰色试验,培养“宏观辨识”的核心素养。
三、焰色试验
1、概念
[实验2-6]把熔嵌在玻璃棒上的铂丝(或用光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼烧,等到跟原来的火焰颜色相同时,用铂丝(或铁丝)蘸取碳酸钠溶液,放在外焰上灼烧,观察火焰的颜色。
用稀盐酸洗净铂丝,在火焰上灼烧到火焰颜色相同时,再蘸取碳酸钾溶液做同样的实验,此时要透过蓝色的钻玻璃观察火焰的颜色。
实验现象:
1、焰色试验定义:
根据火焰呈现的特殊颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作
4.应用
(1)检验金属元素的存在,如鉴别NaCl和KCl溶液。
2. 焰色试验操作步骤
3、几种金属的焰色
(2)做焰火材料
节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。
谢谢观看
