福建省三明永安市2022-2023学年高三上学期期中考试及部分科目模块考试化学试题(PDF版含答案)
文档属性
| 名称 | 福建省三明永安市2022-2023学年高三上学期期中考试及部分科目模块考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-12 15:35:16 | ||
图片预览



文档简介
永安市 2022-2023 学年上学期期中考试及部分科目模块考试卷
高三化学
题号 一 二 总分
得分
完卷时间 75 分钟; 满分 100 分;
本卷可能用到的相对原子量:Na:23 Cu:64 Zn:65 Mg:24 Cl:35.5 C:12 Ag:108 S:32
一、选择题:本题共 12小题,每小题 4分,共 48分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.《开宝本草》载:“硝石(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”.下列叙述正
确的是( )
A.温度降低,硝石的溶解度增大 B.硝石易溶于水,且水溶液显碱性
C.产生“霜”的过程涉及化学变化 D.上述提纯过程涉及溶解、蒸发、结晶
2.下列化学用语或图示表达不.正.确.的是( )
A.Cl-的结构示意图: B.2-甲基丁烷的结构模型:
C.顺式聚异戊二烯的结构简式: D.HC1O的结构式:H-Cl-O
3.下列说法正确的是 ( )
A. Al3+ Cl- SO 2-在中性溶液中能大量共存: 、 、 4 、Na+
B. 含有大量 NO3-能大量共存:、H+、Fe2+、Cl-、SO 2-4
C. 已知中和热为 57.3KJ/mol,则稀氨水与盐酸反应生成 1mol水时放出的热量小于 57.3KJ
D. 已知辛烷的燃烧热为 5518KJ/mol,则辛烷燃烧的热化学方程式:
2C8H18 (l) + 25O2 (g) = 16CO2(g) + 2H2O(g), H=-11036KJ/mol
4. 设 NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 1L1mol/L氯化铵溶液中 NH + +4 与 H 离子数之和大于 NA
B. 22.4L(标准状况)SO2所含的质子数为 40 NA
C. pH=13的 Ba (OH)2溶液中含有 OH-离子数目为 0.1 NA
D. 4.6g乙醇中含有的极性共价键数目为 0.8 NA
1
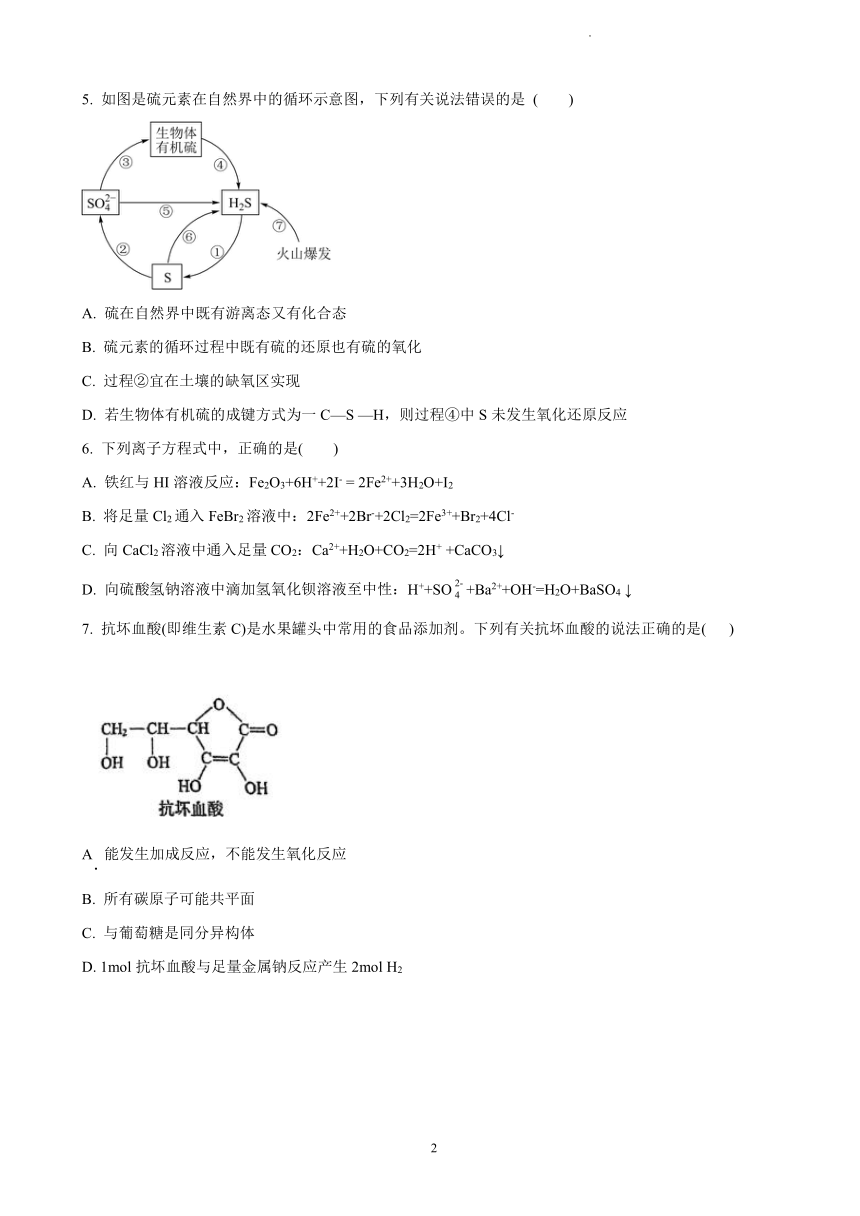
5. 如图是硫元素在自然界中的循环示意图,下列有关说法错误的是 ( )
A. 硫在自然界中既有游离态又有化合态
B. 硫元素的循环过程中既有硫的还原也有硫的氧化
C. 过程②宜在土壤的缺氧区实现
D. 若生物体有机硫的成键方式为一 C—S —H,则过程④中 S未发生氧化还原反应
6. 下列离子方程式中,正确的是( )
A. 铁红与 HI溶液反应:Fe2O3+6H++2I- = 2Fe2++3H2O+I2
B. 将足量 Cl2通入 FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 向 CaCl2溶液中通入足量 CO2:Ca2++H2O+CO2=2H+ +CaCO3↓
D. 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO 2-4 +Ba2++OH-=H2O+BaSO4 ↓
7. 抗坏血酸(即维生素 C)是水果罐头中常用的食品添加剂。下列有关抗坏血酸的说法正确的是( )
A. 能发生加成反应,不能发生氧化反应
B. 所有碳原子可能共平面
C. 与葡萄糖是同分异构体
D. 1mol抗坏血酸与足量金属钠反应产生 2mol H2
2
8. 下列实验操作能达到目的的是 ( )
A. 图 A时除去 CO2气体中的 HC1气体
B. 图 B时除去 NaCl中混有的 NH4C1
C. 图 C时分离 Fe (OH)3胶体中的 KBr
D. 图 D时测量硫酸铜晶体中结晶水含量
9. 短周期非金属元素 X、Y、Z、W的原子序数依次增大,基态 X原子的未成对电子数是其所在周期中最
多的,基态W原子的电子总数是其最高能级电子数的 4倍。四种元素与 Xe元素组成的某化合物的结构如
图所示。下列说法错误的是( )
A. W的常见氧化物是酸性氧化物 B. 气态氢化物的还原性W> Z
C.最简单氢化物的沸点:Z>Y>X
D. X和W的最高价氧化物对应水化物的浓溶液都具有强氧化性
10.下列实验操作和现象所得出的结论正确的是( )
选项 实验操作 现象 结论
A 向某无色溶液中滴加足量稀盐酸 产生白色沉淀 溶液中一定存在Ag
分别向饱和硼酸溶液和稀硫酸溶液中加入少量
前者无气泡冒出,后
B 非金属性:S>C>B
NaHCO3粉末 者有气泡冒出
密闭容器中盛有NO2 ,一段时间后反应达平衡,压 平衡向生成NO2 的方向
C 气体颜色加深
缩体积至原来的一半 移动
向两支试管中加入等体积等浓度的H2O2 溶液,再分
D 后者产生气泡速度快 Fe3 Cu2 催化效果
别滴入等体积等浓度的CuSO4溶液和FeCl3 溶液
3
11.CH4和 Cl2反应生成 CH3Cl和 HCl的反应进程如图所示。
已知总反应分 3步进行:
(1)Cl Cl(g) 2Cl (g) H1 242.7kJ mol
1
(2)CH4 (g) Cl(g) CH3(g) HCl(g) H2
(3) CH3(g) Cl Cl(g) CH3Cl(g) Cl(g) H3
下列有关说法正确的是 ( )
A. H2 0
B.第 2步的反应速率小于第 3步的反应速率
C.根据上述信息,反应中只有 C—H键的断裂和 C—Cl键的形成
D.CH4 (g) Cl2 (g) CH Cl(g) HCl(g) H 112.9kJ mol
1
3
12.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白.一种制备亚氯酸钠
的流程如下.已知:NaClO2高于 60℃时分解成NaClO3 和NaCl .
下列说法不正确的是( )
A.由过程Ⅰ反应可知还原性:SO2 ClO2
B.过程Ⅱ反应的离子方程式为 2ClO2 H2O2 2ClO
2 O2 2H
C.过程Ⅲ应控制温度不超过 60℃
D.过程Ⅰ消耗SO2 物质的量与的过程Ⅱ产生O2物质的量相等
4
二、非选择题:本题共有 4题,共 52分。
13.(12分)(1)EDTA二钠盐(用 Na2H2Y表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
EDTA的结构简式为 。
实验(一):制备 Na2H2Y。
步骤 1:称取一氯乙酸于三口瓶中,慢慢加入 50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤 2:如图 1所示,在 50℃条件下保温小时。
步骤 3:将步骤 2所得混合物倒入烧杯中,用浓盐酸调节 pH至 1.2,析出大量白色沉淀。
步骤 4:从步骤 3所得混合物中分离 Na2H2Y,如图所示。
图 1 图 2
已知:4ClCH2COONa H2NCH2CH2NH2 (NaOOCCH2 )2NCH2CH2N(CH2COONa)2+4HCl。
(1)图 1中三口瓶采用 (填“酒精灯”或“热水浴”)加热。
(2)图 1中仪器 A的名称是 ,NaOH的作用是 。
(3)仪器 B的作用是 ,进水口是 (填“a”或“b”)。
(4)用图 2装置分离 Na2H2Y的优点是 。
(5)分离出来的 Na2H2Y用 (填“冷水”、“热水”或“酒精”)洗涤。
实验(二):用 Na2H2Y溶液测定饮用水的总硬度。
饮用水的总硬度用Mg2+、Ca2+的总浓度表示。取 VmL 1某饮用水于锥形瓶中,滴加 EBT指示剂,用 cmol L
的 Na2H2Y溶液滴定,三次平行实验测定数据如下:
实验 起始读数/mL 终点读数 mL
I 0.25 26.54
II 1.20 26.10
III 0.40 25.50
滴定反应:Ca2 H Y2 CaY2 2H ,Mg2 H Y2 MgY2 2 2 2H
。
1
(6)该饮用水的总硬度为 mol L 。
5
14.(14分)金属钒主要用于冶炼特种钢,被誉为“合金的维生素”。人们在化工实践中,以富钒炉渣(其
中的钒以 FeO V2O3、V2O5等形式存在,还有少量的 SiO2、Al2O3等)为原料提取金属钒的工艺流程如图所
示。
提示:①钒有多种价态,其中+5价最稳定;②V 2O5在碱性条件下可转化为VO3 。
(1)试列举可加快“高温氧化”速率的措施: (填一条)。
(2)“气体 Y”和“滤渣 1”的化学式分别为 、 。
(3)“沉硅、沉铝”中得到含铝沉淀的离子方程式为 。
(4)“高温氧化”过程中,若有 1mol FeO V2O3被氧化,则转移的电子数为 NA。
(5)写出“焙烧”时 Al2O3发生反应的化学方程式: 。
(6)在“高温还原”反应中,氧化钙最终转化为 (写化学式)。
15. (14分)某研究性学习小组设计下列实验探究 Zn 和 FeCl3溶液的反应,回答下列问题:
(1)由 FeCl3固体配制未酸化的 250mL0.5mol·L-1FeCl3溶液(pH=1.3)。
在配制过程中下列操作中,判断对所得溶液浓度的影响(填“偏高”“偏低”“不影响”)
① 容量瓶中有水未干燥 ________________
② 定容时,俯视刻度线_________________
③ 转移溶液时,有少量液体测出__________________
(2)将 Zn 投入到未酸化的 0.5mol·L-1FeCl3 溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
实验编号 条件 现象
刚开始无明显气泡,0.5min 后有气体产生,一段时间后,
i 锌粒 18℃ 溶液颜色加深。向反应后的溶液中滴加铁氰化钾溶液后,
可见蓝色沉淀
产生气泡较快,大约 12 s后,气泡非常明显,溶液很快转
ii 锌粒 65℃ 为红棕色。较长时间后发现红棕色基本消失,最后产生红
棕色沉淀
①实验中产生的气体为___________,实验 ii中产生气体的速率明显快于实验 i,可能的原因是
___________(答出两点)。
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在 Fe2+。生成 Fe2+的离子方程式为___________。
6
(3)实验 i和 ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧
化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且
电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,
φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则 Fe3+、H+、Zn2+ 、Fe2+ 的氧化性大
小关系为 ___________。
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
实验编号 条件 现象
锌粉 18℃ 大约 3min可以看到明显的气泡,溶液颜色逐渐变深。向反应后
iii
不振荡 的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀
锌粉 18℃ 气泡不明显,红褐色褪色明显。向反应后的溶液中滴加铁氰化
iv
振荡 钾溶液后,可见蓝色沉淀
对比实验 iii和 iv,实验 iv中“气泡不明显,红褐色褪色明显”的原因可能为___________。
③结合实验探究过程及现象分析,影响 Zn与 FeCl3溶液反应的条件有___________(答两点即可的)。
16. (12分)某合金废料经分析含有 20.7%的 Pb、64%的 Cu和 13.4%的 Ag。某化学研究小组以该合金废料为
原料,设计了如下工艺流程制备 PbO2、Ag 和 CuSO4·5H2O。 回答下列问题:
(1)铅与稀 HNO3发生反应的化学方程式是___________。
(2)氧化酸溶时 Ag发生反应的离子方程式:___________。
(3)操作 2所得滤液的成分是___________(填化学式),要想得到 CuSO4·5H2O,需要在滤液中加入足量的
氢氧化钠溶液,经过滤、洗涤,在沉淀物中加入稀硫酸,经___________、过滤、低温干燥得到 CuSO4·5H2O。
(4)100 g合金,经过上述流程处理后得到 10.05gAg 和 250gCuSO4·5H2O计算银的回收率是___________,
合金废料中的铜___________(填“是”或“不是”)全部被回收,原因是___________。
7
选择题答案
1-5DDCAC 6-10ADDCB 11-12BB
13.(12分)(1)热水浴(1分)
(2)滴液漏斗(或恒压漏斗,1分);中和产物中的 HCl(2分)
(3)冷凝回流,提高原料利用率(2分);b(1分)
(4)过滤速率加快(2分)
(5)冷水(1分)
25c
(6) (2分)
V
【解析】本题主要考查实验基本操作与设计,考查学生的实验能力。
(2)根据反应原理知,乙二胺与氯乙酸钠反应生成了氯化氢,加入氢氧化钠中和氯化氢,促进反应向正反
应方向进行。
(3)图 1中冷凝管起冷凝回流的作用,提高有机原料利用率。冷凝管下口进水,上口出水,提高水的冷却
效率。
(4)抽去部分空气,减小抽滤瓶内的压强,在外压和重力作用下过滤速率加快。
(5)产品易溶于乙醇,微溶于冷水,选择冷水洗涤。
(6)实验 I、II、III消耗 Na2H2Y溶液的体积依次为 26.29mL、24.90mL、25.10mL。舍去 26.29mL,剩余
两次实验消耗滴定液的平均体积为 25.00mL。该饮用水总硬度为 。
c(Ca2 ,Mg2 ) 25c mol L 1
V
14.(14分)(1)将富钒炉渣粉碎(或将 KClO3与富钒炉渣充分混合等合理答案,2分)
(2)NH3(2分);Fe2O3(2分)
(3)AlO 2 HCO
3 H2O Al(OH)3 CO
2
3 (2分)
(4)5(2分)
Al O Na CO 高温(5) 2 3 2 3 2NaAlO2 CO2 (2分)
(6)CaSiO3(2分)
【解析】本题主要考查制备金属钒的工艺流程,考查学生对元素化合物的理解能力和综合运用能力。
(3)富钒炉渣中的 Al2O3通过“焙烧”和“浸取”过程转变为AlO 2 ,遇 NH4HCO3时转化为 Al(OH)3沉淀,
相应的离子方程式为AlO 2 HCO
3 H2O Al(OH)3 CO
2
3 。
(4)“高温氧化”过程中,FeO V2O3被氧化为 Fe2O3和 V2O5,则 1mol FeO V2O3失去 5mol电子。
高温
(5)“焙烧”时 Al2O3与碳酸钠在高温条件下发生反应Al2O3 Na 2CO3 2NaAlO2 CO2 。
高温
(6)硅在高温时将钒还原(5Si 2V2O5 4V 5SiO2),同时生成的二氧化硅与氧化钙反应生成
炉渣(SiO2 CaO
高温 CaSiO3)。
8
15(14分)【答案】(1)(3 分)① “不影响”② “偏高”③ “偏低”
(2) ①. (1分)H2 ②. (2分)温度升高、c(H+)浓度增大 ③. (2分)2Fe3++Zn=2Fe2++Zn2+
(3) (2分)①. Fe3+>H+>Fe2+>Zn2+ (2 分)②. 将 Zn 粒改为 Zn 粉并振荡,增大了 Zn 与 Fe3+碰撞
几率,加快了 Zn与 Fe3+的反应 (2分)③. 反应温度、碰撞几率(离子迁移速度)、粒子的氧化性强弱
16(12分)【答案】(1)3Pb+8H++2NO 3 =3Pb3++2NO↑+4H2O (2分)
(2)2Ag+H2O2+2HNO3= 2AgNO3+2H2O (2分)
(3) ①. Cu(NO3)2(2分) ②. 蒸发浓缩、冷却结晶 (2分)
(4) ①. 75% (2分) ②. 是,铜理论质量与实际质量相等(2分)
9
高三化学
题号 一 二 总分
得分
完卷时间 75 分钟; 满分 100 分;
本卷可能用到的相对原子量:Na:23 Cu:64 Zn:65 Mg:24 Cl:35.5 C:12 Ag:108 S:32
一、选择题:本题共 12小题,每小题 4分,共 48分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.《开宝本草》载:“硝石(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”.下列叙述正
确的是( )
A.温度降低,硝石的溶解度增大 B.硝石易溶于水,且水溶液显碱性
C.产生“霜”的过程涉及化学变化 D.上述提纯过程涉及溶解、蒸发、结晶
2.下列化学用语或图示表达不.正.确.的是( )
A.Cl-的结构示意图: B.2-甲基丁烷的结构模型:
C.顺式聚异戊二烯的结构简式: D.HC1O的结构式:H-Cl-O
3.下列说法正确的是 ( )
A. Al3+ Cl- SO 2-在中性溶液中能大量共存: 、 、 4 、Na+
B. 含有大量 NO3-能大量共存:、H+、Fe2+、Cl-、SO 2-4
C. 已知中和热为 57.3KJ/mol,则稀氨水与盐酸反应生成 1mol水时放出的热量小于 57.3KJ
D. 已知辛烷的燃烧热为 5518KJ/mol,则辛烷燃烧的热化学方程式:
2C8H18 (l) + 25O2 (g) = 16CO2(g) + 2H2O(g), H=-11036KJ/mol
4. 设 NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 1L1mol/L氯化铵溶液中 NH + +4 与 H 离子数之和大于 NA
B. 22.4L(标准状况)SO2所含的质子数为 40 NA
C. pH=13的 Ba (OH)2溶液中含有 OH-离子数目为 0.1 NA
D. 4.6g乙醇中含有的极性共价键数目为 0.8 NA
1
5. 如图是硫元素在自然界中的循环示意图,下列有关说法错误的是 ( )
A. 硫在自然界中既有游离态又有化合态
B. 硫元素的循环过程中既有硫的还原也有硫的氧化
C. 过程②宜在土壤的缺氧区实现
D. 若生物体有机硫的成键方式为一 C—S —H,则过程④中 S未发生氧化还原反应
6. 下列离子方程式中,正确的是( )
A. 铁红与 HI溶液反应:Fe2O3+6H++2I- = 2Fe2++3H2O+I2
B. 将足量 Cl2通入 FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 向 CaCl2溶液中通入足量 CO2:Ca2++H2O+CO2=2H+ +CaCO3↓
D. 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO 2-4 +Ba2++OH-=H2O+BaSO4 ↓
7. 抗坏血酸(即维生素 C)是水果罐头中常用的食品添加剂。下列有关抗坏血酸的说法正确的是( )
A. 能发生加成反应,不能发生氧化反应
B. 所有碳原子可能共平面
C. 与葡萄糖是同分异构体
D. 1mol抗坏血酸与足量金属钠反应产生 2mol H2
2
8. 下列实验操作能达到目的的是 ( )
A. 图 A时除去 CO2气体中的 HC1气体
B. 图 B时除去 NaCl中混有的 NH4C1
C. 图 C时分离 Fe (OH)3胶体中的 KBr
D. 图 D时测量硫酸铜晶体中结晶水含量
9. 短周期非金属元素 X、Y、Z、W的原子序数依次增大,基态 X原子的未成对电子数是其所在周期中最
多的,基态W原子的电子总数是其最高能级电子数的 4倍。四种元素与 Xe元素组成的某化合物的结构如
图所示。下列说法错误的是( )
A. W的常见氧化物是酸性氧化物 B. 气态氢化物的还原性W> Z
C.最简单氢化物的沸点:Z>Y>X
D. X和W的最高价氧化物对应水化物的浓溶液都具有强氧化性
10.下列实验操作和现象所得出的结论正确的是( )
选项 实验操作 现象 结论
A 向某无色溶液中滴加足量稀盐酸 产生白色沉淀 溶液中一定存在Ag
分别向饱和硼酸溶液和稀硫酸溶液中加入少量
前者无气泡冒出,后
B 非金属性:S>C>B
NaHCO3粉末 者有气泡冒出
密闭容器中盛有NO2 ,一段时间后反应达平衡,压 平衡向生成NO2 的方向
C 气体颜色加深
缩体积至原来的一半 移动
向两支试管中加入等体积等浓度的H2O2 溶液,再分
D 后者产生气泡速度快 Fe3 Cu2 催化效果
别滴入等体积等浓度的CuSO4溶液和FeCl3 溶液
3
11.CH4和 Cl2反应生成 CH3Cl和 HCl的反应进程如图所示。
已知总反应分 3步进行:
(1)Cl Cl(g) 2Cl (g) H1 242.7kJ mol
1
(2)CH4 (g) Cl(g) CH3(g) HCl(g) H2
(3) CH3(g) Cl Cl(g) CH3Cl(g) Cl(g) H3
下列有关说法正确的是 ( )
A. H2 0
B.第 2步的反应速率小于第 3步的反应速率
C.根据上述信息,反应中只有 C—H键的断裂和 C—Cl键的形成
D.CH4 (g) Cl2 (g) CH Cl(g) HCl(g) H 112.9kJ mol
1
3
12.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白.一种制备亚氯酸钠
的流程如下.已知:NaClO2高于 60℃时分解成NaClO3 和NaCl .
下列说法不正确的是( )
A.由过程Ⅰ反应可知还原性:SO2 ClO2
B.过程Ⅱ反应的离子方程式为 2ClO2 H2O2 2ClO
2 O2 2H
C.过程Ⅲ应控制温度不超过 60℃
D.过程Ⅰ消耗SO2 物质的量与的过程Ⅱ产生O2物质的量相等
4
二、非选择题:本题共有 4题,共 52分。
13.(12分)(1)EDTA二钠盐(用 Na2H2Y表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
EDTA的结构简式为 。
实验(一):制备 Na2H2Y。
步骤 1:称取一氯乙酸于三口瓶中,慢慢加入 50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤 2:如图 1所示,在 50℃条件下保温小时。
步骤 3:将步骤 2所得混合物倒入烧杯中,用浓盐酸调节 pH至 1.2,析出大量白色沉淀。
步骤 4:从步骤 3所得混合物中分离 Na2H2Y,如图所示。
图 1 图 2
已知:4ClCH2COONa H2NCH2CH2NH2 (NaOOCCH2 )2NCH2CH2N(CH2COONa)2+4HCl。
(1)图 1中三口瓶采用 (填“酒精灯”或“热水浴”)加热。
(2)图 1中仪器 A的名称是 ,NaOH的作用是 。
(3)仪器 B的作用是 ,进水口是 (填“a”或“b”)。
(4)用图 2装置分离 Na2H2Y的优点是 。
(5)分离出来的 Na2H2Y用 (填“冷水”、“热水”或“酒精”)洗涤。
实验(二):用 Na2H2Y溶液测定饮用水的总硬度。
饮用水的总硬度用Mg2+、Ca2+的总浓度表示。取 VmL 1某饮用水于锥形瓶中,滴加 EBT指示剂,用 cmol L
的 Na2H2Y溶液滴定,三次平行实验测定数据如下:
实验 起始读数/mL 终点读数 mL
I 0.25 26.54
II 1.20 26.10
III 0.40 25.50
滴定反应:Ca2 H Y2 CaY2 2H ,Mg2 H Y2 MgY2 2 2 2H
。
1
(6)该饮用水的总硬度为 mol L 。
5
14.(14分)金属钒主要用于冶炼特种钢,被誉为“合金的维生素”。人们在化工实践中,以富钒炉渣(其
中的钒以 FeO V2O3、V2O5等形式存在,还有少量的 SiO2、Al2O3等)为原料提取金属钒的工艺流程如图所
示。
提示:①钒有多种价态,其中+5价最稳定;②V 2O5在碱性条件下可转化为VO3 。
(1)试列举可加快“高温氧化”速率的措施: (填一条)。
(2)“气体 Y”和“滤渣 1”的化学式分别为 、 。
(3)“沉硅、沉铝”中得到含铝沉淀的离子方程式为 。
(4)“高温氧化”过程中,若有 1mol FeO V2O3被氧化,则转移的电子数为 NA。
(5)写出“焙烧”时 Al2O3发生反应的化学方程式: 。
(6)在“高温还原”反应中,氧化钙最终转化为 (写化学式)。
15. (14分)某研究性学习小组设计下列实验探究 Zn 和 FeCl3溶液的反应,回答下列问题:
(1)由 FeCl3固体配制未酸化的 250mL0.5mol·L-1FeCl3溶液(pH=1.3)。
在配制过程中下列操作中,判断对所得溶液浓度的影响(填“偏高”“偏低”“不影响”)
① 容量瓶中有水未干燥 ________________
② 定容时,俯视刻度线_________________
③ 转移溶液时,有少量液体测出__________________
(2)将 Zn 投入到未酸化的 0.5mol·L-1FeCl3 溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
实验编号 条件 现象
刚开始无明显气泡,0.5min 后有气体产生,一段时间后,
i 锌粒 18℃ 溶液颜色加深。向反应后的溶液中滴加铁氰化钾溶液后,
可见蓝色沉淀
产生气泡较快,大约 12 s后,气泡非常明显,溶液很快转
ii 锌粒 65℃ 为红棕色。较长时间后发现红棕色基本消失,最后产生红
棕色沉淀
①实验中产生的气体为___________,实验 ii中产生气体的速率明显快于实验 i,可能的原因是
___________(答出两点)。
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在 Fe2+。生成 Fe2+的离子方程式为___________。
6
(3)实验 i和 ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧
化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且
电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,
φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则 Fe3+、H+、Zn2+ 、Fe2+ 的氧化性大
小关系为 ___________。
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
实验编号 条件 现象
锌粉 18℃ 大约 3min可以看到明显的气泡,溶液颜色逐渐变深。向反应后
iii
不振荡 的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀
锌粉 18℃ 气泡不明显,红褐色褪色明显。向反应后的溶液中滴加铁氰化
iv
振荡 钾溶液后,可见蓝色沉淀
对比实验 iii和 iv,实验 iv中“气泡不明显,红褐色褪色明显”的原因可能为___________。
③结合实验探究过程及现象分析,影响 Zn与 FeCl3溶液反应的条件有___________(答两点即可的)。
16. (12分)某合金废料经分析含有 20.7%的 Pb、64%的 Cu和 13.4%的 Ag。某化学研究小组以该合金废料为
原料,设计了如下工艺流程制备 PbO2、Ag 和 CuSO4·5H2O。 回答下列问题:
(1)铅与稀 HNO3发生反应的化学方程式是___________。
(2)氧化酸溶时 Ag发生反应的离子方程式:___________。
(3)操作 2所得滤液的成分是___________(填化学式),要想得到 CuSO4·5H2O,需要在滤液中加入足量的
氢氧化钠溶液,经过滤、洗涤,在沉淀物中加入稀硫酸,经___________、过滤、低温干燥得到 CuSO4·5H2O。
(4)100 g合金,经过上述流程处理后得到 10.05gAg 和 250gCuSO4·5H2O计算银的回收率是___________,
合金废料中的铜___________(填“是”或“不是”)全部被回收,原因是___________。
7
选择题答案
1-5DDCAC 6-10ADDCB 11-12BB
13.(12分)(1)热水浴(1分)
(2)滴液漏斗(或恒压漏斗,1分);中和产物中的 HCl(2分)
(3)冷凝回流,提高原料利用率(2分);b(1分)
(4)过滤速率加快(2分)
(5)冷水(1分)
25c
(6) (2分)
V
【解析】本题主要考查实验基本操作与设计,考查学生的实验能力。
(2)根据反应原理知,乙二胺与氯乙酸钠反应生成了氯化氢,加入氢氧化钠中和氯化氢,促进反应向正反
应方向进行。
(3)图 1中冷凝管起冷凝回流的作用,提高有机原料利用率。冷凝管下口进水,上口出水,提高水的冷却
效率。
(4)抽去部分空气,减小抽滤瓶内的压强,在外压和重力作用下过滤速率加快。
(5)产品易溶于乙醇,微溶于冷水,选择冷水洗涤。
(6)实验 I、II、III消耗 Na2H2Y溶液的体积依次为 26.29mL、24.90mL、25.10mL。舍去 26.29mL,剩余
两次实验消耗滴定液的平均体积为 25.00mL。该饮用水总硬度为 。
c(Ca2 ,Mg2 ) 25c mol L 1
V
14.(14分)(1)将富钒炉渣粉碎(或将 KClO3与富钒炉渣充分混合等合理答案,2分)
(2)NH3(2分);Fe2O3(2分)
(3)AlO 2 HCO
3 H2O Al(OH)3 CO
2
3 (2分)
(4)5(2分)
Al O Na CO 高温(5) 2 3 2 3 2NaAlO2 CO2 (2分)
(6)CaSiO3(2分)
【解析】本题主要考查制备金属钒的工艺流程,考查学生对元素化合物的理解能力和综合运用能力。
(3)富钒炉渣中的 Al2O3通过“焙烧”和“浸取”过程转变为AlO 2 ,遇 NH4HCO3时转化为 Al(OH)3沉淀,
相应的离子方程式为AlO 2 HCO
3 H2O Al(OH)3 CO
2
3 。
(4)“高温氧化”过程中,FeO V2O3被氧化为 Fe2O3和 V2O5,则 1mol FeO V2O3失去 5mol电子。
高温
(5)“焙烧”时 Al2O3与碳酸钠在高温条件下发生反应Al2O3 Na 2CO3 2NaAlO2 CO2 。
高温
(6)硅在高温时将钒还原(5Si 2V2O5 4V 5SiO2),同时生成的二氧化硅与氧化钙反应生成
炉渣(SiO2 CaO
高温 CaSiO3)。
8
15(14分)【答案】(1)(3 分)① “不影响”② “偏高”③ “偏低”
(2) ①. (1分)H2 ②. (2分)温度升高、c(H+)浓度增大 ③. (2分)2Fe3++Zn=2Fe2++Zn2+
(3) (2分)①. Fe3+>H+>Fe2+>Zn2+ (2 分)②. 将 Zn 粒改为 Zn 粉并振荡,增大了 Zn 与 Fe3+碰撞
几率,加快了 Zn与 Fe3+的反应 (2分)③. 反应温度、碰撞几率(离子迁移速度)、粒子的氧化性强弱
16(12分)【答案】(1)3Pb+8H++2NO 3 =3Pb3++2NO↑+4H2O (2分)
(2)2Ag+H2O2+2HNO3= 2AgNO3+2H2O (2分)
(3) ①. Cu(NO3)2(2分) ②. 蒸发浓缩、冷却结晶 (2分)
(4) ①. 75% (2分) ②. 是,铜理论质量与实际质量相等(2分)
9
同课章节目录
