化学人教版(2019)选择性必修1 2.4 化学反应的调控(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4 化学反应的调控(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-13 10:17:32 | ||
图片预览




文档简介
(共23张PPT)
第二章 化学反应速率与平衡
第四节 化学反应的调控
第1课时
化学反应的调控
我们对化学反应的调控并不陌生。例如,为了灭火,可以采取隔离可燃物、隔绝空气或降低温度等措施;为了延长食物储存时间,可以将它们保存在冰箱中。
1、合成氨的应用(固氮):18世纪末,英国化学家克鲁克斯“先天下之忧而忧”,率先发出为了使子孙后代免于饥饿“向空气要氮肥”的号召。
一、工业合成氨
N2(g)+3H2(g) 2NH3(g)
已知298 K时:ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1。
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:ΔH<0,熵变:ΔS<0。
(4)自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行。
2、合成氨反应的特点
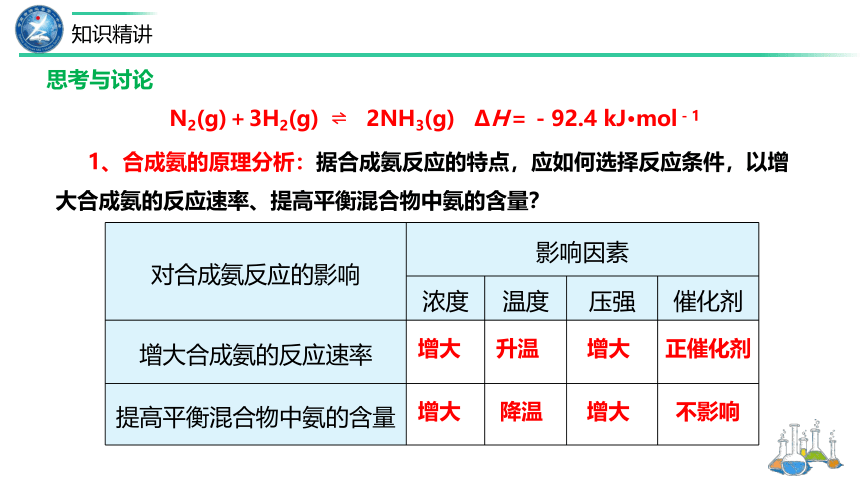
1、合成氨的原理分析:据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
对合成氨反应的影响 影响因素
浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大
增大
升温
降温
增大
增大
正催化剂
不影响
思考与讨论
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
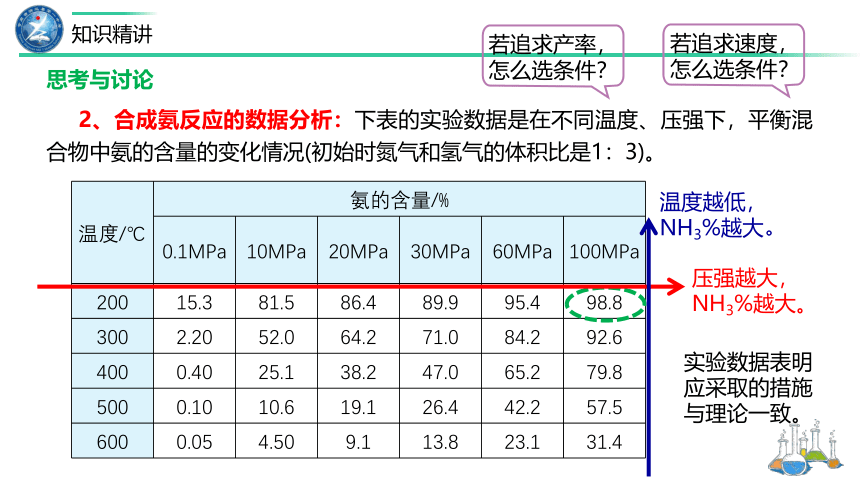
2、合成氨反应的数据分析:下表的实验数据是在不同温度、压强下,平衡混合物中氨的含量的变化情况(初始时氮气和氢气的体积比是1:3)。
温度/℃ 氨的含量/%
0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
若追求速度,怎么选条件?
若追求产率,怎么选条件?
压强越大,NH3%越大。
温度越低,NH3%越大。
实验数据表明应采取的措施与理论一致。
思考与讨论
①升高温度,氨的含量降低,化学反应速率加快。两者矛盾;
②增大压强,氨的含量增大,化学反应速率加快。两者一致。
那么实际生成中到底选择哪些适宜的条件呢?
3、合成氨反应的结论分析:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
思考与讨论
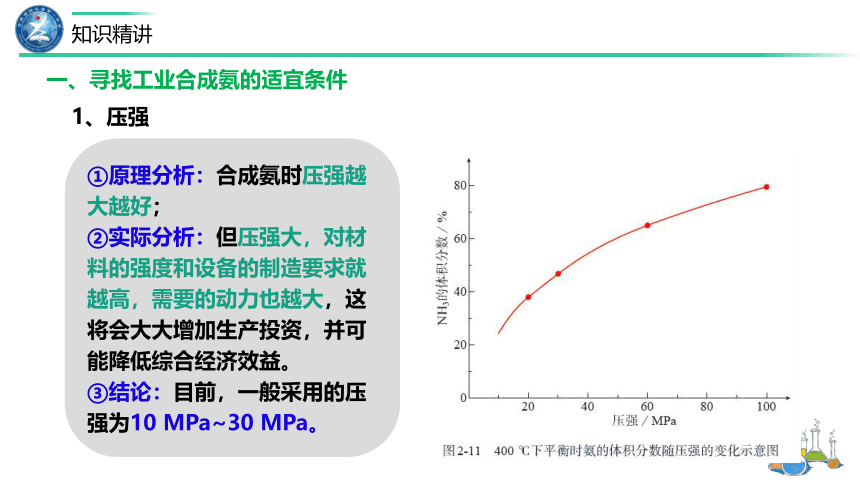
1、压强
①原理分析:合成氨时压强越大越好;
②实际分析:但压强大,对材料的强度和设备的制造要求就越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益。
③结论:目前,一般采用的压强为10 MPa~30 MPa。
一、寻找工业合成氨的适宜条件
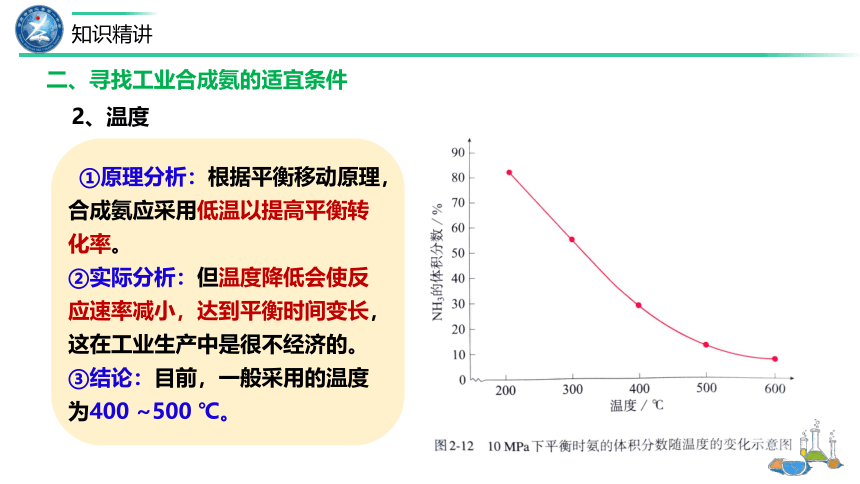
①原理分析:根据平衡移动原理,合成氨应采用低温以提高平衡转化率。
②实际分析:但温度降低会使反应速率减小,达到平衡时间变长,这在工业生产中是很不经济的。
③结论:目前,一般采用的温度为400 ~500 ℃。
二、寻找工业合成氨的适宜条件
2、温度
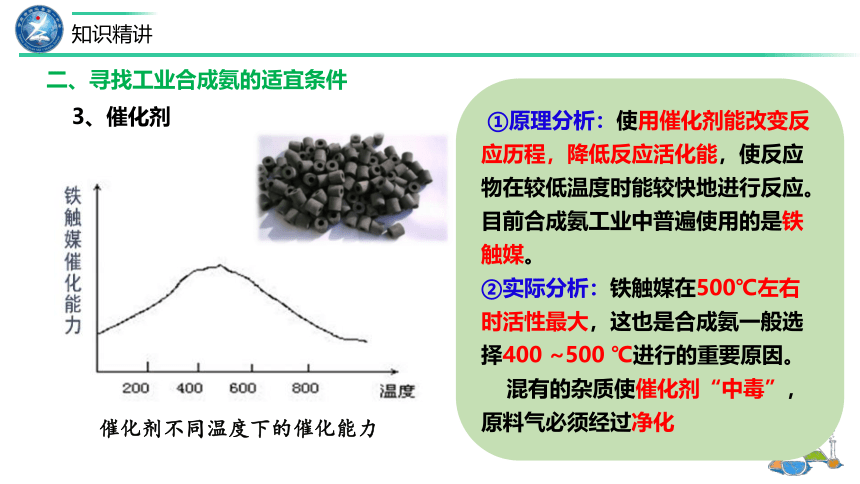
①原理分析:使用催化剂能改变反应历程,降低反应活化能,使反应物在较低温度时能较快地进行反应。目前合成氨工业中普遍使用的是铁触媒。
②实际分析:铁触媒在500℃左右时活性最大,这也是合成氨一般选择400 ~500 ℃进行的重要原因。
混有的杂质使催化剂“中毒”,原料气必须经过净化
催化剂不同温度下的催化能力
二、寻找工业合成氨的适宜条件
3、催化剂
①原理分析:为提高平衡转化率,工业上采取迅速冷却的方法,使氨气变成液氨并及时分离减小生成物浓度,平衡向正向移动,提高氨的产率。
②实际分析:分离后的原料气N2和H2,并及时补充循环使用,使反应物保持一定的浓度。
二、寻找工业合成氨的适宜条件
4、浓度
综上所述,工业上通常采用铁触媒、400~500 ℃、10~30 Mpa、N2和H2的投料比为1∶2.8,及时分离氨,原料气循环使用。
哈伯
(1918年)
合成氨的基础开发工
博施
(1931年)
实现了合成氨的工业化
埃特尔
(2007年)
揭开了合成氨的“天机”
合成氨与三次诺贝尔化学奖
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350℃、1 MPa 。
更加节能、降低成本
知识拓展
三、合成氨工业流程
1、干燥、净化:除去原料气中的杂质,防止催化剂“中毒”而降低或丧失催化活性。
2、压缩机加压:增大压强
3、热交换:合成氨为放热反应,反应体系温度逐渐升高,为原料气反应提供热量,故热交换
可充分利用能源,提高经济效益。
三、合成氨工业流程
4、冷却:NH3的液化需较低温度,迅速冷却使气态氨变成液氨后及时从平衡混合物中分离,
促使平衡向生成NH3的方向移动。
5、循环使用原料气:因合成氨为可逆反应,平衡混合物中含有原料气,将NH3分离后的原料
气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,
提高经济效益。
1、影响化学反应进行的因素
(1)内因:参加反应的物质的组成、结构和性质等本身因素;
(2)外因:温度、压强、浓度、催化剂等反应条件。
四、化学反应条件的控制
2、化学反应的调控
(1)含义:通过改变反应条件使一个可能发生的反应按照某一方向进行。
(2)考虑实际因素
a、结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找合适的生产条件。
b、根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
设备可行
成本核算
如何为一个化学反应选择适宜的生产条件?
影响因素
调控反应
化学平衡
反应速率
最佳效果
化学反应的调控
(1)温度越高越利于合成氨反应平衡正向移动。 ( )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。 ( )
(3)使用催化剂能提高合成氨反应物的平衡转化率。 ( )
(4)充入的N2越多越有利于NH3的合成。 ( )
(5)恒容条件下充入稀有气体有利于NH3的合成。 ( )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。( )
练习1、判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
×
×
练习3、有关合成氨工业的说法中,正确的是( )
A、增大H2的浓度,可提高H2的转化率
B、由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高
C、合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动
D、合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
B
练习4、有平衡体系:CO(g)+2H2(g) CH3OH(g) ΔH<0。为了增加甲醇(CH3OH)的产量,应采取的正确措施是( )
A、高温,高压 B、适宜温度,高压,催化剂
C、低温,低压 D、高温,高压,催化剂
B
练习5、工业上合成氨一般采用400~500 ℃的温度,其原因是 ( )
①适当提高氨的合成速率 ②提高H2的转化率 ③提高氨的产率 ④催化剂在500 ℃左右活性最大
A、只有① B、只有①② C、②③④ D、只有①④
D
练习6、在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A、加催化剂,v(正)、v(逆)都发生变化且变化的倍数相等
B、加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C、降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数
D、等容条件下加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
D
练习7、某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A、工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B、若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率
C、工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D、工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
D
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
压强
温度
转化率
练习8、 在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1。(已知催化剂是V2O5,在400~500 ℃时催化效果最好)下表为不同温度和压强下SO2的转化率(%):
1、根据化学理论分析,为了使二氧化硫尽可能转化为三氧化硫,应选择的条件是什么
2、在实际生产中,选定400~500 ℃作为操作温度,其原因是什么
提示:低温、高压。
提示:兼顾速率和平衡,且在此温度下催化剂的活性最高。
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
压强
温度
转化率
3、根据上表中的数据分析,制取SO3时为什么不采用高压
4、在生产中,通入过量空气的目的是什么
5、尾气中的SO2必须回收的目的是什么
提示:在常压下SO2的转化率就已经很高了(97.5%),若采用高压,平衡能向右移动,但效果并不明显,且采用高压时会增大设备的成本,得不偿失。
提示:增大反应物O2的浓度,提高SO2的转化率。
提示:防止污染环境;循环利用,提高原料的利用率。
再 见
谢谢
第二章 化学反应速率与平衡
第四节 化学反应的调控
第1课时
化学反应的调控
我们对化学反应的调控并不陌生。例如,为了灭火,可以采取隔离可燃物、隔绝空气或降低温度等措施;为了延长食物储存时间,可以将它们保存在冰箱中。
1、合成氨的应用(固氮):18世纪末,英国化学家克鲁克斯“先天下之忧而忧”,率先发出为了使子孙后代免于饥饿“向空气要氮肥”的号召。
一、工业合成氨
N2(g)+3H2(g) 2NH3(g)
已知298 K时:ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1。
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:ΔH<0,熵变:ΔS<0。
(4)自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行。
2、合成氨反应的特点
1、合成氨的原理分析:据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
对合成氨反应的影响 影响因素
浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大
增大
升温
降温
增大
增大
正催化剂
不影响
思考与讨论
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2、合成氨反应的数据分析:下表的实验数据是在不同温度、压强下,平衡混合物中氨的含量的变化情况(初始时氮气和氢气的体积比是1:3)。
温度/℃ 氨的含量/%
0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
若追求速度,怎么选条件?
若追求产率,怎么选条件?
压强越大,NH3%越大。
温度越低,NH3%越大。
实验数据表明应采取的措施与理论一致。
思考与讨论
①升高温度,氨的含量降低,化学反应速率加快。两者矛盾;
②增大压强,氨的含量增大,化学反应速率加快。两者一致。
那么实际生成中到底选择哪些适宜的条件呢?
3、合成氨反应的结论分析:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
思考与讨论
1、压强
①原理分析:合成氨时压强越大越好;
②实际分析:但压强大,对材料的强度和设备的制造要求就越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益。
③结论:目前,一般采用的压强为10 MPa~30 MPa。
一、寻找工业合成氨的适宜条件
①原理分析:根据平衡移动原理,合成氨应采用低温以提高平衡转化率。
②实际分析:但温度降低会使反应速率减小,达到平衡时间变长,这在工业生产中是很不经济的。
③结论:目前,一般采用的温度为400 ~500 ℃。
二、寻找工业合成氨的适宜条件
2、温度
①原理分析:使用催化剂能改变反应历程,降低反应活化能,使反应物在较低温度时能较快地进行反应。目前合成氨工业中普遍使用的是铁触媒。
②实际分析:铁触媒在500℃左右时活性最大,这也是合成氨一般选择400 ~500 ℃进行的重要原因。
混有的杂质使催化剂“中毒”,原料气必须经过净化
催化剂不同温度下的催化能力
二、寻找工业合成氨的适宜条件
3、催化剂
①原理分析:为提高平衡转化率,工业上采取迅速冷却的方法,使氨气变成液氨并及时分离减小生成物浓度,平衡向正向移动,提高氨的产率。
②实际分析:分离后的原料气N2和H2,并及时补充循环使用,使反应物保持一定的浓度。
二、寻找工业合成氨的适宜条件
4、浓度
综上所述,工业上通常采用铁触媒、400~500 ℃、10~30 Mpa、N2和H2的投料比为1∶2.8,及时分离氨,原料气循环使用。
哈伯
(1918年)
合成氨的基础开发工
博施
(1931年)
实现了合成氨的工业化
埃特尔
(2007年)
揭开了合成氨的“天机”
合成氨与三次诺贝尔化学奖
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350℃、1 MPa 。
更加节能、降低成本
知识拓展
三、合成氨工业流程
1、干燥、净化:除去原料气中的杂质,防止催化剂“中毒”而降低或丧失催化活性。
2、压缩机加压:增大压强
3、热交换:合成氨为放热反应,反应体系温度逐渐升高,为原料气反应提供热量,故热交换
可充分利用能源,提高经济效益。
三、合成氨工业流程
4、冷却:NH3的液化需较低温度,迅速冷却使气态氨变成液氨后及时从平衡混合物中分离,
促使平衡向生成NH3的方向移动。
5、循环使用原料气:因合成氨为可逆反应,平衡混合物中含有原料气,将NH3分离后的原料
气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,
提高经济效益。
1、影响化学反应进行的因素
(1)内因:参加反应的物质的组成、结构和性质等本身因素;
(2)外因:温度、压强、浓度、催化剂等反应条件。
四、化学反应条件的控制
2、化学反应的调控
(1)含义:通过改变反应条件使一个可能发生的反应按照某一方向进行。
(2)考虑实际因素
a、结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找合适的生产条件。
b、根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
设备可行
成本核算
如何为一个化学反应选择适宜的生产条件?
影响因素
调控反应
化学平衡
反应速率
最佳效果
化学反应的调控
(1)温度越高越利于合成氨反应平衡正向移动。 ( )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。 ( )
(3)使用催化剂能提高合成氨反应物的平衡转化率。 ( )
(4)充入的N2越多越有利于NH3的合成。 ( )
(5)恒容条件下充入稀有气体有利于NH3的合成。 ( )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。( )
练习1、判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
×
×
练习3、有关合成氨工业的说法中,正确的是( )
A、增大H2的浓度,可提高H2的转化率
B、由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高
C、合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动
D、合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
B
练习4、有平衡体系:CO(g)+2H2(g) CH3OH(g) ΔH<0。为了增加甲醇(CH3OH)的产量,应采取的正确措施是( )
A、高温,高压 B、适宜温度,高压,催化剂
C、低温,低压 D、高温,高压,催化剂
B
练习5、工业上合成氨一般采用400~500 ℃的温度,其原因是 ( )
①适当提高氨的合成速率 ②提高H2的转化率 ③提高氨的产率 ④催化剂在500 ℃左右活性最大
A、只有① B、只有①② C、②③④ D、只有①④
D
练习6、在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A、加催化剂,v(正)、v(逆)都发生变化且变化的倍数相等
B、加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C、降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数
D、等容条件下加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
D
练习7、某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A、工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B、若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率
C、工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D、工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
D
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
压强
温度
转化率
练习8、 在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1。(已知催化剂是V2O5,在400~500 ℃时催化效果最好)下表为不同温度和压强下SO2的转化率(%):
1、根据化学理论分析,为了使二氧化硫尽可能转化为三氧化硫,应选择的条件是什么
2、在实际生产中,选定400~500 ℃作为操作温度,其原因是什么
提示:低温、高压。
提示:兼顾速率和平衡,且在此温度下催化剂的活性最高。
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
压强
温度
转化率
3、根据上表中的数据分析,制取SO3时为什么不采用高压
4、在生产中,通入过量空气的目的是什么
5、尾气中的SO2必须回收的目的是什么
提示:在常压下SO2的转化率就已经很高了(97.5%),若采用高压,平衡能向右移动,但效果并不明显,且采用高压时会增大设备的成本,得不偿失。
提示:增大反应物O2的浓度,提高SO2的转化率。
提示:防止污染环境;循环利用,提高原料的利用率。
再 见
谢谢
