第12章盐巩固练习 九年级化学京改版(2013)下册(有答案)
文档属性
| 名称 | 第12章盐巩固练习 九年级化学京改版(2013)下册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 142.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-12 23:30:07 | ||
图片预览


文档简介
第12章盐巩固
一、单选题
1.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
2.某农用物资商店里的化肥有Ca3(PO4)2、K2SO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥 B.磷肥
C.钾肥 D.复合肥
3.下列各组物质的溶液中,不另加试剂则无法鉴别出来的是
A.H2SO4 NaOH CuSO4
B.HCl NaOH NaCl
C.H2SO4 Ca(OH)2 FeCl3
D.HCl Ca(OH)2 Na2CO3
4.将珍珠加入稀盐酸中,有气泡产生,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.硫酸根离子 C.碳酸根离子 D.氢氧根离子
5.粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A.量取10mL水 B.溶解粗盐
C.过滤悬浊液 D.蒸发滤液
6.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
7.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.HNO3和FeCl3 B.NaOH和HCl
C.BaCl2和Na2SO4 D.KOH和CuSO4
8.下列做法不能达到目的是( )
A.用洗涤剂去除油污 B.用白酒去除水垢
C.用小苏打发酵面粉 D.用煮沸的方法软化硬水
9.下列各组溶液混合后能发生反应且无明显现象的一组是
A.NaNO3、NaCl、AgNO3 B.CuSO4、H2SO4、BaCl2
C.HCl、Na2SO4、NaOH D.HCl、NaHCO3、NaNO3
10.下列实验目的与所用试剂相符的是
A.证明NaOH溶液中含有Na2CO3――酚酞试剂
B.证明NaOH溶液中含有Na2CO3――澄清石灰水
C.除去NaOH溶液中的Na2CO3杂质――稀盐酸
D.除去NaOH溶液中的Na2CO3杂质――CaCl2溶液
11.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
二、简答题
12.向AgNO3溶液中滴入NaCl溶液至恰好完全反应,如图表示反应前后溶液中存在的主要离子。
(1)实验过程中观察到的现象是 _____ 。
(2)写出“”表示的粒子的符号: _____ 。
(3)写出该反应的化学方程式: _____ 。
13.碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
(1)如何除去一瓶氢氧化钠溶液中混有的碳酸钠?用化学方程式表示除去杂质的原理_____。
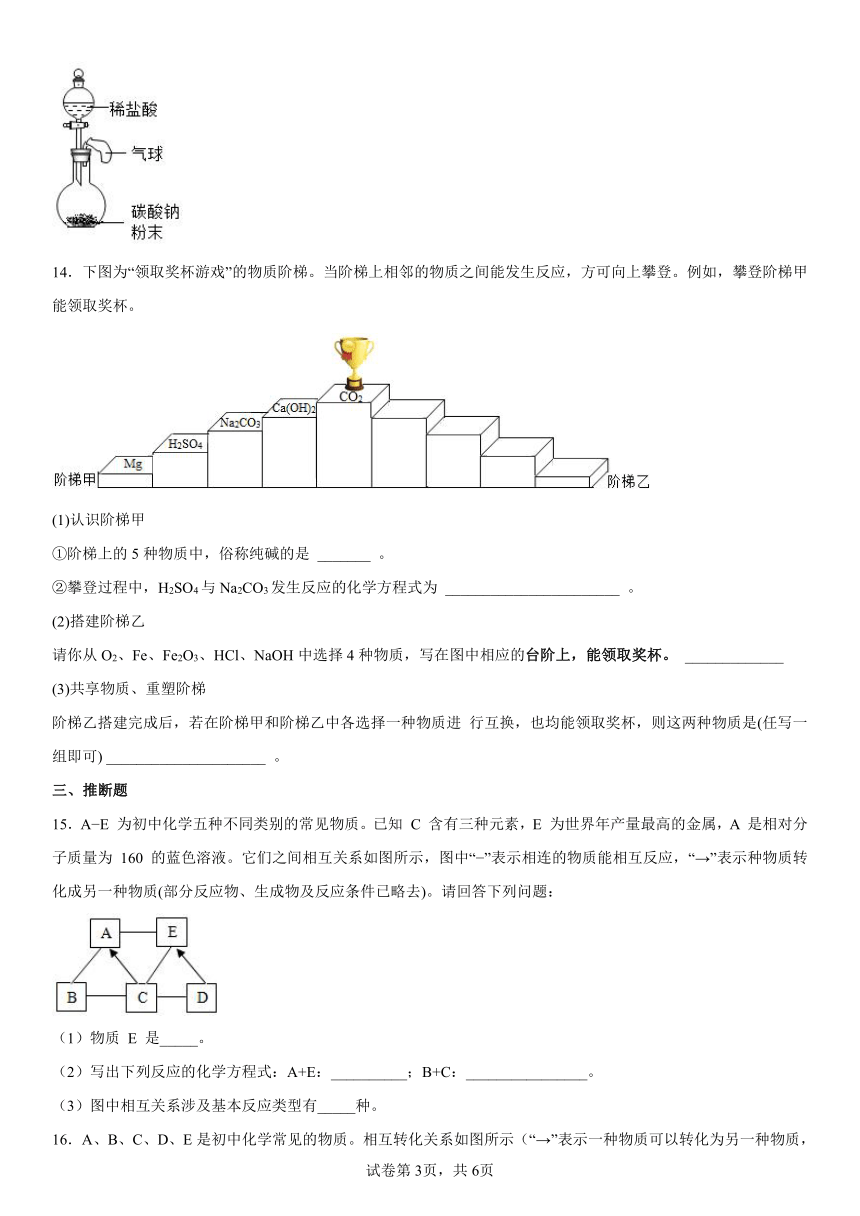
(2)某趣味实验装置图,其气密性良好。打开分液漏斗的活塞后,可观察到气球胀大的现象。请用化学方程式解释产生此现象的原因_____。
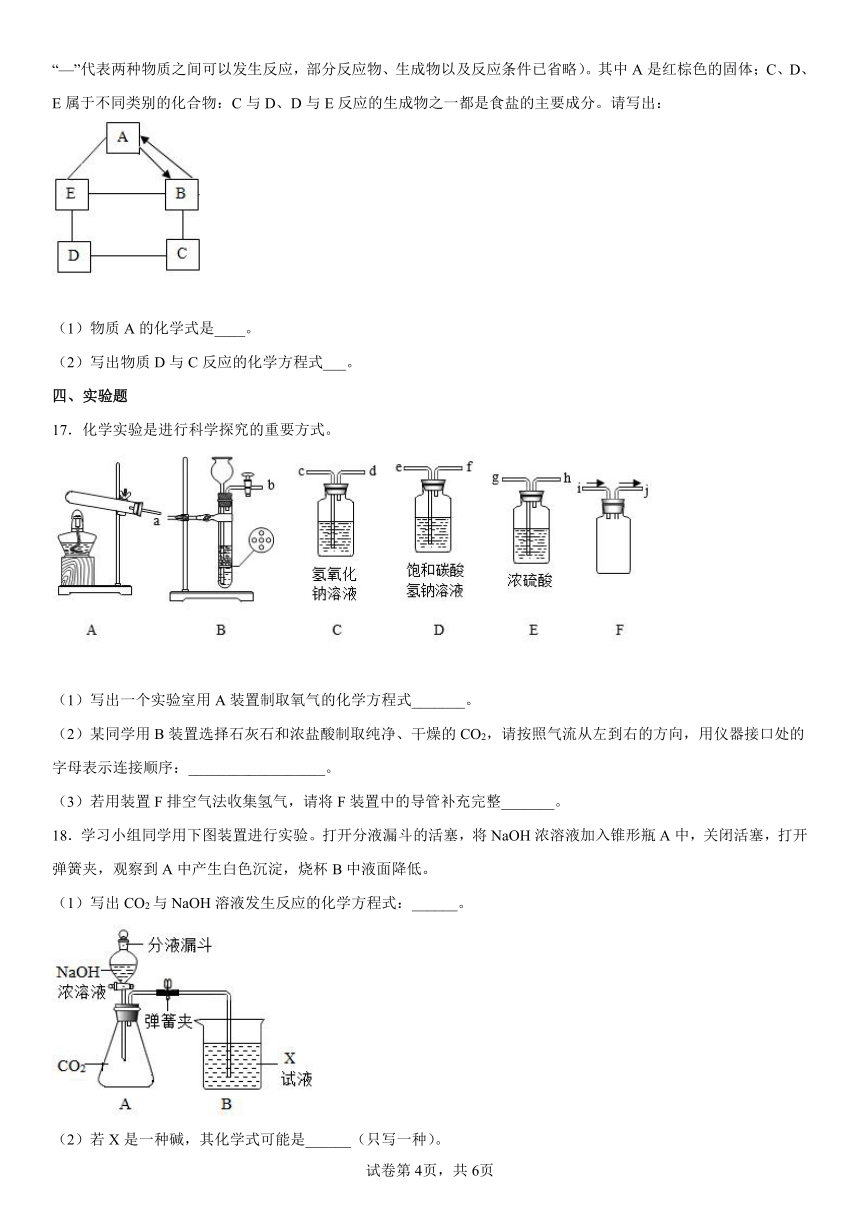
14.下图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(1)认识阶梯甲
①阶梯上的5种物质中,俗称纯碱的是 _______ 。
②攀登过程中,H2SO4与Na2CO3发生反应的化学方程式为 _______________________ 。
(2)搭建阶梯乙
请你从O2、Fe、Fe2O3、HCl、NaOH中选择4种物质,写在图中相应的台阶上,能领取奖杯。 _____________
(3)共享物质、重塑阶梯
阶梯乙搭建完成后,若在阶梯甲和阶梯乙中各选择一种物质进 行互换,也均能领取奖杯,则这两种物质是(任写一组即可) _____________________ 。
三、推断题
15.A E 为初中化学五种不同类别的常见物质。已知 C 含有三种元素,E 为世界年产量最高的金属,A 是相对分子质量为 160 的蓝色溶液。它们之间相互关系如图所示,图中“ ”表示相连的物质能相互反应,“→”表示种物质转化成另一种物质(部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)物质 E 是_____。
(2)写出下列反应的化学方程式:A+E:__________;B+C:________________。
(3)图中相互关系涉及基本反应类型有_____种。
16.A、B、C、D、E是初中化学常见的物质。相互转化关系如图所示(“→”表示一种物质可以转化为另一种物质,“—”代表两种物质之间可以发生反应,部分反应物、生成物以及反应条件已省略)。其中A是红棕色的固体;C、D、E属于不同类别的化合物:C与D、D与E反应的生成物之一都是食盐的主要成分。请写出:
(1)物质A的化学式是____。
(2)写出物质D与C反应的化学方程式___。
四、实验题
17.化学实验是进行科学探究的重要方式。
(1)写出一个实验室用A装置制取氧气的化学方程式_______。
(2)某同学用B装置选择石灰石和浓盐酸制取纯净、干燥的CO2,请按照气流从左到右的方向,用仪器接口处的字母表示连接顺序:__________________。
(3)若用装置F排空气法收集氢气,请将F装置中的导管补充完整_______。
18.学习小组同学用下图装置进行实验。打开分液漏斗的活塞,将NaOH浓溶液加入锥形瓶A中,关闭活塞,打开弹簧夹,观察到A中产生白色沉淀,烧杯B中液面降低。
(1)写出CO2与NaOH溶液发生反应的化学方程式:______。
(2)若X是一种碱,其化学式可能是______(只写一种)。
(3)学习小组同学用的X是CaCl2,实验结束后,同学们又分别做了以下三组实验:
①取少量A中溶液测其pH,pH>7
②取少量A中溶液,向其中加入CaCl2溶液,无明显现象,再测其pH,pH>7
③取少量A中溶液,测其pH,pH>7,再向其中加入K2CO3溶液,产生白色沉淀查阅资料可知CaCl2溶液呈中性。
以上三组实验事实中,能说明A中溶液一定含有NaOH的是______(填序号)。
五、计算题
19.如图是某化肥厂生产的碳酸氢铵的包装袋上的部分说明。
(1)避免高温天气施用的原因是___________(用化学方程式表示)。
(2)一袋该化肥中至少含有纯净的NH4HCO3的质量为______Kg(直接写出计算结果)。
20.某兴趣小组测定纯碱样品中碳酸钠的质量分数(假设该样品中杂质不与水反应也不与酸反应),取样品13g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,
求:
(1)生成二氧化碳的质量为______g;
(2)样品中碳酸钠的质量分数________;
(3)计算恰好完全反应时,所得溶液中溶质的质量分数_________。
21.化学兴趣小组为测定某小苏打样品(含NaCl杂质)中碳酸氢钠的含量,进行以下实验:称取10.0g样品,放入锥形瓶中,加水溶解。向该溶液中分两次加入稀盐酸,发生反应,锥形瓶及溶液质量的变化如图所示(忽略CO2在水中的溶解)。请计算:
(1)NaCl的化学式量为______。
(2)当第一次加入40.0g盐酸时,产生二氧化碳的质量是______g。
(3)样品中 NaHCO3的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.C
5.B
6.B
7.B
8.B
9.C
10.B
11.B
12. 产生白色沉淀 Na+ NaCl+AgNO3═NaNO3+AgCl↓
13.
14. Na2CO3 Na2CO3 + H2SO4 = Na2SO4+H2O +CO2↑ 从高到低: NaOH HCl Fe O2 H2SO4和HCl(或 Fe 和Mg)
15. Fe 两
16. Fe2O3
17. 2KClO32KCl + 3O2 ↑ befgh
18. Ca(OH)2或Ba(OH)2 ②③
19.(1)
(2)39.5
20.(1)4.4
(2)设样品中碳酸钠的质量为x,则有
故样品中碳酸钠的质量分数为:
(3)设恰好完全反应时,所得溶液中溶质的质量为y,则有
故恰好完全反应时,所得溶液中溶质的质量分数为:
21.(1)58.5
(2)4.4g
(3)解:设碳酸氢钠质量分数为x。
x=84%
答:样品中 NaHCO3的质量分数84%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
2.某农用物资商店里的化肥有Ca3(PO4)2、K2SO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥 B.磷肥
C.钾肥 D.复合肥
3.下列各组物质的溶液中,不另加试剂则无法鉴别出来的是
A.H2SO4 NaOH CuSO4
B.HCl NaOH NaCl
C.H2SO4 Ca(OH)2 FeCl3
D.HCl Ca(OH)2 Na2CO3
4.将珍珠加入稀盐酸中,有气泡产生,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.硫酸根离子 C.碳酸根离子 D.氢氧根离子
5.粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A.量取10mL水 B.溶解粗盐
C.过滤悬浊液 D.蒸发滤液
6.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
7.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.HNO3和FeCl3 B.NaOH和HCl
C.BaCl2和Na2SO4 D.KOH和CuSO4
8.下列做法不能达到目的是( )
A.用洗涤剂去除油污 B.用白酒去除水垢
C.用小苏打发酵面粉 D.用煮沸的方法软化硬水
9.下列各组溶液混合后能发生反应且无明显现象的一组是
A.NaNO3、NaCl、AgNO3 B.CuSO4、H2SO4、BaCl2
C.HCl、Na2SO4、NaOH D.HCl、NaHCO3、NaNO3
10.下列实验目的与所用试剂相符的是
A.证明NaOH溶液中含有Na2CO3――酚酞试剂
B.证明NaOH溶液中含有Na2CO3――澄清石灰水
C.除去NaOH溶液中的Na2CO3杂质――稀盐酸
D.除去NaOH溶液中的Na2CO3杂质――CaCl2溶液
11.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
二、简答题
12.向AgNO3溶液中滴入NaCl溶液至恰好完全反应,如图表示反应前后溶液中存在的主要离子。
(1)实验过程中观察到的现象是 _____ 。
(2)写出“”表示的粒子的符号: _____ 。
(3)写出该反应的化学方程式: _____ 。
13.碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
(1)如何除去一瓶氢氧化钠溶液中混有的碳酸钠?用化学方程式表示除去杂质的原理_____。
(2)某趣味实验装置图,其气密性良好。打开分液漏斗的活塞后,可观察到气球胀大的现象。请用化学方程式解释产生此现象的原因_____。
14.下图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(1)认识阶梯甲
①阶梯上的5种物质中,俗称纯碱的是 _______ 。
②攀登过程中,H2SO4与Na2CO3发生反应的化学方程式为 _______________________ 。
(2)搭建阶梯乙
请你从O2、Fe、Fe2O3、HCl、NaOH中选择4种物质,写在图中相应的台阶上,能领取奖杯。 _____________
(3)共享物质、重塑阶梯
阶梯乙搭建完成后,若在阶梯甲和阶梯乙中各选择一种物质进 行互换,也均能领取奖杯,则这两种物质是(任写一组即可) _____________________ 。
三、推断题
15.A E 为初中化学五种不同类别的常见物质。已知 C 含有三种元素,E 为世界年产量最高的金属,A 是相对分子质量为 160 的蓝色溶液。它们之间相互关系如图所示,图中“ ”表示相连的物质能相互反应,“→”表示种物质转化成另一种物质(部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)物质 E 是_____。
(2)写出下列反应的化学方程式:A+E:__________;B+C:________________。
(3)图中相互关系涉及基本反应类型有_____种。
16.A、B、C、D、E是初中化学常见的物质。相互转化关系如图所示(“→”表示一种物质可以转化为另一种物质,“—”代表两种物质之间可以发生反应,部分反应物、生成物以及反应条件已省略)。其中A是红棕色的固体;C、D、E属于不同类别的化合物:C与D、D与E反应的生成物之一都是食盐的主要成分。请写出:
(1)物质A的化学式是____。
(2)写出物质D与C反应的化学方程式___。
四、实验题
17.化学实验是进行科学探究的重要方式。
(1)写出一个实验室用A装置制取氧气的化学方程式_______。
(2)某同学用B装置选择石灰石和浓盐酸制取纯净、干燥的CO2,请按照气流从左到右的方向,用仪器接口处的字母表示连接顺序:__________________。
(3)若用装置F排空气法收集氢气,请将F装置中的导管补充完整_______。
18.学习小组同学用下图装置进行实验。打开分液漏斗的活塞,将NaOH浓溶液加入锥形瓶A中,关闭活塞,打开弹簧夹,观察到A中产生白色沉淀,烧杯B中液面降低。
(1)写出CO2与NaOH溶液发生反应的化学方程式:______。
(2)若X是一种碱,其化学式可能是______(只写一种)。
(3)学习小组同学用的X是CaCl2,实验结束后,同学们又分别做了以下三组实验:
①取少量A中溶液测其pH,pH>7
②取少量A中溶液,向其中加入CaCl2溶液,无明显现象,再测其pH,pH>7
③取少量A中溶液,测其pH,pH>7,再向其中加入K2CO3溶液,产生白色沉淀查阅资料可知CaCl2溶液呈中性。
以上三组实验事实中,能说明A中溶液一定含有NaOH的是______(填序号)。
五、计算题
19.如图是某化肥厂生产的碳酸氢铵的包装袋上的部分说明。
(1)避免高温天气施用的原因是___________(用化学方程式表示)。
(2)一袋该化肥中至少含有纯净的NH4HCO3的质量为______Kg(直接写出计算结果)。
20.某兴趣小组测定纯碱样品中碳酸钠的质量分数(假设该样品中杂质不与水反应也不与酸反应),取样品13g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,
求:
(1)生成二氧化碳的质量为______g;
(2)样品中碳酸钠的质量分数________;
(3)计算恰好完全反应时,所得溶液中溶质的质量分数_________。
21.化学兴趣小组为测定某小苏打样品(含NaCl杂质)中碳酸氢钠的含量,进行以下实验:称取10.0g样品,放入锥形瓶中,加水溶解。向该溶液中分两次加入稀盐酸,发生反应,锥形瓶及溶液质量的变化如图所示(忽略CO2在水中的溶解)。请计算:
(1)NaCl的化学式量为______。
(2)当第一次加入40.0g盐酸时,产生二氧化碳的质量是______g。
(3)样品中 NaHCO3的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.C
5.B
6.B
7.B
8.B
9.C
10.B
11.B
12. 产生白色沉淀 Na+ NaCl+AgNO3═NaNO3+AgCl↓
13.
14. Na2CO3 Na2CO3 + H2SO4 = Na2SO4+H2O +CO2↑ 从高到低: NaOH HCl Fe O2 H2SO4和HCl(或 Fe 和Mg)
15. Fe 两
16. Fe2O3
17. 2KClO32KCl + 3O2 ↑ befgh
18. Ca(OH)2或Ba(OH)2 ②③
19.(1)
(2)39.5
20.(1)4.4
(2)设样品中碳酸钠的质量为x,则有
故样品中碳酸钠的质量分数为:
(3)设恰好完全反应时,所得溶液中溶质的质量为y,则有
故恰好完全反应时,所得溶液中溶质的质量分数为:
21.(1)58.5
(2)4.4g
(3)解:设碳酸氢钠质量分数为x。
x=84%
答:样品中 NaHCO3的质量分数84%。
答案第1页,共2页
答案第1页,共2页
