高中化学人教版(2019)必修第一册2.2.1 氯气的性质(共20张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册2.2.1 氯气的性质(共20张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-13 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
2.2 氯及其化合物
2.2.1 氯气的性质
氯元素在自然界中的存在:
化合态
海洋占地球表面71%
湖盐
氯气的应用:
资料来源——百度百科
①消毒,自来水常用氯气消毒,1L 水里约通入0.002g氯气
②制盐酸
③工业用于制漂白粉或漂粉精
④制多种农药
一、氯气的物理性质:
黄绿色、刺激性气味的气体,密度大于空气,在水中溶解度是1:2,有毒,易液化。
收集方法:
向上排空气、
排饱和食盐水法。
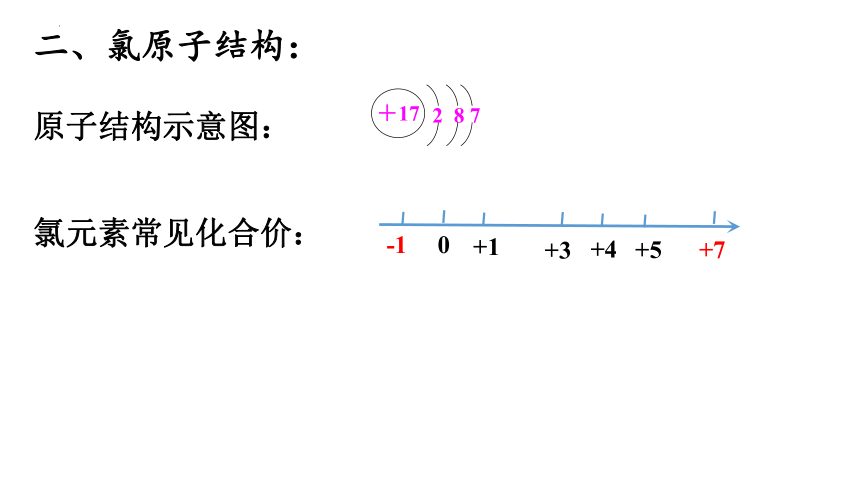
二、氯原子结构:
原子结构示意图:
氯元素常见化合价:
-1
0
+7
+3
+4
+1
+5
+17
2 8 7
三、氯气化学性质:
1、与金属、非金属单质反应
2Na+Cl2 2NaCl
加热
现象:剧烈燃烧,黄色火焰,大量白烟。
现象:剧烈燃烧,棕褐色烟。
2Fe+3Cl2 2FeCl3
加热
Cu+Cl2 CuCl2
加热
现象:剧烈燃烧,棕黄色烟。
具有氧化性(为主)和还原性
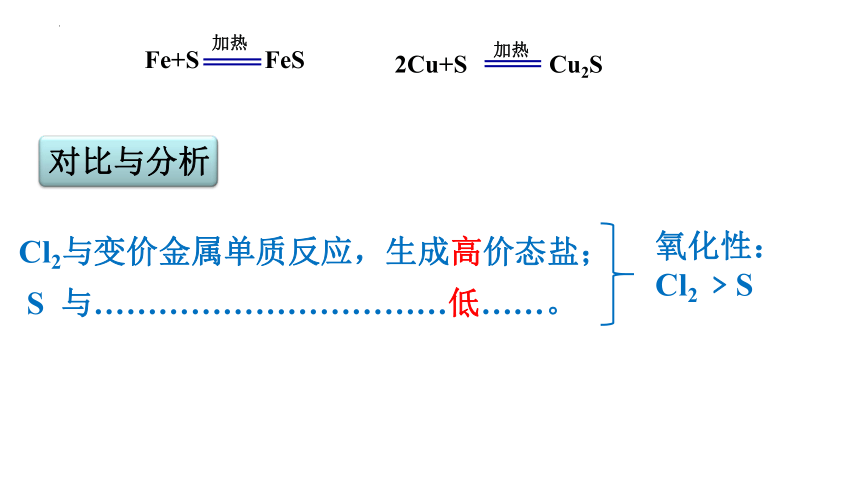
对比与分析
Fe+S FeS
加热
2Cu+S Cu2S
加热
Cl2与变价金属单质反应,生成高价态盐;
S 与……………………………低……。
氧化性:
Cl2 ﹥S
思考与交流
对燃烧的新认识:
燃烧的本质是氧化还原反应,不一定要有氧气参加,
所有发光发热的剧烈的化学反应都可称为燃烧。
9
三、氯气化学性质:
2、与水的反应
实验操作 实验现象 氯水中微粒
观察新制氯水颜色
滴入Na2CO3溶液
滴入AgNO3溶液
盛有氯水的试管中 有色布条
将紫色石蕊溶液 滴入新制氯水
Cl2
实验探究
为探究氯气与水是否反应,若反应,产物是什么,设计下列实验:
H+
Cl—
HClO
H+、HClO
呈黄绿色
生成气体
生成白色沉淀
有色布条褪色
先变红,后褪色
11
三、氯气化学性质:
2、与水的反应
次氯酸
氧化剂
还原剂
e-
Cl2+H2O HCl+HClO
Cl2+H2O H+ + Cl— + HClO
离子反应方程式为:
HClO 次氯酸
①强氧化性,漂白剂、消毒剂
不能用酸碱指示剂、pH试纸检验新制氯水的酸性。
②弱酸性,弱于H2CO3
部分电离:HClO H+ + ClO—
部分电离:H2O H+ + OH—
全部电离:HCl = H+ + Cl—
思考与交流
新制氯水中的微粒有哪些?
三种分子:Cl2、HClO、H2O
四种离子:Cl—、H+、ClO—、OH—
“三分四离”
③不稳定性,见光易分解
2HClO 2HCl + O2↑
1、保存新制氯水时要注意什么?
思考与交流
密封保存在棕色试剂瓶,放在冷暗处
2、久置氯水的成分是什么?
稀盐酸
3、俗话:“养鱼先养水”是什么意思?
自来水在日光照射下十小时,在放入鱼。
对比与区分
液氯、新制氯水、久置氯水
液氯 新制氯水 久置氯水
物质类别
颜色
微粒 成分 分子
离子
性质
纯净物
黄绿色
Cl2
无
氧化性(主)、还原性、
毒性
混合物
黄绿色
Cl2、HClO、H2O
Cl—、H+、ClO—、OH—
氧化性、酸性、漂白性、消毒、不稳定性
混合物
无色
H2O
Cl—、H+、OH—
酸性
检验一瓶氯水是否已经完全变质,可选用哪种试剂?
A. 酚酞溶液
B. AgNO3溶液
C. Na2CO3溶液
D. 紫色石蕊溶液
三、氯气化学性质:
3、与碱的反应
(1) 与NaOH溶液的反应
漂白原理:NaClO+CO2+H2O = HClO + NaHCO3
离子方程式:
Cl2 +2OH—= ClO— +Cl— + H2O
84消毒液与洁厕灵(稀盐酸)混合后:
NaClO +2 HCl = NaCl + Cl2↑ +H2O
离子方程式:
ClO— +Cl— +2H+ = Cl2↑ + H2O
不能混合适用!
三、氯气化学性质:
3、与碱的反应
(2) 与Ca(OH)2的反应
漂白原理:
Ca(ClO)2+CO2+H2O = 2HClO + CaCO3↓
2.2 氯及其化合物
2.2.1 氯气的性质
氯元素在自然界中的存在:
化合态
海洋占地球表面71%
湖盐
氯气的应用:
资料来源——百度百科
①消毒,自来水常用氯气消毒,1L 水里约通入0.002g氯气
②制盐酸
③工业用于制漂白粉或漂粉精
④制多种农药
一、氯气的物理性质:
黄绿色、刺激性气味的气体,密度大于空气,在水中溶解度是1:2,有毒,易液化。
收集方法:
向上排空气、
排饱和食盐水法。
二、氯原子结构:
原子结构示意图:
氯元素常见化合价:
-1
0
+7
+3
+4
+1
+5
+17
2 8 7
三、氯气化学性质:
1、与金属、非金属单质反应
2Na+Cl2 2NaCl
加热
现象:剧烈燃烧,黄色火焰,大量白烟。
现象:剧烈燃烧,棕褐色烟。
2Fe+3Cl2 2FeCl3
加热
Cu+Cl2 CuCl2
加热
现象:剧烈燃烧,棕黄色烟。
具有氧化性(为主)和还原性
对比与分析
Fe+S FeS
加热
2Cu+S Cu2S
加热
Cl2与变价金属单质反应,生成高价态盐;
S 与……………………………低……。
氧化性:
Cl2 ﹥S
思考与交流
对燃烧的新认识:
燃烧的本质是氧化还原反应,不一定要有氧气参加,
所有发光发热的剧烈的化学反应都可称为燃烧。
9
三、氯气化学性质:
2、与水的反应
实验操作 实验现象 氯水中微粒
观察新制氯水颜色
滴入Na2CO3溶液
滴入AgNO3溶液
盛有氯水的试管中 有色布条
将紫色石蕊溶液 滴入新制氯水
Cl2
实验探究
为探究氯气与水是否反应,若反应,产物是什么,设计下列实验:
H+
Cl—
HClO
H+、HClO
呈黄绿色
生成气体
生成白色沉淀
有色布条褪色
先变红,后褪色
11
三、氯气化学性质:
2、与水的反应
次氯酸
氧化剂
还原剂
e-
Cl2+H2O HCl+HClO
Cl2+H2O H+ + Cl— + HClO
离子反应方程式为:
HClO 次氯酸
①强氧化性,漂白剂、消毒剂
不能用酸碱指示剂、pH试纸检验新制氯水的酸性。
②弱酸性,弱于H2CO3
部分电离:HClO H+ + ClO—
部分电离:H2O H+ + OH—
全部电离:HCl = H+ + Cl—
思考与交流
新制氯水中的微粒有哪些?
三种分子:Cl2、HClO、H2O
四种离子:Cl—、H+、ClO—、OH—
“三分四离”
③不稳定性,见光易分解
2HClO 2HCl + O2↑
1、保存新制氯水时要注意什么?
思考与交流
密封保存在棕色试剂瓶,放在冷暗处
2、久置氯水的成分是什么?
稀盐酸
3、俗话:“养鱼先养水”是什么意思?
自来水在日光照射下十小时,在放入鱼。
对比与区分
液氯、新制氯水、久置氯水
液氯 新制氯水 久置氯水
物质类别
颜色
微粒 成分 分子
离子
性质
纯净物
黄绿色
Cl2
无
氧化性(主)、还原性、
毒性
混合物
黄绿色
Cl2、HClO、H2O
Cl—、H+、ClO—、OH—
氧化性、酸性、漂白性、消毒、不稳定性
混合物
无色
H2O
Cl—、H+、OH—
酸性
检验一瓶氯水是否已经完全变质,可选用哪种试剂?
A. 酚酞溶液
B. AgNO3溶液
C. Na2CO3溶液
D. 紫色石蕊溶液
三、氯气化学性质:
3、与碱的反应
(1) 与NaOH溶液的反应
漂白原理:NaClO+CO2+H2O = HClO + NaHCO3
离子方程式:
Cl2 +2OH—= ClO— +Cl— + H2O
84消毒液与洁厕灵(稀盐酸)混合后:
NaClO +2 HCl = NaCl + Cl2↑ +H2O
离子方程式:
ClO— +Cl— +2H+ = Cl2↑ + H2O
不能混合适用!
三、氯气化学性质:
3、与碱的反应
(2) 与Ca(OH)2的反应
漂白原理:
Ca(ClO)2+CO2+H2O = 2HClO + CaCO3↓
