云南省开远四中2013-2014学年高二上学期期中考试 化学试题 Word版含答案
文档属性
| 名称 | 云南省开远四中2013-2014学年高二上学期期中考试 化学试题 Word版含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-05 10:29:49 | ||
图片预览



文档简介
说明:
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)及答卷卡三部分,第Ⅰ卷1至3页,第Ⅱ卷3至6页,答卷卡7至8页,共100分。考试时间90分钟。
第Ⅰ卷(选择题 共48分)
注意事项:
1.答第Ⅰ卷前考生务必在答卷卡填上自己的班级、姓名。
2.每小题选出答案后,将答案选项填入答卷卡选择题答案栏上,答在其它位置无效。
3.考试结束,监考人员只须将答卷卡收回。
可能用到的原子量: H-1 C-12 N-14 O-16 F-19 S-32 Cl-35.5 Fe-56
Cu-64 Zn-65 Br-80 K-39 Ba-137 Na-23 Mg-24 Al-27 Ca-40
选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
1.对一些具有危险的化学物质,若要在其包装上贴危险化学品标记,下列标签贴错的是
浓硫酸 汽油 KClO3 乙醇
A B C D
A B C D
2.用固体配制100毫升一定物质的量浓度的溶液时,必须用到的仪器是
A.分液漏斗 B. 圆底烧瓶 C. 容量瓶 D. 集气瓶
3.下列化学用语的表达,正确的是
A.氮气的电子式:N??N
B.乙烯的结构简式:CH2CH2
C.二氧化碳分子的结构式:O—C—O
D.CH4分子的球棍模型:
4.下列物质中,只含有共价键的化合物是
A.Na B. N2 C.HCl D.KCl
5.下列各组物质中,互为同位素的是
A.O2和O3 B.CO和CO2 C.H2O和H2O2 D.126C和 136C
6.某溶液中存在大量的H+、Cl-、SO42-,该溶液中还可能大量存在的离子是
A.HCO3- B.Ba2+ C.Al3+ D.Ag+
7.标准状况下,下列气体体积最小的是
A.1克氢气 B.1摩尔氮气 C.6.02×1022个氧气分子 D.8.96升氯气
8. 下列不存在丁达尔效应的分散系是
A.有尘埃的空气 B.食盐水
C.稀豆浆 D.向沸水中滴入FeCl3饱和溶液所得液体
9.下列关于金属的叙述正确的是
A.金属元素在自然界中都是以化合态存在
B.通常情况下,金属具有导电性、导热性、和延展性
C.金属活动性顺序表中排在氢前的金属都能与酸反应,但都不能与碱反应
D.常温下所有的金属单质都是固态的
10.下列叙述不正确的是
A.铝是地壳中含量最多的金属元素
B.铝在空气中能稳定存在,是因为表面覆盖着保护膜
C.实验室制备Al(OH)3,常用铝盐溶液与NaOH溶液反应
D.Al(OH)3是一种医用胃酸中和剂
11.下列关于浓硫酸与浓硝酸的叙述中不正确的是
A.都是常用的干燥剂
B.一定条件下都能与铜等金属反应
C.常温下都可以储存于铝制槽罐中
D.敞口露置于空气中,一段时间后,容器内的溶质的物质的量浓度都降低
12.下列单质在一定条件下与氯气反应,所得产物与事实不相符合的是
A.Cu→ CuCl2 B.Na → NaCl C.Fe→ FeCl2 D.Al→ AlCl3
13.下列物质中,能够导电的电解质是
A.稀硫酸溶液 B.固体KCl C.铜导线 D.熔融的 NaCl
14.下列关于气体制备不正确的是
A.铜与稀硫酸反应制取氢气
B.碳酸钙与稀盐酸反应制取二氧化碳
C.过氧化钠与水反应制取氧气
D.氯化铵固体与氢氧化钙固体混合加热制取氨气
15.下列离子方程式书写正确的是
A.氢氧化钠溶液加到稀硫酸中:OH- +H+===H2O
B.金属钠投入到水中:Na+H2O===Na+ +OH-+H2↑
C.石灰石投入到稀盐酸中:CO32- + 2H+ ===CO2↑ + H2O
D.Fe粉加入稀盐酸中:2Fe+6H+==Fe3+ +3H2↑
16. 下列各组物质的性质比较,正确的是
A.酸性:H3PO4 ﹥H2SO4 B.热稳定性:H2S﹥H2O
C.碱性:Mg(OH)2﹥NaOH D.氧化性:Cl2﹥Br2
17. 高铁的快速发展方便了人们的出行。常利用铝热反应焊接钢轨间的缝隙和冶炼金属,反应方程式如下2Al + Fe2O3===2Fe + Al2O3:其中Fe2O3是
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
18.关于如下图所示装置的叙述,正确的是
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
19.下列说法不正确的是
A.催化剂可以改变化学反应速率
B.2 mol SO2与l mol O2混合一定能生成2 mol SO3
C.食物放在冰箱中会减慢食物变质的速率
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等
20.下列说法中错误的是
A.能量变化是化学反应的基本特征之一
B.化学反应都伴随着能量变化和其他各种现象的出现
C.拆开物质中的化学键一定需要吸收能量
D.形成化学键的过程一定释放能量
21.下列说法中,不正确的是
A.人类目前直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
22.一定条件下,不能与乙烯发生反应的是
A.氮气 B.水 C.溴的四氯化碳溶液 D.酸性高锰酸钾溶液
23.下列物质,不能通过单质与氧气直接反应生成的是
A.SO3 B.NO C.Na2O2 D.SiO2
24.24 mL浓度为0.05 m01/L的Na2SO3溶液恰好与20 mL浓度为0.02 mol/L的
K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原
产物中的化合价为
A.+2 B.+3 C.+4 D.+5
非选择题(共32分)
二、填空题(共2道题,共28分)
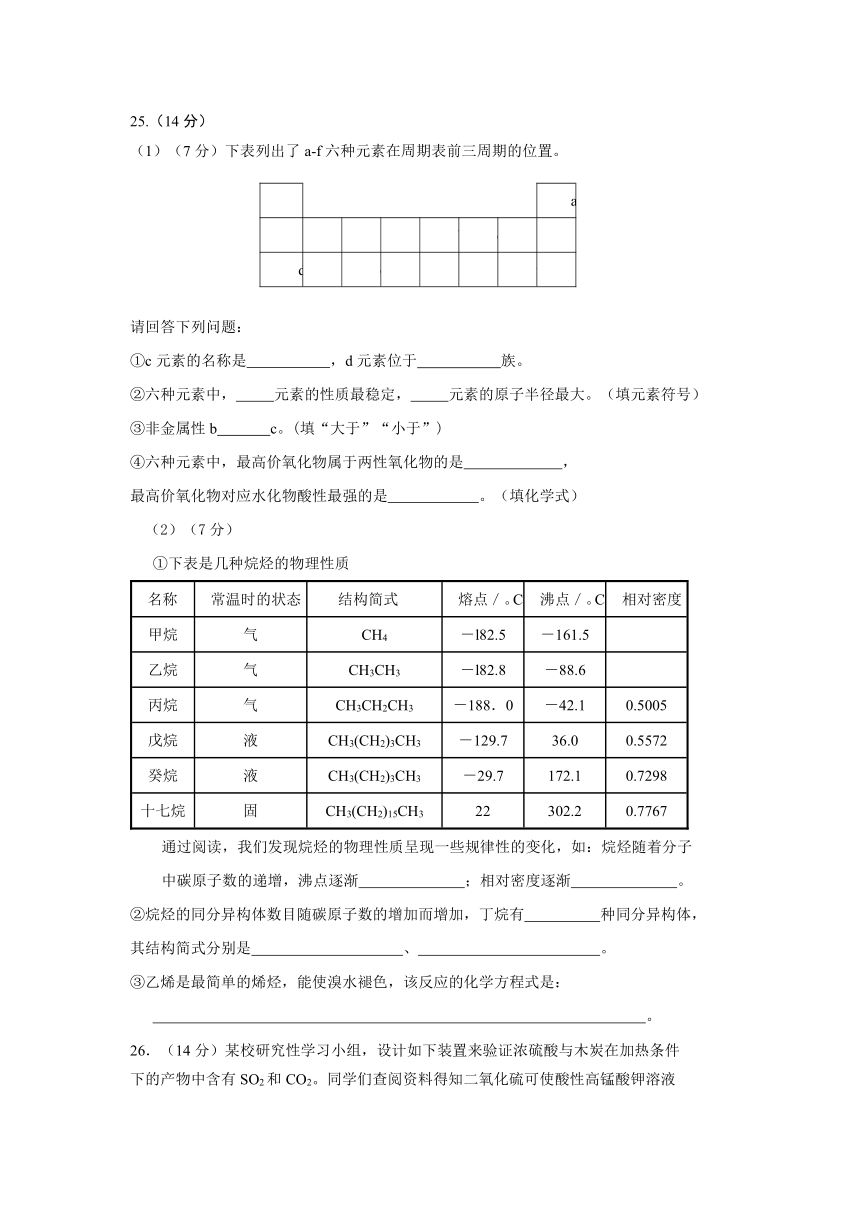
25.(14分)
(1)(7分)下表列出了a-f六种元素在周期表前三周期的位置。
a
b
c
d
e
f
请回答下列问题:
①c元素的名称是 ,d元素位于 族。
②六种元素中, 元素的性质最稳定, 元素的原子半径最大。(填元素符号)
③非金属性b c。(填“大于”“小于”)
④六种元素中,最高价氧化物属于两性氧化物的是 ,
最高价氧化物对应水化物酸性最强的是 。(填化学式)
(2)(7分)
①下表是几种烷烃的物理性质
名称
常温时的状态
结构简式
熔点/。C
沸点/。C
相对密度
甲烷
气
CH4
-l82.5
-161.5
乙烷
气
CH3CH3
-l82.8
-88.6
丙烷
气
CH3CH2CH3
-188.0
-42.1
0.5005
戊烷
液
CH3(CH2)3CH3
-129.7
36.0
0.5572
癸烷
液
CH3(CH2)3CH3
-29.7
172.1
0.7298
十七烷
固
CH3(CH2)15CH3
22
302.2
0.7767
通过阅读,我们发现烷烃的物理性质呈现一些规律性的变化,如:烷烃随着分子
中碳原子数的递增,沸点逐渐 ;相对密度逐渐 。
②烷烃的同分异构体数目随碳原子数的增加而增加,丁烷有 种同分异构体,
其结构简式分别是 、 。
③乙烯是最简单的烯烃,能使溴水褪色,该反应的化学方程式是:
。
26.(14分)某校研究性学习小组,设计如下装置来验证浓硫酸与木炭在加热条件
下的产物中含有SO2和CO2。同学们查阅资料得知二氧化硫可使酸性高锰酸钾溶液
褪色,化学方程式为:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
(1)实验时,反应产生的气体应从 端通入装置。(用“a”或“b”填空)
(2)A瓶的实验现象是 ,A瓶溶液的作用是 ,
B瓶溶液的作用是 。
(3)讨论中某同学认为两次出现品红溶液不必要,你认为 (填“能”或“不能”)去掉C瓶,C瓶溶液的作用是 。
(4)要证明产物中含有CO2的实验现象是:C中品红溶液 ,
D中澄清石灰水 。
三 、计算题(共1道题,共4分)
27.某一定量的锌与稀硫酸反应,收集到4.48L氢气(标准状况)。
(1)计算参加反应的锌的质量是多少?
(2)若所用稀硫酸的浓度为0.4mol/L,则至少需要硫酸溶液的体积为多少升?
选修模块卷
供学习选修1《化学与生活》模块的学生使用(共20分)
四 、选择题(本题包括4小题,每小题2分,共8分。每小题只有1个选项符合题意)
28.创建和谐社会,保护生存环境是每一个公民的责任和义务。下列做法中,有利于环保环境的是
①推广使用可降解塑料 ②城市生活垃圾分类处理
③新农村建设中倡导建造沼气池 ④推广使用一次性木质筷子
A.②③④ B. ①②③ C. ①②④ D. ①③④
29.为了维持生命和健康,人要从食物中提取营养物质,下列物质中不属于营养物质的是
A.葡萄糖 B.乙醇 C.蛋白质 D.芝麻油
30.有人分析一些可溶的有机物的样品,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是
A.油脂 B.维生素C C.葡萄糖 D.氨基酸
31.在试管中加入10%的氢氧化钠溶液1mL,然后滴入2%的硫酸铜溶液2—3滴,稍加振荡,加入某病人的尿液,在酒精灯火焰上加热至沸腾,出现砖红色沉淀。该实验现象证明了该病人尿液中含有的物质是
A.尿酸 B.蛋白质 C.葡萄糖 D.氯化钠
五、填空题(共1题,12分)
32.人体内蛋白质约占体重的16%,人体丢失体内20%以上的蛋白质,生命活动有可能会被迫停止。蛋白质的生理功能与它的化学性质密切相关。人体摄入的蛋白质,在酶的翠花作用下发生水解,最终生成氨基酸。这些氨基酸部分重新合成人体所需的蛋白质、糖或脂类物质,另一部分则发生氧化反应,释放能量;以满足各种生命活动的需要。
(1)蛋白质属于天然________化合物,是由氨基酸通过________键构成;
【注:(2)、(3)、(4)小题用“变性”、“两性”、或“盐析”填写】
(2)天然蛋白质水解得到的都是α—氨基酸,与酸或碱反应都生成盐,所以具有________;
(3)蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀,这个过程称为________;
(4)蛋白质遇到酸、碱、重金属盐,失去原来的活性,这个变化称为________;
(5)食物中的蛋白质来源分为两种:植物性蛋白质和动物性蛋白质。下列食物含有植物性蛋白质的是________(填序号)
A.鱼肉 B.黄豆 C.羊肉 D.大米
开远市第四中学2013-2014学年上学期高二期中考试卷
化学答卷卡
注意事项:
1.答卷前考生务必考号、姓名等项目认真填写在密封线内的指定位置。
2.请将答案填写在答卷卡内,填写在答卷卡密封线内答案无效,考试结束后只交答卷卡,试卷请妥善保存。
第Ⅰ卷(选择题 共48分)
一、选择题答案表
第Ⅱ卷(非选择题 共32分
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
D
C
D
C
D
C
C
B
B
C
A
C
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
D
A
A
B
D
D
B
B
D
A
A
B
二、填空题(28分)
25.(14分)
(1)(7分)
① 氧 IA ② He Na
③ 小于 ④ Al2O3 HClO4
(2)(7分)
① 升高 增大
② 两 CH3CH2CH2CH3 、 CH3CH(CH3)2
③ CH2==CH2+Br2→CH2Br—CH2Br
26.(14分)
(1) a (1分) (2) 红色退去 ;
检验是否有SO2生成 ; 除去SO2
(3) 不能 (1分) 检验SO2是否除尽
(4) 不褪色 ; 变浑浊 或有白色沉淀生成 。
三、计算题(4分)
27(1)13克
(2)0.5L
选修部分
四、选择题 (8分)
28、 B 29、 B 30、 D 31、 C
五、填空题(12)
32、(1) 有机高分子 肽
(2) 两性 (3) 盐析
(4 ) 变性 (5) B
同课章节目录
