化学人教版(2019)必修第一册2.3.3 物质的量浓度(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.3 物质的量浓度(共21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 439.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 08:49:10 | ||
图片预览







文档简介
(共21张PPT)
必修第一册
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第5课时 物质的量浓度
[思考1]在初中我们用什么来表示的溶液浓度,是怎样表示的?
质量分数=
溶液的质量(g)
溶质的质量(g)
×100%
ω=
m(溶液)
m(溶质)
×100%
用溶质的质量分数表示
可变为
但对于溶液我们通常不称其质量,而是量它的体积。同时,在化学反应中,反应物与生成物之间的比例关系是由化学方程式中的化学计量数所决定的。那有什么更好的方法来表示溶液浓度吗?
可以用物质的量浓度来表示
PART
01
PART
02
能从宏观和微观的角度理解物质的量浓度的含义及其微观粒子间的关系。
能够根据物质的量浓度的概念表达式进行简单的计算,逐步提升证据推理思维能力。
核心素养发展目标
单位体积的溶液里所含溶质B的物质的量。
mol/L(mol L-1)
一、物质的量浓度
cB
=
nB
V
1.概念
2.符号
3.单位
4.表示式
CB
nB = cB·V
可变为
也称为溶质B的物质的量浓度
5.含义
每升溶液中溶质的物质的量为多少mol
1、V是溶液的体积,不是溶剂的体积。
2、溶质若为气体,出现气体体积时需要注意温度和压强。
二、有关 注意事项
cB
=
nB
V
3、溶液的体积不等于溶剂的体积,也不是溶质和溶剂体积的简单加和。是溶质和溶剂混合溶解后的实际体积,
ρ(溶液)=
m(溶液)
V(溶液)
用22.4 L/mol须在标况下
还要注意溶液体积的单位换算。
[思考2]:1 mol/LNaCl 溶液的含义是什么?
每升HCl溶液中含有 0.1 mol HCl
每升NaCl溶液中溶质NaCl的
物质的量为1 mol
含义1:
含义2:
每升NaCl溶液中Na+和Cl- 的物质的量均为1mol
[变式]:1 mol/L盐酸溶液的含义是什么?
每升盐酸溶液中H+和Cl- 的物质的量均为0.1mol
例1、判断正误,正确的打“√”,错误的打“×”。并说明理由
(1)将 1mol NaOH 溶于 1 L水中配成溶液,其物质的量浓度为1mol/L( )
(2)将 22.4L 的 NH3 溶于水配制成 1 L 溶液,所得溶液的浓度为1mol/L( )
(3)从100mL2mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度为1mol/L( )
理由:体积指的是溶液的体积,而不是溶剂的体积。
理由:没有指明气体的温度和压强,无法计算NH3的物质的量。
理由:溶液具有均一性,其物质的量浓度不变。
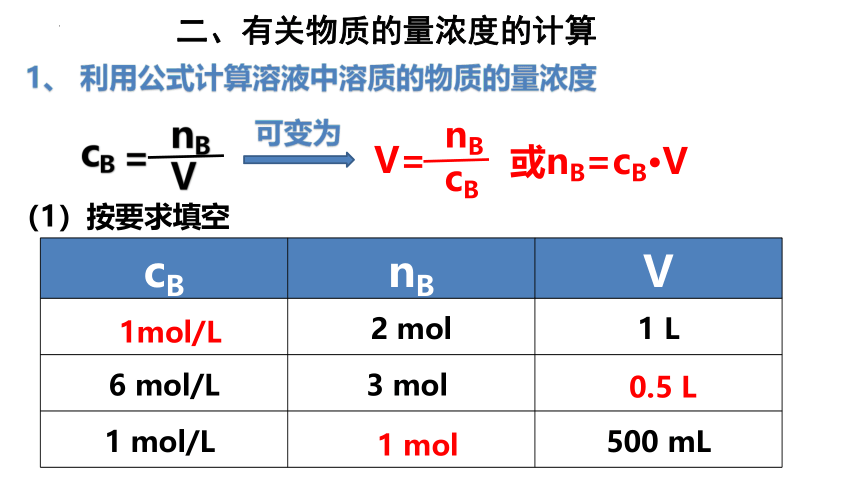
cB nB V
2 mol 1 L
6 mol/L 3 mol
1 mol/L 500 mL
0.5 L
cB
=
nB
V
可变为
V=
nB
cB
或nB=cB V
二、有关物质的量浓度的计算
1、 利用公式计算溶液中溶质的物质的量浓度
(1)按要求填空
1mol/L
1 mol
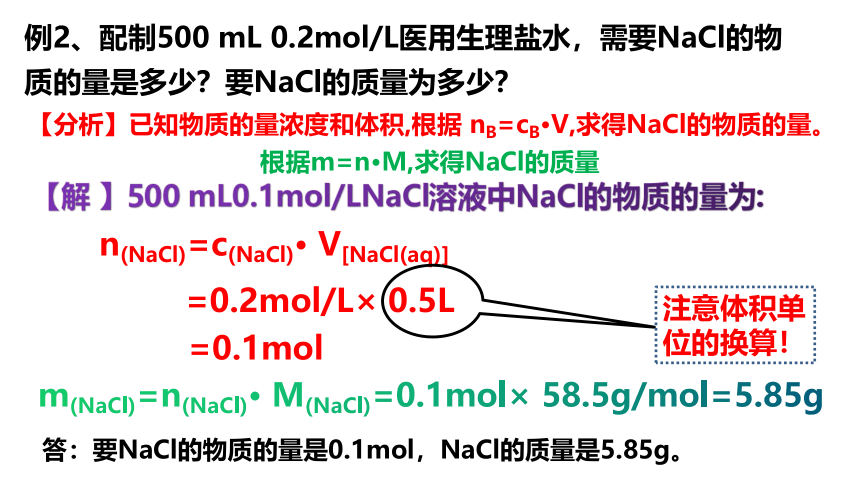
例2、配制500 mL 0.2mol/L医用生理盐水,需要NaCl的物质的量是多少?要NaCl的质量为多少?
【分析】已知物质的量浓度和体积,根据 nB=cB V,求得NaCl的物质的量。
根据m=n M,求得NaCl的质量
【解 】500 mL0.1mol/LNaCl溶液中NaCl的物质的量为:
n(NaCl)=c(NaCl)· V[NaCl(aq)]
=0.2mol/L× 0.5L
=0.1mol
注意体积单位的换算!
m(NaCl)=n(NaCl)· M(NaCl)=0.1mol× 58.5g/mol=5.85g
答:要NaCl的物质的量是0.1mol,NaCl的质量是5.85g。
[变式训练1]:把98克H2SO4配成1L稀H2SO4,则H2SO4物质的量浓度为多少?
解:c(H2SO4)=
n(H2SO4)
V(溶液)
=
M(H2SO4)
m(H2SO4)
V(溶液)
=1mol/L
=
1mol
1L
Na2O+H2O = 2NaOH
[思考3]把2 mol Na2O溶于水配成1L的溶液,所得溶质物质的量浓度是多少?
解:c(Na2O)=
n(Na2O)
V(溶液)
=2mol/L
×
2 mol
4 mol
1
2
解:c(NaOH)=
n(NaOH)
V(溶液)
=4mol/L
如Na、Na2O、Na2O2 NaOH,
SO3 H2SO4等。
如何正确判断溶液的溶质?
(1)物质能与水发生反应
则生成的新的物质为溶质
(2)含结晶水的物质如CuSO4·5H2O溶于水
CuSO4为溶质
比较物质的量浓度与质量分数
物理量 物质的量浓度 溶质的质量分数
定义
表达式
单位
(B) = 100%
cB =
mol·L-1
1
表示单位体积溶液里所含溶质B的物质的量
溶液里溶质质量与溶液质量的比值
cB(溶液)
×V(aq)
÷V(aq)
物质的量(n)为中心构建质量(m)、体积(V)、粒子数(N)、物质的量浓度(cB)之间的认知模型:
m (g)
N(个)
n (mol)
÷NA
×M(g/mol)
÷M(g/mol)
×NA
气体体积V (L)
×Vm
÷Vm
课堂小结
单位体积的溶液里所含溶质B的物质的量。
mol/L(mol L-1)
cB
=
nB
V
1.概念
2.符号
3.单位
4.表示式
CB
5.含义
每升溶液中溶质的物质的量为多少mol
1、判断正误,正确的打“√”,错误的打“×”。
(1)将2 molNaCl投入1 L水中形成的溶液的物质的量浓度为2 mol·L-1( )
(2)从200 mL 0.1 mol·L-1盐酸中取出50 mL溶液,其物质的量浓度仍为0.1 mol·L-1( )
(3)0.1 mol·L-1的NaCl溶液中含有Na+的物质的量为0.1 mol( )
√
×
×
同步练习
(4)将25 g CuSO4·5H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 mol·L-1( )
(5)2mol/L的BaCl2溶液中Ba2+ 的物质的量浓度为2mol/L , Cl- 的物质的量浓度为4mol/L ( )
(6)从1L 1mol/L的NaOH溶液中取出 500 mL,浓度变为0.5 mol /L( )
√
×
×
2、1mol·L-1硫酸溶液的含义是( )
A.1L水中含有1mol硫酸
B.1L溶液中含有1molH+
C.将98g硫酸溶于1L水所配成的溶液
D.从1L该溶液中取出500mL后,剩余溶液的浓度仍为1mol·L-1
D
3、下列溶液中溶质的物质的量浓度为1 mol/L的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将NA个氨气分子通入1 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
D
4、在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
c(NH3)=
n(NH3)
V(溶液)
Vm
V(NH3)
=
V(溶液)
=
0.5mol
0.4L
=1.25mol/L
谢谢观看
必修第一册
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第5课时 物质的量浓度
[思考1]在初中我们用什么来表示的溶液浓度,是怎样表示的?
质量分数=
溶液的质量(g)
溶质的质量(g)
×100%
ω=
m(溶液)
m(溶质)
×100%
用溶质的质量分数表示
可变为
但对于溶液我们通常不称其质量,而是量它的体积。同时,在化学反应中,反应物与生成物之间的比例关系是由化学方程式中的化学计量数所决定的。那有什么更好的方法来表示溶液浓度吗?
可以用物质的量浓度来表示
PART
01
PART
02
能从宏观和微观的角度理解物质的量浓度的含义及其微观粒子间的关系。
能够根据物质的量浓度的概念表达式进行简单的计算,逐步提升证据推理思维能力。
核心素养发展目标
单位体积的溶液里所含溶质B的物质的量。
mol/L(mol L-1)
一、物质的量浓度
cB
=
nB
V
1.概念
2.符号
3.单位
4.表示式
CB
nB = cB·V
可变为
也称为溶质B的物质的量浓度
5.含义
每升溶液中溶质的物质的量为多少mol
1、V是溶液的体积,不是溶剂的体积。
2、溶质若为气体,出现气体体积时需要注意温度和压强。
二、有关 注意事项
cB
=
nB
V
3、溶液的体积不等于溶剂的体积,也不是溶质和溶剂体积的简单加和。是溶质和溶剂混合溶解后的实际体积,
ρ(溶液)=
m(溶液)
V(溶液)
用22.4 L/mol须在标况下
还要注意溶液体积的单位换算。
[思考2]:1 mol/LNaCl 溶液的含义是什么?
每升HCl溶液中含有 0.1 mol HCl
每升NaCl溶液中溶质NaCl的
物质的量为1 mol
含义1:
含义2:
每升NaCl溶液中Na+和Cl- 的物质的量均为1mol
[变式]:1 mol/L盐酸溶液的含义是什么?
每升盐酸溶液中H+和Cl- 的物质的量均为0.1mol
例1、判断正误,正确的打“√”,错误的打“×”。并说明理由
(1)将 1mol NaOH 溶于 1 L水中配成溶液,其物质的量浓度为1mol/L( )
(2)将 22.4L 的 NH3 溶于水配制成 1 L 溶液,所得溶液的浓度为1mol/L( )
(3)从100mL2mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度为1mol/L( )
理由:体积指的是溶液的体积,而不是溶剂的体积。
理由:没有指明气体的温度和压强,无法计算NH3的物质的量。
理由:溶液具有均一性,其物质的量浓度不变。
cB nB V
2 mol 1 L
6 mol/L 3 mol
1 mol/L 500 mL
0.5 L
cB
=
nB
V
可变为
V=
nB
cB
或nB=cB V
二、有关物质的量浓度的计算
1、 利用公式计算溶液中溶质的物质的量浓度
(1)按要求填空
1mol/L
1 mol
例2、配制500 mL 0.2mol/L医用生理盐水,需要NaCl的物质的量是多少?要NaCl的质量为多少?
【分析】已知物质的量浓度和体积,根据 nB=cB V,求得NaCl的物质的量。
根据m=n M,求得NaCl的质量
【解 】500 mL0.1mol/LNaCl溶液中NaCl的物质的量为:
n(NaCl)=c(NaCl)· V[NaCl(aq)]
=0.2mol/L× 0.5L
=0.1mol
注意体积单位的换算!
m(NaCl)=n(NaCl)· M(NaCl)=0.1mol× 58.5g/mol=5.85g
答:要NaCl的物质的量是0.1mol,NaCl的质量是5.85g。
[变式训练1]:把98克H2SO4配成1L稀H2SO4,则H2SO4物质的量浓度为多少?
解:c(H2SO4)=
n(H2SO4)
V(溶液)
=
M(H2SO4)
m(H2SO4)
V(溶液)
=1mol/L
=
1mol
1L
Na2O+H2O = 2NaOH
[思考3]把2 mol Na2O溶于水配成1L的溶液,所得溶质物质的量浓度是多少?
解:c(Na2O)=
n(Na2O)
V(溶液)
=2mol/L
×
2 mol
4 mol
1
2
解:c(NaOH)=
n(NaOH)
V(溶液)
=4mol/L
如Na、Na2O、Na2O2 NaOH,
SO3 H2SO4等。
如何正确判断溶液的溶质?
(1)物质能与水发生反应
则生成的新的物质为溶质
(2)含结晶水的物质如CuSO4·5H2O溶于水
CuSO4为溶质
比较物质的量浓度与质量分数
物理量 物质的量浓度 溶质的质量分数
定义
表达式
单位
(B) = 100%
cB =
mol·L-1
1
表示单位体积溶液里所含溶质B的物质的量
溶液里溶质质量与溶液质量的比值
cB(溶液)
×V(aq)
÷V(aq)
物质的量(n)为中心构建质量(m)、体积(V)、粒子数(N)、物质的量浓度(cB)之间的认知模型:
m (g)
N(个)
n (mol)
÷NA
×M(g/mol)
÷M(g/mol)
×NA
气体体积V (L)
×Vm
÷Vm
课堂小结
单位体积的溶液里所含溶质B的物质的量。
mol/L(mol L-1)
cB
=
nB
V
1.概念
2.符号
3.单位
4.表示式
CB
5.含义
每升溶液中溶质的物质的量为多少mol
1、判断正误,正确的打“√”,错误的打“×”。
(1)将2 molNaCl投入1 L水中形成的溶液的物质的量浓度为2 mol·L-1( )
(2)从200 mL 0.1 mol·L-1盐酸中取出50 mL溶液,其物质的量浓度仍为0.1 mol·L-1( )
(3)0.1 mol·L-1的NaCl溶液中含有Na+的物质的量为0.1 mol( )
√
×
×
同步练习
(4)将25 g CuSO4·5H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 mol·L-1( )
(5)2mol/L的BaCl2溶液中Ba2+ 的物质的量浓度为2mol/L , Cl- 的物质的量浓度为4mol/L ( )
(6)从1L 1mol/L的NaOH溶液中取出 500 mL,浓度变为0.5 mol /L( )
√
×
×
2、1mol·L-1硫酸溶液的含义是( )
A.1L水中含有1mol硫酸
B.1L溶液中含有1molH+
C.将98g硫酸溶于1L水所配成的溶液
D.从1L该溶液中取出500mL后,剩余溶液的浓度仍为1mol·L-1
D
3、下列溶液中溶质的物质的量浓度为1 mol/L的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将NA个氨气分子通入1 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
D
4、在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
c(NH3)=
n(NH3)
V(溶液)
Vm
V(NH3)
=
V(溶液)
=
0.5mol
0.4L
=1.25mol/L
谢谢观看
