第四单元盐化肥单元练习 九年级化学人教版(五四学制)全一册(含答案)
文档属性
| 名称 | 第四单元盐化肥单元练习 九年级化学人教版(五四学制)全一册(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 221.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 00:00:00 | ||
图片预览


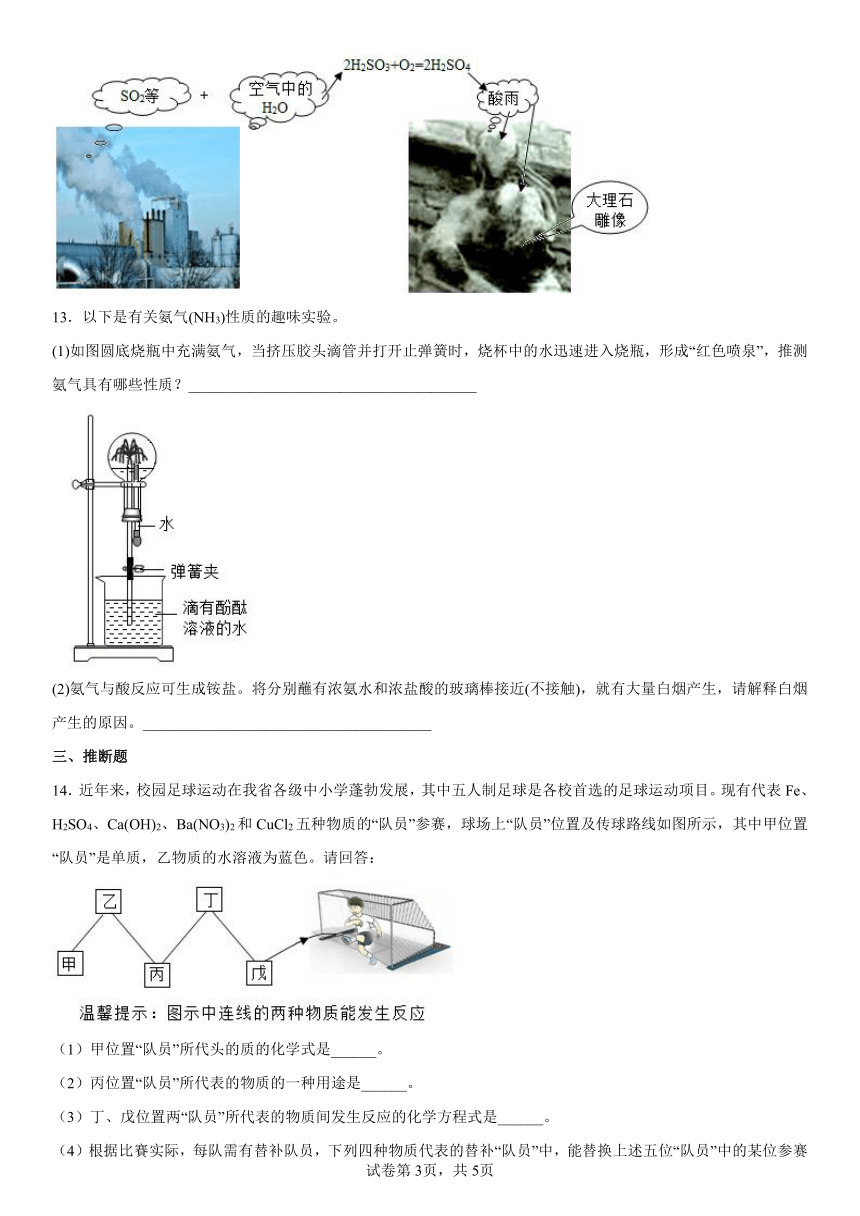
文档简介
第四单元盐化肥 同步练习
一、单选题
1.下列物质的的俗称和化学式一致的是( )
A.NaCl ——盐 B.NaHCO3——苏打
C.NaOH——纯碱、烧碱 D.Ca(OH)2——消石灰、熟石灰
2.K2CO3是常用的肥料,它属于
A.钾肥 B.氮肥 C.磷肥 D.复合肥
3.下列物质间能够发生反应,但没有出现明显现象的是
A.将稀盐酸滴入盛石灰石的试管中
B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中
D.将稀硫酸滴入NaCl溶液中
4.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
5.硝石是主要含KNO3的天然矿物,历史上《本草经集注》中对硝石有记载:“强烧之,紫青烟起…云是真硝石也”。下列有关KNO3的叙述不正确的是( )
A.是一种化合物 B.可用作复合肥料
C.可能发生分解反应 D.其溶解度一定大于NaCl的溶解度
6.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
7.除去下列各组物质中的杂质(括号内为杂质),所选用的试剂(足量)及操作方法均正确的是( )
选项 物质 选用试剂 操作方法
A Fe2O3(Fe) 盐酸 浸泡、过滤、洗涤、烘干
B CO(CO2) NaOH溶液、浓硫酸 洗气、干燥
C CaO(CaCO3) 水 过滤、烘干
D NaCl(Na2CO3) Ca(NO3)2溶液 溶解、过滤、蒸发、结晶
A.A B.B C.C D.D
8.以下归纳和总结完全正确的一组是
A.对酸的认识:①酸溶液中都存在H+②pH小于7的雨水为酸雨
B.对碱的认识:①碱溶液中都存在OH﹣②氨水可以作为氮肥使用
C.对盐的认识:①盐溶液都是中性的②盐类物质就是食盐可食用
D.对氧化物的认识:①氧化物都含有氧元素②氯酸钾是氧化物
9.下列反应属于复分解反应的是
A.4P+5O22P2O5 B.Fe+2HCl=FeCl2+H2↑
C.2H2O2H2↑+O2↑ D.Na2CO3+MgCl2=MgCO3↓+2NaCl
10.下列各组物质在溶液中能大量共存且形成无色溶液的是
A.NaCl BaCl2Na2CO3 B.KNO3HCl CaCl2
C.H2SO4 FeCl3NaNO3 D.NaOH HNO3NH4NO3
11.某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是
A.与足量稀盐酸充分反应,用排水法收集到 VmL气体
B.与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C.与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干操,得到m2g固体
D.与足量浓盐酸充分反应,逸出的气体用NaOH固体充分吸收,固体质量增加 m3g
二、简答题
12.自然界中的物质在不断地发生着变化,有些变化使人类的生存环境发生了恶化,例如,随着大量化石燃料(如含硫的煤)的使用,导致酸雨频发,致使大理石建筑物遭受严重侵蚀,请根据如图,解释大理石雕像受到侵蚀的主要原因._________.
13.以下是有关氨气(NH3)性质的趣味实验。
(1)如图圆底烧瓶中充满氨气,当挤压胶头滴管并打开止弹簧时,烧杯中的水迅速进入烧瓶,形成“红色喷泉”,推测氨气具有哪些性质?______________________________________
(2)氨气与酸反应可生成铵盐。将分别蘸有浓氨水和浓盐酸的玻璃棒接近(不接触),就有大量白烟产生,请解释白烟产生的原因。______________________________________
三、推断题
14.近年来,校园足球运动在我省各级中小学蓬勃发展,其中五人制足球是各校首选的足球运动项目。现有代表Fe、H2SO4、Ca(OH)2、Ba(NO3)2和CuCl2五种物质的“队员”参赛,球场上“队员”位置及传球路线如图所示,其中甲位置“队员”是单质,乙物质的水溶液为蓝色。请回答:
(1)甲位置“队员”所代头的质的化学式是______。
(2)丙位置“队员”所代表的物质的一种用途是______。
(3)丁、戊位置两“队员”所代表的物质间发生反应的化学方程式是______。
(4)根据比賽实际,每队需有替补队员,下列四种物质代表的替补“队员”中,能替换上述五位“队员”中的某位参赛的是______(填序号)。
A Cu B KCl C NaOH D Ca(NO3)2
15.某化学兴趣小组用Fe、H2SO4、Ba(OH)2、CuSO4和Na2CO3五种物质玩化学拼图游戏(见下图),游戏规则要求图中相邻物质之间能发生化学反应,其中 C 物质的溶液呈蓝色,A 与 E 反应产生的气体是光合作用的原料之一。
(1)A物质的俗称是____________,E物质的用途是____________。
(2)B与E反应的化学方程式为____________________;D与E反应的基本类型是______________。
(3)按游戏规则,CaCO3____________(填“能”或“不能”)替代A物质。
四、实验题
16.为验证稀盐酸的化学性质,同学们做了如图实验。
(1)试管A中刚开始无现象,过一会儿才看到气泡,原因是______。
(2)试管B中铁锈溶解对应的化学方程式为______。
(3)向试管C反应后的溶液中滴加紫色石蕊溶液,观察到______。
(4)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。滤液中一定存在的溶质是______(填化学式,下同),可能存在的溶质有______。
17.某化学学习小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。
(1)该反应的化学方程式为________________________________。
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:
①氢氧化钠和氢氧化钙; ②氢氧化钠和碳酸钠;③________________________。
(3)小王取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况_______(填序号)是不可能的。为了进一步确定溶液的成分,同学们设计了如下实验方案:
实验步骤 现象 结论
____ _________ 情况①正确
小李选择了另外一种不同类别的物质_______________(填化学式),也得出了同样的结论。
在同学们的合作下,他们顺利完成了探究任务。
五、计算题
18.高温煅烧12.5g大理石,完全分解产生0.1mol二氧化碳。求:
(1)大理石中碳酸钙的质量为___________g。(根据化学方程式列式计算)
(2)大理石中碳酸钙的质量分数为___________。
19.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.B
4.A
5.D
6.C
7.B
8.B
9.D
10.B
11.B
12.大理石的主要成分是碳酸钙,碳酸钙能和酸雨中的酸性物质反应,侵蚀大理石
13. 氨气易溶于水,溶液显碱性 浓盐酸易挥发出氯化氢气体,氯化氢气体能与氨气化合生成了氯化铵颗粒
14. Fe 改良酸性土壤等 C
15. 纯碱或苏打 除锈或生产化肥等 Ba(OH)2+H2SO4=BaSO4↓+2H2O 置换反应 不能
16.(1)开始稀盐酸先和氧化铝反应生成氯化铝和水
(2)Fe2O3+6HCl═2FeCl3+3H2O
(3)溶液会变红
(4) NaCl CaCl2或Na2CO3
17. Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 氢氧化钠(或NaOH) ② 取少量溶液于试管中,加入少量Na2CO3溶液 产生白色沉淀 CO2
18.(1)解:设大理石中碳酸钙的物质的量为x
x=0.1mol
大理石中碳酸钙的质量为0.1mol×100g/mol=10g;
(2)大理石中碳酸钙的质量分数为。
19.(1)9.8g (2)32%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质的的俗称和化学式一致的是( )
A.NaCl ——盐 B.NaHCO3——苏打
C.NaOH——纯碱、烧碱 D.Ca(OH)2——消石灰、熟石灰
2.K2CO3是常用的肥料,它属于
A.钾肥 B.氮肥 C.磷肥 D.复合肥
3.下列物质间能够发生反应,但没有出现明显现象的是
A.将稀盐酸滴入盛石灰石的试管中
B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中
D.将稀硫酸滴入NaCl溶液中
4.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
5.硝石是主要含KNO3的天然矿物,历史上《本草经集注》中对硝石有记载:“强烧之,紫青烟起…云是真硝石也”。下列有关KNO3的叙述不正确的是( )
A.是一种化合物 B.可用作复合肥料
C.可能发生分解反应 D.其溶解度一定大于NaCl的溶解度
6.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
7.除去下列各组物质中的杂质(括号内为杂质),所选用的试剂(足量)及操作方法均正确的是( )
选项 物质 选用试剂 操作方法
A Fe2O3(Fe) 盐酸 浸泡、过滤、洗涤、烘干
B CO(CO2) NaOH溶液、浓硫酸 洗气、干燥
C CaO(CaCO3) 水 过滤、烘干
D NaCl(Na2CO3) Ca(NO3)2溶液 溶解、过滤、蒸发、结晶
A.A B.B C.C D.D
8.以下归纳和总结完全正确的一组是
A.对酸的认识:①酸溶液中都存在H+②pH小于7的雨水为酸雨
B.对碱的认识:①碱溶液中都存在OH﹣②氨水可以作为氮肥使用
C.对盐的认识:①盐溶液都是中性的②盐类物质就是食盐可食用
D.对氧化物的认识:①氧化物都含有氧元素②氯酸钾是氧化物
9.下列反应属于复分解反应的是
A.4P+5O22P2O5 B.Fe+2HCl=FeCl2+H2↑
C.2H2O2H2↑+O2↑ D.Na2CO3+MgCl2=MgCO3↓+2NaCl
10.下列各组物质在溶液中能大量共存且形成无色溶液的是
A.NaCl BaCl2Na2CO3 B.KNO3HCl CaCl2
C.H2SO4 FeCl3NaNO3 D.NaOH HNO3NH4NO3
11.某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是
A.与足量稀盐酸充分反应,用排水法收集到 VmL气体
B.与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C.与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干操,得到m2g固体
D.与足量浓盐酸充分反应,逸出的气体用NaOH固体充分吸收,固体质量增加 m3g
二、简答题
12.自然界中的物质在不断地发生着变化,有些变化使人类的生存环境发生了恶化,例如,随着大量化石燃料(如含硫的煤)的使用,导致酸雨频发,致使大理石建筑物遭受严重侵蚀,请根据如图,解释大理石雕像受到侵蚀的主要原因._________.
13.以下是有关氨气(NH3)性质的趣味实验。
(1)如图圆底烧瓶中充满氨气,当挤压胶头滴管并打开止弹簧时,烧杯中的水迅速进入烧瓶,形成“红色喷泉”,推测氨气具有哪些性质?______________________________________
(2)氨气与酸反应可生成铵盐。将分别蘸有浓氨水和浓盐酸的玻璃棒接近(不接触),就有大量白烟产生,请解释白烟产生的原因。______________________________________
三、推断题
14.近年来,校园足球运动在我省各级中小学蓬勃发展,其中五人制足球是各校首选的足球运动项目。现有代表Fe、H2SO4、Ca(OH)2、Ba(NO3)2和CuCl2五种物质的“队员”参赛,球场上“队员”位置及传球路线如图所示,其中甲位置“队员”是单质,乙物质的水溶液为蓝色。请回答:
(1)甲位置“队员”所代头的质的化学式是______。
(2)丙位置“队员”所代表的物质的一种用途是______。
(3)丁、戊位置两“队员”所代表的物质间发生反应的化学方程式是______。
(4)根据比賽实际,每队需有替补队员,下列四种物质代表的替补“队员”中,能替换上述五位“队员”中的某位参赛的是______(填序号)。
A Cu B KCl C NaOH D Ca(NO3)2
15.某化学兴趣小组用Fe、H2SO4、Ba(OH)2、CuSO4和Na2CO3五种物质玩化学拼图游戏(见下图),游戏规则要求图中相邻物质之间能发生化学反应,其中 C 物质的溶液呈蓝色,A 与 E 反应产生的气体是光合作用的原料之一。
(1)A物质的俗称是____________,E物质的用途是____________。
(2)B与E反应的化学方程式为____________________;D与E反应的基本类型是______________。
(3)按游戏规则,CaCO3____________(填“能”或“不能”)替代A物质。
四、实验题
16.为验证稀盐酸的化学性质,同学们做了如图实验。
(1)试管A中刚开始无现象,过一会儿才看到气泡,原因是______。
(2)试管B中铁锈溶解对应的化学方程式为______。
(3)向试管C反应后的溶液中滴加紫色石蕊溶液,观察到______。
(4)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。滤液中一定存在的溶质是______(填化学式,下同),可能存在的溶质有______。
17.某化学学习小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。
(1)该反应的化学方程式为________________________________。
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:
①氢氧化钠和氢氧化钙; ②氢氧化钠和碳酸钠;③________________________。
(3)小王取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况_______(填序号)是不可能的。为了进一步确定溶液的成分,同学们设计了如下实验方案:
实验步骤 现象 结论
____ _________ 情况①正确
小李选择了另外一种不同类别的物质_______________(填化学式),也得出了同样的结论。
在同学们的合作下,他们顺利完成了探究任务。
五、计算题
18.高温煅烧12.5g大理石,完全分解产生0.1mol二氧化碳。求:
(1)大理石中碳酸钙的质量为___________g。(根据化学方程式列式计算)
(2)大理石中碳酸钙的质量分数为___________。
19.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.B
4.A
5.D
6.C
7.B
8.B
9.D
10.B
11.B
12.大理石的主要成分是碳酸钙,碳酸钙能和酸雨中的酸性物质反应,侵蚀大理石
13. 氨气易溶于水,溶液显碱性 浓盐酸易挥发出氯化氢气体,氯化氢气体能与氨气化合生成了氯化铵颗粒
14. Fe 改良酸性土壤等 C
15. 纯碱或苏打 除锈或生产化肥等 Ba(OH)2+H2SO4=BaSO4↓+2H2O 置换反应 不能
16.(1)开始稀盐酸先和氧化铝反应生成氯化铝和水
(2)Fe2O3+6HCl═2FeCl3+3H2O
(3)溶液会变红
(4) NaCl CaCl2或Na2CO3
17. Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 氢氧化钠(或NaOH) ② 取少量溶液于试管中,加入少量Na2CO3溶液 产生白色沉淀 CO2
18.(1)解:设大理石中碳酸钙的物质的量为x
x=0.1mol
大理石中碳酸钙的质量为0.1mol×100g/mol=10g;
(2)大理石中碳酸钙的质量分数为。
19.(1)9.8g (2)32%
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
