化学人教版(2019)选择性必修1 2.1.1.化学反应速率及影响因素(共37张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.1.1.化学反应速率及影响因素(共37张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 16:04:47 | ||
图片预览










文档简介
(共37张PPT)
第二章 化学反应速率与化学平衡
第一节 化学反应 速率
第1课时 化学反应速率及影响因素
1.知道化学反应速率的表示方法。
2.了解测定化学反应速率的简单方法。
3.能够进行有关的化学反应速率的简单计算。
4.了解温度、浓度、压强和催化剂对化学反应速率的影响。
学习目标:
在化学实验和日常生活中,我们经常观察到有些反应进行得快,有些反应进行得慢。
爆炸
牛奶变质
钢铁生锈
溶洞形成
哪个反应快?
我们可通过观察对比哪些实验现象来定性描述化学反应的快慢?
①冒气泡快慢
②颜色变化快慢
③固体物质的减少快慢
④出现浑浊的快慢
⑤温度变化快慢
如何定量描述化学反应的快慢呢
只能粗略估计化学反应进行的快慢(定性角度)
请同学们阅读课本22-23页的内容,回答以下问题:
1、化学反应速率的概念?
2、化学反应速率如何表示,符号,单位是什么?
3、化学反应速率如何计算,写出数学表达式。
一、化学反应速率
1.概念:用来衡量化学反应过程进行的快慢的物理量
3.数学表达式:
4.常用单位:
mol/(L min)、 mol/(L s)
=
V Δt
Δn
 ̄ ̄ ̄
υ=
Δt
Δc
 ̄ ̄
2.表示方法:
通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
0.5 mol/(L·s)
1.5 mol/(L·s)
1 mol/(L·s)
一样快
例1、反应:A(g) + 3B(g) 2C(g)在1L密闭容器中进行,不同时间各物质的物质的量如下,完成表格并求出各物质在2 s内的速率。
A B C
开始 3 mol 7 mol 0 mol
2s末 2 mol 4 mol 2 mol
v
=
3 mol –2 mol
1L×2 s
v(A)
c(A)
t
=
= 0.5 mol·L-1·s-1
n(A)
V× t
=
问1:第2s的用A表示的反应速率为多少?
问2:哪个速率最快?
问3:用A、B、C表示的同一反应速率在数值上有什么关系?
无法确定
数值之比等于化学计量数之比
例2.已知:S2O32—+2H+=SO2↑+S↓+H2O,将1mol/L的Na2S2O3和1mol/L的H2SO4等体积混合,反应到3min时,测得容器内H+浓度为0.4mol/L,则这段时间用H+和S2O32—表示的速率分别为?
三段式
解: S2O32—+2H+==SO2↑+S↓+H2O
C始(mol/L):
△C(mol/L):
C2s末(mol/L):
则υ(H+) = 0.6/3=0.2 mol/(L·min)
0.5
1
0
0.3
0.4
0
0.6
0.2
υ(S2O32—) = 0.3/3=0.1mol/(L·min)
若用SO2、S、H2O来表示该反应速率应为多少?
思考:为什么用H+和S2O32—所表示的反应速率其数值符合2:1——化学计量数之比?
【说明】速率、平衡中的计算一般运用“三段思维法”,即“起始”、“转化”、“平衡或末”时的情况来考虑,这种方法的优点在于各物质的量及变化非常清晰,一目了然。
Δn之比=Δc之比=化学计量数之比
解: N2 + 3H2 2NH3
υ (H2) =
△n (H2)
V△t
0. 18mol/2L
2min
=
三段分析法
υ (N2) = 0.015mol /(L·min)
υ (NH3) = 0.03mol /(L·min)
n始:
0.4 mol
0.8 mol
0 mol
△ n :
0.06 mol
0.18 mol
0.12 mol
n2min:
0.34 mol
0.62 mol
0.12 mol
【例2】在2 L容积不变的容器中,发生 N2+3H2 2NH3的反应。
现通入0.8 mol H2 和 0.4 mol N2 , 2 min 后生成了0.12 mol NH3 ,
求υ (H2)、 υ (N2) 、 υ (NH3)。
υ (N2) ︰ υ(H2) ︰ υ (NH3) = 1 ︰ 3 ︰ 2
问4:为什么用不同物质表示的同一反应速率的数值之比等于化学计量数之比?
(1)写出有关反应的化学方程式;
(2)标出各物质的起始量、变化量、最终量(可用物质的量,也可用物质的量浓度);
(3)根据已知条件计算。
= 0.045 mol/(L·min)
Δn之比=Δc之比=化学计量数之比
【归纳】
(3)一般不用固体或纯液体表示化学反应速率
5、化学反应速率注意事项
巩固:P30题3、4
(1)化学反应速率一般为平均速率,且只有正值。
(2)不同物质表示反应速率之比=化学计量数之比。
mA(g)+nB(g)?? pC(g) + qD(g)
υ(A):υ(B) :υ(C):υ(D)=m:n:p:q
变式:
=
υ(A)
m
=
υ(B)
n
=
υ(C)
p
υ(D)
q
对于一个反应:
【例3】在2A(g)+B(g) 3C(g)+5D(g)反应中,表示该反应速率最快的是( )
A.v(A)=2mol·L-1·min-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.8mol·L-1·s-1 D.v(D)=1mol·L-1·s-1
B
归一法
(4)化学反应速率的比较
同一物质、统一单位!
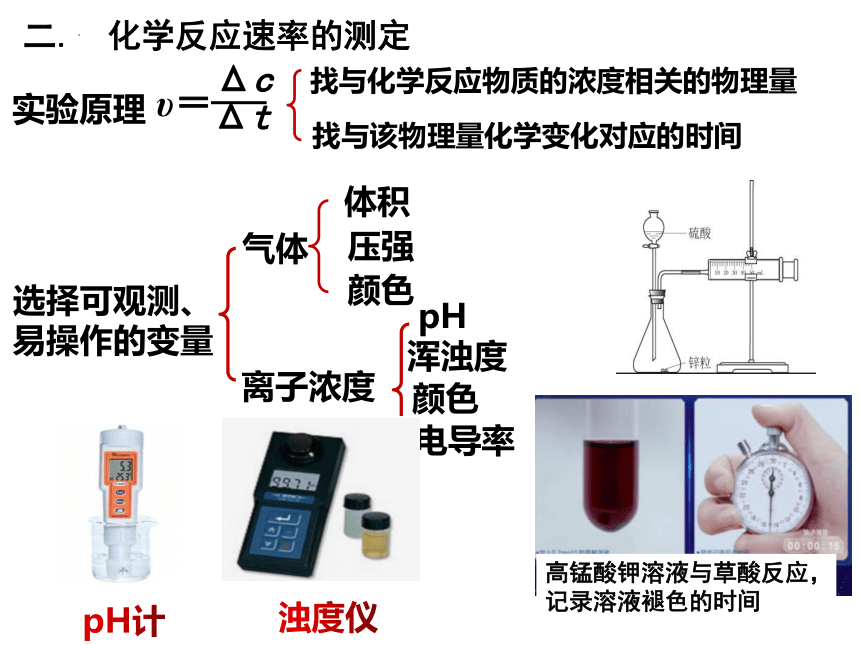
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
二. 化学反应速率的测定
例:在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2↑
催化剂
υ(O2)
υ(H2O2)
测量
选择可观测、易操作的变量
浓度变化容易测量吗?我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测哪些物理量呢?
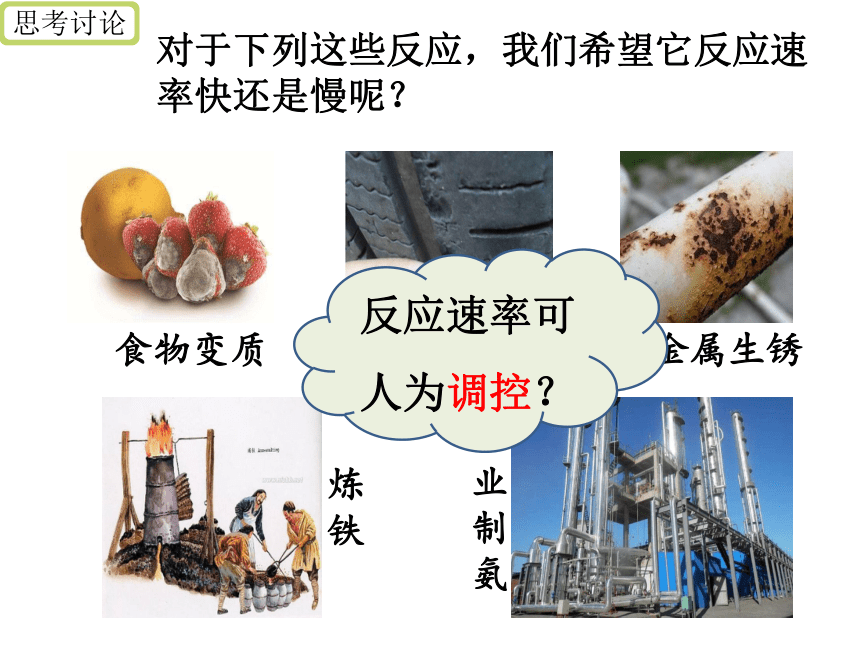
思考讨论
对于下列这些反应,我们希望它反应速率快还是慢呢?
食物变质
橡胶老化
金属生锈
炼铁
工业制氨
反应速率可人为调控?
三、影响化学反应速率的因素
如何定性与定量研究
影响化学反应速率的因素呢?
这些因素如何影响 ν ?如何测定 ν ?
1、内因
2、外因
——反应物本身的性质,如金属活动性,是决定因素,不可调控
——外界环境,如催化剂、温度、浓度等,可人为调控
反应物的化学性质越活泼,化学反应速率越快;反之,化学反应速率越慢
小结:
三、影响化学反应速率的因素
1、内因
2、外因
——反应物本身的性质,
——外界环境,如催化剂、温度、浓度等,
一般条件下:
(1)其他条件相同时,增大浓度,反应速率增大
(2)其他条件相同时,升高温度,反应速率增大
温度每升高10℃,化学反应速率增大为原来的2-4倍
(3)其他条件相同时,催化剂可以改变化学应速率
催化剂不同对速率的影响不同
思考:
(1)上述实验中我们分别从什么角度判断反应速率的快慢?
(2)Na2S2O3的实验中为什么从产生SO2气体的体积判断反应的快慢?
(3)在研究某一因素对速率的影响时我们要注意什么问题?
变量控制
科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。
气体体积的测定
思考:(1)相比较而言实验中选择的装置有何优点?
操作更简单,读数更准确
(2)如何检查该装置气密性?
关闭分液漏斗活塞,向外拉注射器的活塞,放开活塞,若活塞能回到原位,则气密性良好。
(3)有人认为该装置存在明显不足,你认为是?
如何改进?
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大
小结:
三、影响化学反应速率的因素
1、内因
2、外因
——反应物本身的性质,
——外界环境,如催化剂、温度、浓度等,
一般条件下:
(1)其他条件相同时,增大浓度,反应速率增大
(2)其他条件相同时,升高温度,反应速率增大
(3)其他条件相同时,催化剂可以改变化学应速率
催化剂不同对速率的影响不同
(4)其他条件相同时,增大接触面积,反应速率增大
三、影响化学反应速率的因素
1、内因
2、外因
——反应物本身的性质,
——外界环境,如催化剂、温度、浓度等,
一般条件下:
(1)其他条件相同时,增大浓度,反应速率增大
(2)其他条件相同时,升高温度,反应速率增大
(3)其他条件相同时,催化剂可以改变化学应速率
催化剂不同对速率的影响不同
(4)其他条件相同时,增大接触面积,反应速率增大
知识回顾
(5)压强对化学反应速率的影响
其他条件相同时,增大压强,
反应速率增大
讨论:
1、增大压强能增大反应速率的原因是什么?
2、对任何反应增大压强都能增大速率吗?
3、压强的改变一定会引起体积改变吗?
4、保持压强不变,浓度就不能改变吗?
小结:(5)压强对化学反应速率的影响
其他条件不变
增大压强
浓度增大
速率加快
①压强对固体和液体(溶液)间的反应无影响
②注意压强的“真”变和“假”变。
即:
保持V不变充入惰性气体,P增大但c不变,故υ不变
保持P不变充入惰性气体,体积增大c减小,故υ减小
压强对反应的影响本质上是浓度的影响。
体积减少
课堂巩固:
1.下列条件一定能使化学反应速率增大的是( )
①增加反应物的物质的量 ②升高温度
③缩小反应容器的体积 ④加入生成物
A.只有② B.②③ C.①② D.全部
A
2、根据下图填空:
(1)反应物是________;生成物是________。
(2)在2 min内用A、B、C表示的化学反应速率分别为
_ ______ _、___ _____、__ ______。
(3)该反应的化学方程式是_____________________
____________________________________________。
A、B
C
3 mol/(L·min)
2 mol/(L·min)
3 mol/(L·min)
3A+2B 3C
四、活化能
如何解释浓度、温度、压强及催化剂等因素对υ的影响呢?
活化能
简单的碰撞理论
1、基元反应:
例如:NO2 + CO=NO + CO2
2HI===H2+I2
2HI → H2+2I·
2I· → I2
自由基
带有单电子的原子或原子团
分两步
2、反应机理:反映化学反应先后进行的各个基元反应。
阅读P27,化学反应发生的先决条件是?是不是所有的碰撞都会发生反应?
一步完成的反应
非基元反应
3、有效碰撞:
a.力量不够
b. 取向不好
c. 有效碰撞
发生有效碰撞的条件
(1)发生碰撞的分子必须有足够高的能量;
(2)分子发生碰撞时必须有合适的取向。
——活化分子
辨析:活化分子间的碰撞一定有效吗?
有效碰撞的分子一定是活化分子吗?
能够发生化学反应的碰撞。
4、活化分子:
5、活化能:
具有足够能量,能发生有效碰撞的分子
活化分子的平均能量与反应物分子的平均能量之差
活化分子数(n活)
反应物分子总数(n总)
==
活化分子百分数(活%)
对某一反应而言,一定条件下,活化分子的百分数是一定值。
6、活化分子百分数:
活化分子
E1——活化能
E2——逆反应活化能
△H=E1-E2
反应热与E1、E2有关吗?
改变什么条件能改变活化分子百分数?
反应物浓度增大
单位体积内活化分子数增加
单位时间内,有效碰撞次数增加
化学反应速率增大
(1)浓度对反应速率的影响
7、有效碰撞理论对影响化学反应速率因素的解释
增大浓度
P28思考与讨论
(c活增大)
(2)压强对反应速率的影响
压强增大
浓度增大
单位体积内活化分子数增加
化学反应速率增大
单位时间内有效碰撞次数增加
增大压强
(c活增大)
升高温度
单位时间内有效碰撞次数增加
化学反应速率增大
3、温度对反应速率的影响
反应物分子能量增加
普通分子变成活化分子
升高温度
活%↑
活化分子的百分比增加
单位体积内活化分子数增加
(c活增大)
4、催化剂对反应速率的影响
加催化剂
改变反应历程
降低活化能
活化分子的百分比增加
使更多的普通分子变成活化分子
加催化剂
单位时间内有效碰撞次数增加
化学反应速率增大
活%↑
c活增大
课堂小结
1、浓度
C增大
C活增大
单位时间有效碰撞次数增多
υ增大
2、压强
P增大
V减小
3、温度
T升高
4、催化剂
使用催化剂
影响化学反应速率的因素的微观分析
活%增大
?
浓度、压强、温度、催化剂改变速率的实质
C活增大
单位时间有效碰撞次数增多
υ增大
下列说法错误的是( )
①碰撞理论认为,反应物分子间进行碰撞才可能发生化学反应
②活化分子间的碰撞一定是有效碰撞
③催化剂加快反应速率的本质是降低了反应的活化能
④只有增加活化分子的百分含量才能加快反应速率
⑤对于基元反应而言,温度升高,反应速率一定增加
A.①④ B.②④ C.③⑤ D.②⑤
B
课堂巩固:
5、其他因素对化学反应速率的影响
(1)增大接触面积,反应速率增大
(2)光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等向体系输入能量,都可能改变反应速率
小结:外界条件对化学反应速率的影响
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
加催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
催化剂 >>温度>浓度=压强(体积变化引起的)
1.反应A→C分两步进行:①A→B,②B→C。反应过程的能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。按要求回答下列问题:
(1)整个反应中ΔH= 。
深度思考
E1-E2+E3-E4
(2)使用催化剂 (填“能”或“不能”)影响该反应的反应热。
(3)三种化合物中 最稳定。
不能
C
1、增大反应物的浓度使反应速率加快的主要原因( )
对于气体参与体系增大压强使反应速率加快的主要原因是( )
升高温度使反应速率加快的主要原因是( )
使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
2、下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
3、设NO+CO2 2CO(正反应吸热)反应速率为v1;
N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
第二章 化学反应速率与化学平衡
第一节 化学反应 速率
第1课时 化学反应速率及影响因素
1.知道化学反应速率的表示方法。
2.了解测定化学反应速率的简单方法。
3.能够进行有关的化学反应速率的简单计算。
4.了解温度、浓度、压强和催化剂对化学反应速率的影响。
学习目标:
在化学实验和日常生活中,我们经常观察到有些反应进行得快,有些反应进行得慢。
爆炸
牛奶变质
钢铁生锈
溶洞形成
哪个反应快?
我们可通过观察对比哪些实验现象来定性描述化学反应的快慢?
①冒气泡快慢
②颜色变化快慢
③固体物质的减少快慢
④出现浑浊的快慢
⑤温度变化快慢
如何定量描述化学反应的快慢呢
只能粗略估计化学反应进行的快慢(定性角度)
请同学们阅读课本22-23页的内容,回答以下问题:
1、化学反应速率的概念?
2、化学反应速率如何表示,符号,单位是什么?
3、化学反应速率如何计算,写出数学表达式。
一、化学反应速率
1.概念:用来衡量化学反应过程进行的快慢的物理量
3.数学表达式:
4.常用单位:
mol/(L min)、 mol/(L s)
=
V Δt
Δn
 ̄ ̄ ̄
υ=
Δt
Δc
 ̄ ̄
2.表示方法:
通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
0.5 mol/(L·s)
1.5 mol/(L·s)
1 mol/(L·s)
一样快
例1、反应:A(g) + 3B(g) 2C(g)在1L密闭容器中进行,不同时间各物质的物质的量如下,完成表格并求出各物质在2 s内的速率。
A B C
开始 3 mol 7 mol 0 mol
2s末 2 mol 4 mol 2 mol
v
=
3 mol –2 mol
1L×2 s
v(A)
c(A)
t
=
= 0.5 mol·L-1·s-1
n(A)
V× t
=
问1:第2s的用A表示的反应速率为多少?
问2:哪个速率最快?
问3:用A、B、C表示的同一反应速率在数值上有什么关系?
无法确定
数值之比等于化学计量数之比
例2.已知:S2O32—+2H+=SO2↑+S↓+H2O,将1mol/L的Na2S2O3和1mol/L的H2SO4等体积混合,反应到3min时,测得容器内H+浓度为0.4mol/L,则这段时间用H+和S2O32—表示的速率分别为?
三段式
解: S2O32—+2H+==SO2↑+S↓+H2O
C始(mol/L):
△C(mol/L):
C2s末(mol/L):
则υ(H+) = 0.6/3=0.2 mol/(L·min)
0.5
1
0
0.3
0.4
0
0.6
0.2
υ(S2O32—) = 0.3/3=0.1mol/(L·min)
若用SO2、S、H2O来表示该反应速率应为多少?
思考:为什么用H+和S2O32—所表示的反应速率其数值符合2:1——化学计量数之比?
【说明】速率、平衡中的计算一般运用“三段思维法”,即“起始”、“转化”、“平衡或末”时的情况来考虑,这种方法的优点在于各物质的量及变化非常清晰,一目了然。
Δn之比=Δc之比=化学计量数之比
解: N2 + 3H2 2NH3
υ (H2) =
△n (H2)
V△t
0. 18mol/2L
2min
=
三段分析法
υ (N2) = 0.015mol /(L·min)
υ (NH3) = 0.03mol /(L·min)
n始:
0.4 mol
0.8 mol
0 mol
△ n :
0.06 mol
0.18 mol
0.12 mol
n2min:
0.34 mol
0.62 mol
0.12 mol
【例2】在2 L容积不变的容器中,发生 N2+3H2 2NH3的反应。
现通入0.8 mol H2 和 0.4 mol N2 , 2 min 后生成了0.12 mol NH3 ,
求υ (H2)、 υ (N2) 、 υ (NH3)。
υ (N2) ︰ υ(H2) ︰ υ (NH3) = 1 ︰ 3 ︰ 2
问4:为什么用不同物质表示的同一反应速率的数值之比等于化学计量数之比?
(1)写出有关反应的化学方程式;
(2)标出各物质的起始量、变化量、最终量(可用物质的量,也可用物质的量浓度);
(3)根据已知条件计算。
= 0.045 mol/(L·min)
Δn之比=Δc之比=化学计量数之比
【归纳】
(3)一般不用固体或纯液体表示化学反应速率
5、化学反应速率注意事项
巩固:P30题3、4
(1)化学反应速率一般为平均速率,且只有正值。
(2)不同物质表示反应速率之比=化学计量数之比。
mA(g)+nB(g)?? pC(g) + qD(g)
υ(A):υ(B) :υ(C):υ(D)=m:n:p:q
变式:
=
υ(A)
m
=
υ(B)
n
=
υ(C)
p
υ(D)
q
对于一个反应:
【例3】在2A(g)+B(g) 3C(g)+5D(g)反应中,表示该反应速率最快的是( )
A.v(A)=2mol·L-1·min-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.8mol·L-1·s-1 D.v(D)=1mol·L-1·s-1
B
归一法
(4)化学反应速率的比较
同一物质、统一单位!
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
二. 化学反应速率的测定
例:在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2↑
催化剂
υ(O2)
υ(H2O2)
测量
选择可观测、易操作的变量
浓度变化容易测量吗?我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测哪些物理量呢?
思考讨论
对于下列这些反应,我们希望它反应速率快还是慢呢?
食物变质
橡胶老化
金属生锈
炼铁
工业制氨
反应速率可人为调控?
三、影响化学反应速率的因素
如何定性与定量研究
影响化学反应速率的因素呢?
这些因素如何影响 ν ?如何测定 ν ?
1、内因
2、外因
——反应物本身的性质,如金属活动性,是决定因素,不可调控
——外界环境,如催化剂、温度、浓度等,可人为调控
反应物的化学性质越活泼,化学反应速率越快;反之,化学反应速率越慢
小结:
三、影响化学反应速率的因素
1、内因
2、外因
——反应物本身的性质,
——外界环境,如催化剂、温度、浓度等,
一般条件下:
(1)其他条件相同时,增大浓度,反应速率增大
(2)其他条件相同时,升高温度,反应速率增大
温度每升高10℃,化学反应速率增大为原来的2-4倍
(3)其他条件相同时,催化剂可以改变化学应速率
催化剂不同对速率的影响不同
思考:
(1)上述实验中我们分别从什么角度判断反应速率的快慢?
(2)Na2S2O3的实验中为什么从产生SO2气体的体积判断反应的快慢?
(3)在研究某一因素对速率的影响时我们要注意什么问题?
变量控制
科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。
气体体积的测定
思考:(1)相比较而言实验中选择的装置有何优点?
操作更简单,读数更准确
(2)如何检查该装置气密性?
关闭分液漏斗活塞,向外拉注射器的活塞,放开活塞,若活塞能回到原位,则气密性良好。
(3)有人认为该装置存在明显不足,你认为是?
如何改进?
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大
小结:
三、影响化学反应速率的因素
1、内因
2、外因
——反应物本身的性质,
——外界环境,如催化剂、温度、浓度等,
一般条件下:
(1)其他条件相同时,增大浓度,反应速率增大
(2)其他条件相同时,升高温度,反应速率增大
(3)其他条件相同时,催化剂可以改变化学应速率
催化剂不同对速率的影响不同
(4)其他条件相同时,增大接触面积,反应速率增大
三、影响化学反应速率的因素
1、内因
2、外因
——反应物本身的性质,
——外界环境,如催化剂、温度、浓度等,
一般条件下:
(1)其他条件相同时,增大浓度,反应速率增大
(2)其他条件相同时,升高温度,反应速率增大
(3)其他条件相同时,催化剂可以改变化学应速率
催化剂不同对速率的影响不同
(4)其他条件相同时,增大接触面积,反应速率增大
知识回顾
(5)压强对化学反应速率的影响
其他条件相同时,增大压强,
反应速率增大
讨论:
1、增大压强能增大反应速率的原因是什么?
2、对任何反应增大压强都能增大速率吗?
3、压强的改变一定会引起体积改变吗?
4、保持压强不变,浓度就不能改变吗?
小结:(5)压强对化学反应速率的影响
其他条件不变
增大压强
浓度增大
速率加快
①压强对固体和液体(溶液)间的反应无影响
②注意压强的“真”变和“假”变。
即:
保持V不变充入惰性气体,P增大但c不变,故υ不变
保持P不变充入惰性气体,体积增大c减小,故υ减小
压强对反应的影响本质上是浓度的影响。
体积减少
课堂巩固:
1.下列条件一定能使化学反应速率增大的是( )
①增加反应物的物质的量 ②升高温度
③缩小反应容器的体积 ④加入生成物
A.只有② B.②③ C.①② D.全部
A
2、根据下图填空:
(1)反应物是________;生成物是________。
(2)在2 min内用A、B、C表示的化学反应速率分别为
_ ______ _、___ _____、__ ______。
(3)该反应的化学方程式是_____________________
____________________________________________。
A、B
C
3 mol/(L·min)
2 mol/(L·min)
3 mol/(L·min)
3A+2B 3C
四、活化能
如何解释浓度、温度、压强及催化剂等因素对υ的影响呢?
活化能
简单的碰撞理论
1、基元反应:
例如:NO2 + CO=NO + CO2
2HI===H2+I2
2HI → H2+2I·
2I· → I2
自由基
带有单电子的原子或原子团
分两步
2、反应机理:反映化学反应先后进行的各个基元反应。
阅读P27,化学反应发生的先决条件是?是不是所有的碰撞都会发生反应?
一步完成的反应
非基元反应
3、有效碰撞:
a.力量不够
b. 取向不好
c. 有效碰撞
发生有效碰撞的条件
(1)发生碰撞的分子必须有足够高的能量;
(2)分子发生碰撞时必须有合适的取向。
——活化分子
辨析:活化分子间的碰撞一定有效吗?
有效碰撞的分子一定是活化分子吗?
能够发生化学反应的碰撞。
4、活化分子:
5、活化能:
具有足够能量,能发生有效碰撞的分子
活化分子的平均能量与反应物分子的平均能量之差
活化分子数(n活)
反应物分子总数(n总)
==
活化分子百分数(活%)
对某一反应而言,一定条件下,活化分子的百分数是一定值。
6、活化分子百分数:
活化分子
E1——活化能
E2——逆反应活化能
△H=E1-E2
反应热与E1、E2有关吗?
改变什么条件能改变活化分子百分数?
反应物浓度增大
单位体积内活化分子数增加
单位时间内,有效碰撞次数增加
化学反应速率增大
(1)浓度对反应速率的影响
7、有效碰撞理论对影响化学反应速率因素的解释
增大浓度
P28思考与讨论
(c活增大)
(2)压强对反应速率的影响
压强增大
浓度增大
单位体积内活化分子数增加
化学反应速率增大
单位时间内有效碰撞次数增加
增大压强
(c活增大)
升高温度
单位时间内有效碰撞次数增加
化学反应速率增大
3、温度对反应速率的影响
反应物分子能量增加
普通分子变成活化分子
升高温度
活%↑
活化分子的百分比增加
单位体积内活化分子数增加
(c活增大)
4、催化剂对反应速率的影响
加催化剂
改变反应历程
降低活化能
活化分子的百分比增加
使更多的普通分子变成活化分子
加催化剂
单位时间内有效碰撞次数增加
化学反应速率增大
活%↑
c活增大
课堂小结
1、浓度
C增大
C活增大
单位时间有效碰撞次数增多
υ增大
2、压强
P增大
V减小
3、温度
T升高
4、催化剂
使用催化剂
影响化学反应速率的因素的微观分析
活%增大
?
浓度、压强、温度、催化剂改变速率的实质
C活增大
单位时间有效碰撞次数增多
υ增大
下列说法错误的是( )
①碰撞理论认为,反应物分子间进行碰撞才可能发生化学反应
②活化分子间的碰撞一定是有效碰撞
③催化剂加快反应速率的本质是降低了反应的活化能
④只有增加活化分子的百分含量才能加快反应速率
⑤对于基元反应而言,温度升高,反应速率一定增加
A.①④ B.②④ C.③⑤ D.②⑤
B
课堂巩固:
5、其他因素对化学反应速率的影响
(1)增大接触面积,反应速率增大
(2)光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等向体系输入能量,都可能改变反应速率
小结:外界条件对化学反应速率的影响
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
加催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
催化剂 >>温度>浓度=压强(体积变化引起的)
1.反应A→C分两步进行:①A→B,②B→C。反应过程的能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。按要求回答下列问题:
(1)整个反应中ΔH= 。
深度思考
E1-E2+E3-E4
(2)使用催化剂 (填“能”或“不能”)影响该反应的反应热。
(3)三种化合物中 最稳定。
不能
C
1、增大反应物的浓度使反应速率加快的主要原因( )
对于气体参与体系增大压强使反应速率加快的主要原因是( )
升高温度使反应速率加快的主要原因是( )
使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
2、下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
3、设NO+CO2 2CO(正反应吸热)反应速率为v1;
N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
