北京课改版化学九年级上册第3章:构成物质的微粒复习课件(共19张PPT)
文档属性
| 名称 | 北京课改版化学九年级上册第3章:构成物质的微粒复习课件(共19张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 16:11:24 | ||
图片预览






文档简介
(共19张PPT)
第3章 构成物质的微粒
九年级上册
目
习
标
复
2.知道在化学反应中分子可以分解为原子,原子可以结合成分子,原子和离子通过得失电子可以相互转换
L
1.知道分子、原子、离子都是构成
物质的微粒,以及它们的性质
3.知道原子是由原子核和核外电子构成的
能够根据相对原子质量求算相对分子质量
经过长期的研究证实:构成物质的微粒有分子、原子和离子
有的物质由分子构成,有的物质由原子构成,有的物质由离子构成
干冰由二氧化碳分子构成
金刚石由碳原子构成
氯化钠由钠离子和氯离子构成
(1)由分子构成的物质,分子能保持其化学性质。
(2)由原子构成的物质,原子能保持其化学性质。
分子和原子都能保持物质的化学性质
水的化学性质由水分子保持
汞的化学性质由汞原子保持
1、分子的表示方法:用化学式表示, 例如:水分子--H2O,氧分子--O2,等。
2、原子的表示方法:用元素符号表示, 例如:氧原子 --O,氢原子--H等。
3、离子符号表示方法:先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面,例如:镁离子--Mg2+ ,氯离子--Cl-等。
分子、原子、离子的化学表示方法
1.分子和原子都能直接构成物质,分子和原子都是微粒
2.质量小,体积小;分子和原子都在不断的运动;分子
和原子之间都有间隙 。
共同点:
分子、原子比较
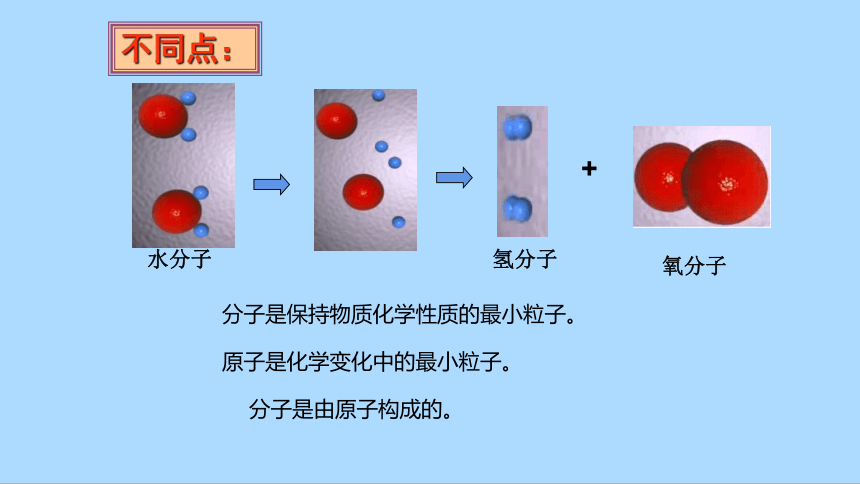
原子是化学变化中的最小粒子。
分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
水分子
氢分子
氧分子
+
不同点:
在化学变化中:
分解 重新聚合 聚集成
分子 原子 新分子 新物质
化学变化的实质:
在化学变化中,分子分成原子,原子又重新组合成新的分子。
本质区别:变化前后有无其他物质生成
1
物理变化时,分子本身没有变化,只是分子间的间隔变了,
2
化学变化中分子改变。
3
区分物理变化和化学变化
原子的构成
原 子
电 子
原子核
质 子
中 子
(带正电)
(不带电)
(带负电)
(带正电)
(不带电)
原子的结构
注意:相对原子质量只是一个比值,不是原子的实际质量。单位为1。
2、相对原子质量=
某原子的质量
碳原子的质量x1/12
1、国际上规定:以一种碳原子质量的1/12作为标准,其他原子的
质量跟它比较所得的数值。
相对原子质量
电子层符号
K L M N O P Q
电子层序数(n)
1 2 3 4 5 6 7
电子离核的距离
近
远
电子具有的能量
低
高
核外电子的分层排布(又叫分层运动)
能量低的在离核近的区域运动,能量高的在离核远的区域运动。
核外电子分层排布示意图
+11
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
质子数带正电
“+”表示
最外层电子数
数字1也可以表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
原子结构示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种图形。
元素分类 电子数 化学反应中得失电子的情况
金属元素 最外层一般少于4个 易失去最外层电子而达稳定结构
非金属元素 一般等于或多于4个 易得到电子而达稳定结构
稀有气体
元素 8个(氦为2个) 不易失去也不易得到电子
元素的性质与原子核外最外层电子数的关系
【结论】元素的性质,特别是化学性质与原子最外层电子有密切关系。
结构
性质
决定
例如
阳离子:带正电荷的原子或原子团。
阴离子:带负电荷的原子或原子团。
先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面
2Mg2+
定义
带电荷的原子或原子团叫做离子。
分类
写法
离子符号意义
表示每个镁离子带2个单位的正电荷
表示2个镁离子
练一练
1、下列物质中存在氧分子的是( )
A.高锰酸钾
B.液态氧
C.空气
D.双氧水
2、电解水的反应中没有发生变化的粒子是( )
A.氢原子
B.水分子
C.氧原子
D 氧分子
B
AC
3、下列有关原子、分子的说法错误的是 ( )
A.原子、分子都是构成物质的微粒
B.原子、分子总是在不断地运动
C.分子可以再分,原子不能再分
D.分子间有一定的间隔
C
4、如图是某元素的原子结构示意图。下列说法不正确的( )
A.该原子的质子数为12
B.该原子的核外有三个电子层
C.该原子的核外电子数为12
D.该原子在化学反应中容易得到2个电子
D
分子
物质
原子
离子
结合
得、失电子
失、得电子
分解
1、同步练习:
2、预习作业:
(1)净化水的基本方法有哪些?
(2)水的电解现象是什么?单质和化合物的区别有哪些?
(1)元素种类的是 ( )
A.电子数 B.质子数 C.中子数 D.最外层电子数
(2)下列各种物质中,由离子构成的是( )
A.Fe B.H2O C.NaCl D.CO2
B
C
第3章 构成物质的微粒
九年级上册
目
习
标
复
2.知道在化学反应中分子可以分解为原子,原子可以结合成分子,原子和离子通过得失电子可以相互转换
L
1.知道分子、原子、离子都是构成
物质的微粒,以及它们的性质
3.知道原子是由原子核和核外电子构成的
能够根据相对原子质量求算相对分子质量
经过长期的研究证实:构成物质的微粒有分子、原子和离子
有的物质由分子构成,有的物质由原子构成,有的物质由离子构成
干冰由二氧化碳分子构成
金刚石由碳原子构成
氯化钠由钠离子和氯离子构成
(1)由分子构成的物质,分子能保持其化学性质。
(2)由原子构成的物质,原子能保持其化学性质。
分子和原子都能保持物质的化学性质
水的化学性质由水分子保持
汞的化学性质由汞原子保持
1、分子的表示方法:用化学式表示, 例如:水分子--H2O,氧分子--O2,等。
2、原子的表示方法:用元素符号表示, 例如:氧原子 --O,氢原子--H等。
3、离子符号表示方法:先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面,例如:镁离子--Mg2+ ,氯离子--Cl-等。
分子、原子、离子的化学表示方法
1.分子和原子都能直接构成物质,分子和原子都是微粒
2.质量小,体积小;分子和原子都在不断的运动;分子
和原子之间都有间隙 。
共同点:
分子、原子比较
原子是化学变化中的最小粒子。
分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
水分子
氢分子
氧分子
+
不同点:
在化学变化中:
分解 重新聚合 聚集成
分子 原子 新分子 新物质
化学变化的实质:
在化学变化中,分子分成原子,原子又重新组合成新的分子。
本质区别:变化前后有无其他物质生成
1
物理变化时,分子本身没有变化,只是分子间的间隔变了,
2
化学变化中分子改变。
3
区分物理变化和化学变化
原子的构成
原 子
电 子
原子核
质 子
中 子
(带正电)
(不带电)
(带负电)
(带正电)
(不带电)
原子的结构
注意:相对原子质量只是一个比值,不是原子的实际质量。单位为1。
2、相对原子质量=
某原子的质量
碳原子的质量x1/12
1、国际上规定:以一种碳原子质量的1/12作为标准,其他原子的
质量跟它比较所得的数值。
相对原子质量
电子层符号
K L M N O P Q
电子层序数(n)
1 2 3 4 5 6 7
电子离核的距离
近
远
电子具有的能量
低
高
核外电子的分层排布(又叫分层运动)
能量低的在离核近的区域运动,能量高的在离核远的区域运动。
核外电子分层排布示意图
+11
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
质子数带正电
“+”表示
最外层电子数
数字1也可以表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
原子结构示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种图形。
元素分类 电子数 化学反应中得失电子的情况
金属元素 最外层一般少于4个 易失去最外层电子而达稳定结构
非金属元素 一般等于或多于4个 易得到电子而达稳定结构
稀有气体
元素 8个(氦为2个) 不易失去也不易得到电子
元素的性质与原子核外最外层电子数的关系
【结论】元素的性质,特别是化学性质与原子最外层电子有密切关系。
结构
性质
决定
例如
阳离子:带正电荷的原子或原子团。
阴离子:带负电荷的原子或原子团。
先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面
2Mg2+
定义
带电荷的原子或原子团叫做离子。
分类
写法
离子符号意义
表示每个镁离子带2个单位的正电荷
表示2个镁离子
练一练
1、下列物质中存在氧分子的是( )
A.高锰酸钾
B.液态氧
C.空气
D.双氧水
2、电解水的反应中没有发生变化的粒子是( )
A.氢原子
B.水分子
C.氧原子
D 氧分子
B
AC
3、下列有关原子、分子的说法错误的是 ( )
A.原子、分子都是构成物质的微粒
B.原子、分子总是在不断地运动
C.分子可以再分,原子不能再分
D.分子间有一定的间隔
C
4、如图是某元素的原子结构示意图。下列说法不正确的( )
A.该原子的质子数为12
B.该原子的核外有三个电子层
C.该原子的核外电子数为12
D.该原子在化学反应中容易得到2个电子
D
分子
物质
原子
离子
结合
得、失电子
失、得电子
分解
1、同步练习:
2、预习作业:
(1)净化水的基本方法有哪些?
(2)水的电解现象是什么?单质和化合物的区别有哪些?
(1)元素种类的是 ( )
A.电子数 B.质子数 C.中子数 D.最外层电子数
(2)下列各种物质中,由离子构成的是( )
A.Fe B.H2O C.NaCl D.CO2
B
C
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
