北京课改版化学九年级上册期中复习课件下(共43张PPT)
文档属性
| 名称 | 北京课改版化学九年级上册期中复习课件下(共43张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 890.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 00:00:00 | ||
图片预览







文档简介
(共43张PPT)
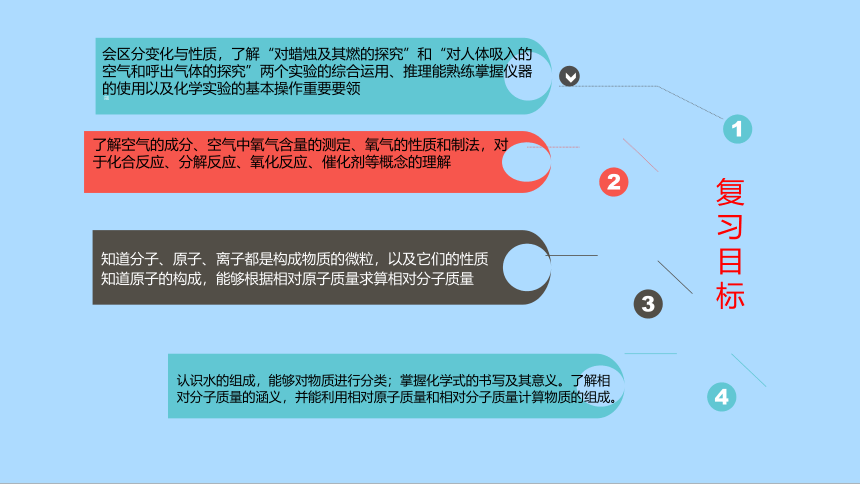
期中复习
九年级
了解空气的成分、空气中氧气含量的测定、氧气的性质和制法,对
于化合反应、分解反应、氧化反应、催化剂等概念的理解
2
知道分子、原子、离子都是构成物质的微粒,以及它们的性质
知道原子的构成,能够根据相对原子质量求算相对分子质量
3
认识水的组成,能够对物质进行分类;掌握化学式的书写及其意义。了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成。
4
复习目标
能
会区分变化与性质,了解“对蜡烛及其燃的探究”和“对人体吸入的空气和呼出气体的探究”两个实验的综合运用、推理能熟练掌握仪器的使用以及化学实验的基本操作重要要领
1
1、分子-----分子是一种保特物质化学性质的最小粒子。
2、原子----化学变化中最小的粒子
3、离子就是带电的原子或原子团。是原子得失电子而形成一种的粒子。跟原子、分子一样,离子也是构成物质的一种粒子。
分子、原子、离子的区别和联系
【第3章:构成物质的微粒】
知识梳理
4、分子、原子的区别
(1)分子与原子的主要区别:分子在化学变化中可分,而原子不可分
(2)分子由原子构成
(3)分子—是保持物质化学性质的最小粒子(注意只能保持化学性质)
(4)原子—是化学变化中的最小微粒。最小指在化学反应中不能再分。
即在化学变化中原物质的分子分解原子重新组合新物质的分子
原子
阳离子(+)
阴离子(-)
失电子
得电子
失电子
得电子
原子中:质子数=电子数(原子不带电)
阳离子中:质子数>电子数(带正电)
阴离子中:质子数<电子数(带负电)
5、原子和离子的区别和联系
01
02
03
1、分子的表示方法:用化学式表示, 例如:水分子--H2O,氧分子--O2,等。
2、原子的表示方法:用元素符号表示, 例如:氧原子 --O,氢原子--H等。
3、离子符号表示方法:先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面,例如:镁离子--Mg2+ ,氯离子--Cl-等。
分子、原子、离子的化学表示方法
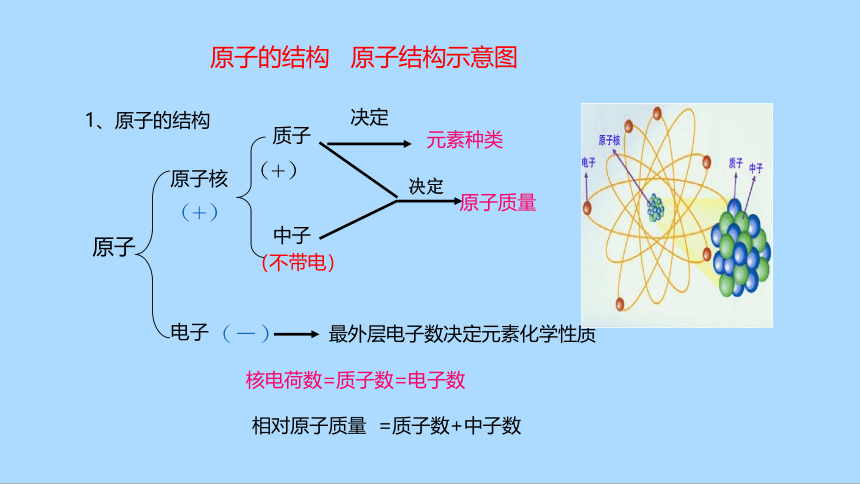
原子核
电子
质子
中子
决定
元素种类
最外层电子数决定元素化学性质
决定
原子质量
(+)
(-)
(+)
(不带电)
核电荷数=质子数=电子数
相对原子质量 =质子数+中子数
原子
1、原子的结构
原子的结构 原子结构示意图
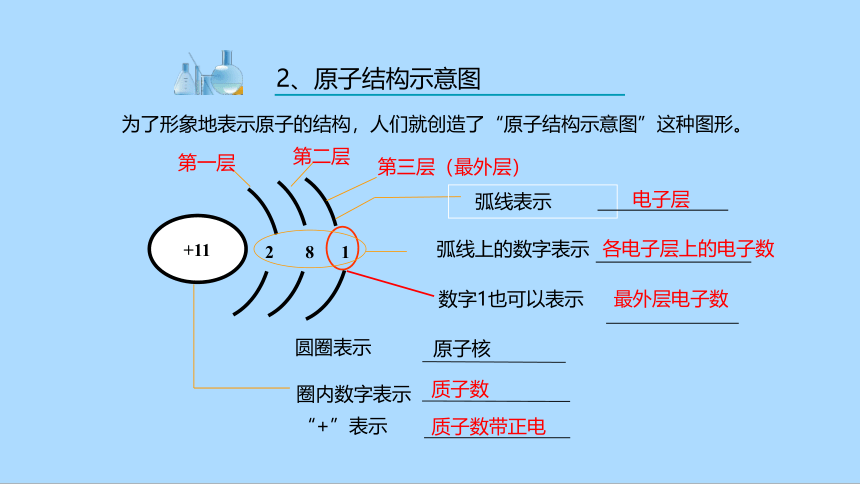
+11
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
质子数带正电
“+”表示
最外层电子数
数字1也可以表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
2、原子结构示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种图形。
注意:相对原子质量只是一个比值,不是原子的实际质量。单位为1。
2、相对原子质量=
某原子的质量
碳原子的质量x1/12
1、国际上规定:以一种碳原子质量的1/12作为标准,其他原子的
质量跟它比较所得的数值。
3、相对原子质量
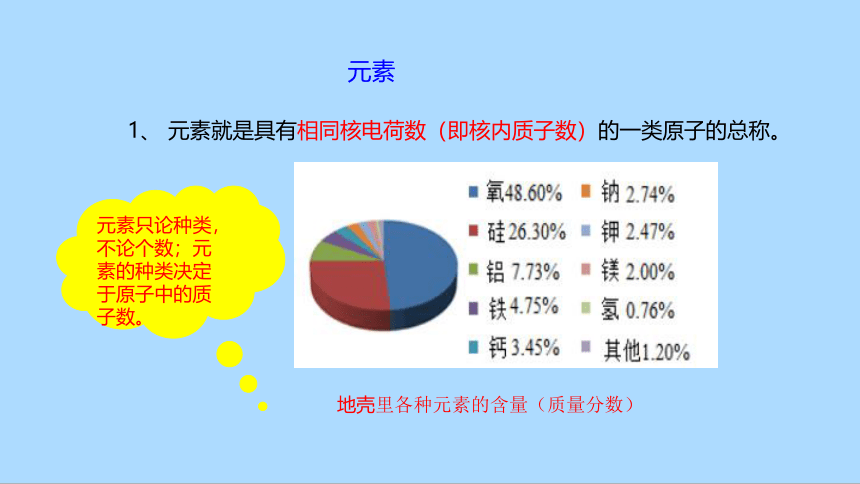
1、 元素就是具有相同核电荷数(即核内质子数)的一类原子的总称。
地壳里各种元素的含量(质量分数)
元素只论种类,不论个数;元素的种类决定于原子中的质子数。
元素
元素分类 电子数 化学反应中得失电子的情况
金属元素 最外层一般少于4个 易失去最外层电子而达稳定结构
非金属元素 一般等于或多于4个 易得到电子而达稳定结构
稀有气体 元素 8个(氦为2个) 不易失去也不易得到电子
2、元素的性质与原子核外最外层电子数的关系
【结论】元素的性质,特别是化学性质与原子最外层电子有密切关系。
结构
性质
决定
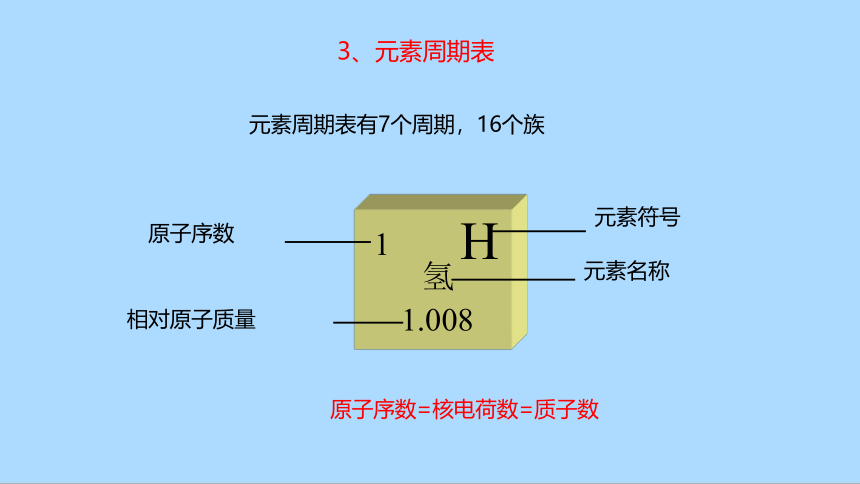
3、元素周期表
H
1
氢
1.008
元素符号
原子序数
元素名称
相对原子质量
元素周期表有7个周期,16个族
原子序数=核电荷数=质子数
自来水厂净水过程示意图
除去不溶性杂质
用活性炭,除去异味、颜色和一部分不溶性杂质
用消毒剂,除去水中的细菌,病毒
一般加入明矾,吸
附水中悬浮的杂质
使大颗粒的固体杂质沉降
【第4章:最常见的液体——水】
一、水的几个主要净化过程
沉淀——加絮凝剂(明矾),使杂质沉降下来。
明矾作用:溶于水后生成的胶状物对杂质有吸附作用。
过滤——通过过滤器,分离液体与不溶性物质的方法。
操作要点:一贴 二低 三靠。
吸附——加入活性炭,滤去液体中的不溶性物质,还可吸
附掉一些溶解的杂质,除去臭味。
【水的净化】
蒸馏---分离液体中少量的杂质,或利用液体中沸点的不同,使液体分离的一种方法
固体
过滤的操作要点:
一贴
滤纸要紧贴漏斗的内壁。
滤纸的边缘要低于漏斗口
液面要低于滤纸的边缘
烧杯口要紧靠玻璃棒
过滤
漏斗的下端要紧靠烧杯内壁
玻璃棒的下端要靠在三层滤纸的一边
二低
过滤可以分离 与 的混合物
液体
三靠
玻璃棒的作用:引流,防止液体冲破滤纸或溅出。
1、硬水和软水的定义:
硬水:含有较多可溶性钙、镁化合物的水。
软水:不含或含较少可溶性钙、镁化合物的水。
二、、硬水和软水
2、硬水和软水的检验:
种类 软水 硬水
现象
结论 有大量泡沫 无浮渣
泡沫少 有大量浮渣
可用肥皂水来区别硬水和软水
软水
硬水
3、硬水软化的方法:
生活中常用煮沸的方法降低水的硬度
实验室常用蒸馏的方法得到蒸馏水以降低水的硬度
蒸馏是指 给液体加热,使它变为蒸气,再使蒸气冷却,凝聚成液体,
【水的组成】
水电解现象
接负极:生成气泡
接正极:生成气泡
H2的体积 : O2的体积 = 2 : 1
(能燃烧,产生淡蓝色火焰-H2)
(使带火星的木条复燃- O2 )
重点考点:
电解水实验要点:
1、通直流电。
2、正极气体少,是氧气;
负极气体多,是氢气。V正:V负=1:2
3、水电解是化学变化
4、实验结论:
水是由氢元素和氧元素组成的
5、该反应文字表达式:
水 通电 氢气 + 氧气
物 质
混合物:矿泉水 空气
化合物:
单质:氧气,氮气,硫粉
纯净物:由一种物质组成
二氧化碳,蒸馏水,
氯化钾、高锰酸钾
氧化物
二氧化碳
蒸馏水
四氧化三铁
2、化学式的意义
某种物质
某种物质的组成
某种物质的一个粒子
某种物质一个粒子的构成
【化学式与化合价】
1、化学式的定义:元素符号不仅可以表示元素,还可以表示由 元素组成的物质。这种用元素符号和数字的组合表示物质组成的式子,叫做化学式。
从化学式中能够得到哪些信息——化学式所表示的意义
H2O
(1)表示水这种物质
(2)表示水是由氢、氧两种元素组成的
O
H
H
(3)表示一个水分子
(4)表示一个水分子由2个氢原子和1个氧原子构成
以“H2O”为例
区别符号前面的数字和右下角的数字的意义。
符号前面的数字:表示微粒的个数,可以改变。若在元素前面表示原子个数;若在化学式前面表示分子个数。
符号右下角的数字:表示一个分子中原子的个数,不能变动。
H 2H H2 2H2 2H+
表示微粒的个数
表示分子中原子的个数
符号右上角的数字:表示一个离子中所带电荷数,不能变
3、化学式的写法与读法
稀有气体单质:
He Ne Ar
金属单质:
Cu Fe Hg Mg
非金属固态单质:
C P S Si
非金属气体:
H2 O2 N2 Cl2
直接用元素符号表示化学式
用元素符号及其右下角的数字表示[ Xn ]
读元素符号的名称
读“某气”
单
质
元素符号右下角数字[n]是表示分子中所含这种原子的个数
化合物
氧化物的化学式:
如:CO2 SO2 P2O5 Fe3O4 MnO2
写法:氧元素在后,另一种元素在前
读法:氧化某或几氧化几某(几代表数字)
金属元素和非金属组成的化合物:
如:NaCl KCl HgO MgO
写法:金属元素在前,非金属元素在后
读法:某(非金属)化某(金属)或几某化几某
化合物化学式小结: 原则:顺写反读
读作:某化某
注:原子个数为1
省略不写
化学上用化合价来表示原子之间相互化合的数目。
1、化学价有正价和负价。金属元素跟非金属元素化合时,金属
元素显正价,非金属元素显负价。
2、在化合物里正负化合价的代数和为0。
3、元素的化合价是元素的原子在形成化合物时表现出来的一种
性质,因此,在单质分子里,元素的化合价为0。
有一些物质,如Ca(OH)2、CaCO3等,它们中的一些原子集团,
如OH、CO3常作为一个整体参加反应,这样的原子集团,叫做原子
团,又叫做根。根也有化合价,如OH为负-1价。
例题:已知磷为+5价,氧为-2价,写出磷的这种化合物的化学式
解:
1.写出组成的元素:正价在前,负价在后,
2.求正负化合价绝对值的最小公倍数→
3.求各元素的原子数:最小公倍数/正价数(或负价数)=原子个数
4.原子个数写在元素符号右下角:→
5.检查正误:正负化合价代数和=0 →
P O
5×2=10
P:10/5=2 O:10/2=5
P2O5
+5×2+(-2)×5=0
根据化合价推写化学式(最小公倍数法)
+5 -2
⑴检验化学式的正误;
⑵根据化学式判断元素的化合价;
⑶根据元素的化合价推求实际存在物质的化学式。
判断依据:化合物中正负化合价之和等于零。
化合价的应用
有关计算化学式的计算
一定量的物质中某元素的质量=该物质的质量×该元素的质量分数。
难点突破
1、如图所示下列实验基本操作中,正确的是( )
【分析】①把试管放入桌面,用手拿橡皮塞硬往试管口按,易使试管压破;②加热试管内液体,所用火焰位置不规范,且管口不要冲着自己;③往试管内加固体药品时,先使试管横放,用药匙将药品送入试管底部;④往试管内倾倒液体时,试管要略微倾斜,瓶口紧挨着试管口,故选B。
A.①②③④ B.②③ C.③ D.②③④
B
2、以下是化学实验室内几种常用的实验装置,请回答:
3、检验A试管内的气体的方法是_____________________
4、检验B试管内的气体的方法是_____________________
5、通过电解水的实验,可以得到的结论是:
燃着的火焰接近气体,用若气体能燃烧火焰且呈淡蓝色,说明是氢气。
用带火星的木条接近气体,若木条复燃,说明是氧气
水电解产生氢气和氧气,水是由氢元素和氧元素组成的
A
B
3、右图是通电分解水的实验装置图,试回答下列问题:
(1)、电解水时常加入少量氢氧化钠或硫酸,
其目的是___________________________。
(2)、根据图可知:A试管内收集到的气体是
_______,B试管内收集到气体是_______。
增强水的导电性
氢气
氧气
(3)、检验A试管内的气体的方法是_____________________
(4)、检验B试管内的气体的方法是_____________________
(5)、通过电解水的实验,可以得到的结论是:
燃着的火焰接近气体,用若气体能燃烧火焰且呈淡蓝色,说明是氢气。
用带火星的木条接近气体,若木条复燃,说明是氧气
水电解产生氢气和氧气,水是由氢元素和氧元素组成的
4、下列有关原子、分子的说法错误的是 ( )
A.原子、分子都是构成物质的微粒
B.原子、分子总是在不断地运动
C.分子可以再分,原子不能再分
D.分子间有一定的间隔
C
5、如图是某元素的原子结构示意图。下列说法不正确的( )
A.该原子的质子数为12
B.该原子的核外有三个电子层
C.该原子的核外电子数为12
D.该原子在化学反应中容易得到2个电子
D
6、维生素C(化学式C6H8O6)能促进人体生长发育,增强人体对疾病的抵抗力。求:
(1)维生素C的相对分子质量是多少?
(2)求维生素C中,碳、氧、氢三种元素质量比.
(3)求88g维生素C中氢元素的质量.
解:(1)维生素C(化学式C6H8O6)的相对分子质量为6×12+8×1+6×16=176.
(2)维生素C(化学式C6H8O6)中碳、氧、氢三种元素质量比为(12×6):(16×6):8=9:12:1.
(3)88g维生素C(化学式C6H8O6)中氢元素的质量为88g×1×8
176
×100%=4g;
本题考查学生利用化学式进行相对分子质量、元素的质量比、元素的质量分数进行计算的能力!
、
会区分变化与性质,了解“对蜡烛及其燃的探究”和“对人体吸入的空气和呼出气体的探究”两个实验、熟练掌握仪器的使用以及化学实验的基本操作重要要领。
知
了解空气的成分、空气中氧气含量的测定、氧气的性质和制法,对于化合反应、分解反应、氧化反应、催化剂等概念的理解
期中复习要点
本课小结
了解分子、原子、离子都是构成物质的微粒,以及它们的性质,了解原子的构成,能够根据相对原子质量求算相对分子质量
认识水的组成,能够对物质进行分类;掌握化学式的书写及其意义,掌握化学式的相关计算。
作业布置
1.实验室制取氧气时,装药品的大试管口应 ( )
A.朝下 B.朝上 C.略向下倾斜 D.略向上倾斜
2.下面所列各项中,与元素的化学性质的关系最为密切的是( )
A.元素的相对原子质量 B.元素的核电荷数
C.原子的核外电子数 D.原子的最外层电子数
3.下列是某同学进行过滤操作时的一些做法,其中错误的是( )
A.让滤纸边缘低于漏斗口 B.直接向漏斗中倾倒待过滤的液体
C.让漏斗下端管口紧靠烧杯内壁 D.让漏斗中液面始终低于滤纸边缘
预习作业:
1.质量守恒定律的内容?
2.如何正确书写化学方程式?
3.会根据化学方程式进行简单计算。
期中复习
九年级
了解空气的成分、空气中氧气含量的测定、氧气的性质和制法,对
于化合反应、分解反应、氧化反应、催化剂等概念的理解
2
知道分子、原子、离子都是构成物质的微粒,以及它们的性质
知道原子的构成,能够根据相对原子质量求算相对分子质量
3
认识水的组成,能够对物质进行分类;掌握化学式的书写及其意义。了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成。
4
复习目标
能
会区分变化与性质,了解“对蜡烛及其燃的探究”和“对人体吸入的空气和呼出气体的探究”两个实验的综合运用、推理能熟练掌握仪器的使用以及化学实验的基本操作重要要领
1
1、分子-----分子是一种保特物质化学性质的最小粒子。
2、原子----化学变化中最小的粒子
3、离子就是带电的原子或原子团。是原子得失电子而形成一种的粒子。跟原子、分子一样,离子也是构成物质的一种粒子。
分子、原子、离子的区别和联系
【第3章:构成物质的微粒】
知识梳理
4、分子、原子的区别
(1)分子与原子的主要区别:分子在化学变化中可分,而原子不可分
(2)分子由原子构成
(3)分子—是保持物质化学性质的最小粒子(注意只能保持化学性质)
(4)原子—是化学变化中的最小微粒。最小指在化学反应中不能再分。
即在化学变化中原物质的分子分解原子重新组合新物质的分子
原子
阳离子(+)
阴离子(-)
失电子
得电子
失电子
得电子
原子中:质子数=电子数(原子不带电)
阳离子中:质子数>电子数(带正电)
阴离子中:质子数<电子数(带负电)
5、原子和离子的区别和联系
01
02
03
1、分子的表示方法:用化学式表示, 例如:水分子--H2O,氧分子--O2,等。
2、原子的表示方法:用元素符号表示, 例如:氧原子 --O,氢原子--H等。
3、离子符号表示方法:先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面,例如:镁离子--Mg2+ ,氯离子--Cl-等。
分子、原子、离子的化学表示方法
原子核
电子
质子
中子
决定
元素种类
最外层电子数决定元素化学性质
决定
原子质量
(+)
(-)
(+)
(不带电)
核电荷数=质子数=电子数
相对原子质量 =质子数+中子数
原子
1、原子的结构
原子的结构 原子结构示意图
+11
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
质子数带正电
“+”表示
最外层电子数
数字1也可以表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
2、原子结构示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种图形。
注意:相对原子质量只是一个比值,不是原子的实际质量。单位为1。
2、相对原子质量=
某原子的质量
碳原子的质量x1/12
1、国际上规定:以一种碳原子质量的1/12作为标准,其他原子的
质量跟它比较所得的数值。
3、相对原子质量
1、 元素就是具有相同核电荷数(即核内质子数)的一类原子的总称。
地壳里各种元素的含量(质量分数)
元素只论种类,不论个数;元素的种类决定于原子中的质子数。
元素
元素分类 电子数 化学反应中得失电子的情况
金属元素 最外层一般少于4个 易失去最外层电子而达稳定结构
非金属元素 一般等于或多于4个 易得到电子而达稳定结构
稀有气体 元素 8个(氦为2个) 不易失去也不易得到电子
2、元素的性质与原子核外最外层电子数的关系
【结论】元素的性质,特别是化学性质与原子最外层电子有密切关系。
结构
性质
决定
3、元素周期表
H
1
氢
1.008
元素符号
原子序数
元素名称
相对原子质量
元素周期表有7个周期,16个族
原子序数=核电荷数=质子数
自来水厂净水过程示意图
除去不溶性杂质
用活性炭,除去异味、颜色和一部分不溶性杂质
用消毒剂,除去水中的细菌,病毒
一般加入明矾,吸
附水中悬浮的杂质
使大颗粒的固体杂质沉降
【第4章:最常见的液体——水】
一、水的几个主要净化过程
沉淀——加絮凝剂(明矾),使杂质沉降下来。
明矾作用:溶于水后生成的胶状物对杂质有吸附作用。
过滤——通过过滤器,分离液体与不溶性物质的方法。
操作要点:一贴 二低 三靠。
吸附——加入活性炭,滤去液体中的不溶性物质,还可吸
附掉一些溶解的杂质,除去臭味。
【水的净化】
蒸馏---分离液体中少量的杂质,或利用液体中沸点的不同,使液体分离的一种方法
固体
过滤的操作要点:
一贴
滤纸要紧贴漏斗的内壁。
滤纸的边缘要低于漏斗口
液面要低于滤纸的边缘
烧杯口要紧靠玻璃棒
过滤
漏斗的下端要紧靠烧杯内壁
玻璃棒的下端要靠在三层滤纸的一边
二低
过滤可以分离 与 的混合物
液体
三靠
玻璃棒的作用:引流,防止液体冲破滤纸或溅出。
1、硬水和软水的定义:
硬水:含有较多可溶性钙、镁化合物的水。
软水:不含或含较少可溶性钙、镁化合物的水。
二、、硬水和软水
2、硬水和软水的检验:
种类 软水 硬水
现象
结论 有大量泡沫 无浮渣
泡沫少 有大量浮渣
可用肥皂水来区别硬水和软水
软水
硬水
3、硬水软化的方法:
生活中常用煮沸的方法降低水的硬度
实验室常用蒸馏的方法得到蒸馏水以降低水的硬度
蒸馏是指 给液体加热,使它变为蒸气,再使蒸气冷却,凝聚成液体,
【水的组成】
水电解现象
接负极:生成气泡
接正极:生成气泡
H2的体积 : O2的体积 = 2 : 1
(能燃烧,产生淡蓝色火焰-H2)
(使带火星的木条复燃- O2 )
重点考点:
电解水实验要点:
1、通直流电。
2、正极气体少,是氧气;
负极气体多,是氢气。V正:V负=1:2
3、水电解是化学变化
4、实验结论:
水是由氢元素和氧元素组成的
5、该反应文字表达式:
水 通电 氢气 + 氧气
物 质
混合物:矿泉水 空气
化合物:
单质:氧气,氮气,硫粉
纯净物:由一种物质组成
二氧化碳,蒸馏水,
氯化钾、高锰酸钾
氧化物
二氧化碳
蒸馏水
四氧化三铁
2、化学式的意义
某种物质
某种物质的组成
某种物质的一个粒子
某种物质一个粒子的构成
【化学式与化合价】
1、化学式的定义:元素符号不仅可以表示元素,还可以表示由 元素组成的物质。这种用元素符号和数字的组合表示物质组成的式子,叫做化学式。
从化学式中能够得到哪些信息——化学式所表示的意义
H2O
(1)表示水这种物质
(2)表示水是由氢、氧两种元素组成的
O
H
H
(3)表示一个水分子
(4)表示一个水分子由2个氢原子和1个氧原子构成
以“H2O”为例
区别符号前面的数字和右下角的数字的意义。
符号前面的数字:表示微粒的个数,可以改变。若在元素前面表示原子个数;若在化学式前面表示分子个数。
符号右下角的数字:表示一个分子中原子的个数,不能变动。
H 2H H2 2H2 2H+
表示微粒的个数
表示分子中原子的个数
符号右上角的数字:表示一个离子中所带电荷数,不能变
3、化学式的写法与读法
稀有气体单质:
He Ne Ar
金属单质:
Cu Fe Hg Mg
非金属固态单质:
C P S Si
非金属气体:
H2 O2 N2 Cl2
直接用元素符号表示化学式
用元素符号及其右下角的数字表示[ Xn ]
读元素符号的名称
读“某气”
单
质
元素符号右下角数字[n]是表示分子中所含这种原子的个数
化合物
氧化物的化学式:
如:CO2 SO2 P2O5 Fe3O4 MnO2
写法:氧元素在后,另一种元素在前
读法:氧化某或几氧化几某(几代表数字)
金属元素和非金属组成的化合物:
如:NaCl KCl HgO MgO
写法:金属元素在前,非金属元素在后
读法:某(非金属)化某(金属)或几某化几某
化合物化学式小结: 原则:顺写反读
读作:某化某
注:原子个数为1
省略不写
化学上用化合价来表示原子之间相互化合的数目。
1、化学价有正价和负价。金属元素跟非金属元素化合时,金属
元素显正价,非金属元素显负价。
2、在化合物里正负化合价的代数和为0。
3、元素的化合价是元素的原子在形成化合物时表现出来的一种
性质,因此,在单质分子里,元素的化合价为0。
有一些物质,如Ca(OH)2、CaCO3等,它们中的一些原子集团,
如OH、CO3常作为一个整体参加反应,这样的原子集团,叫做原子
团,又叫做根。根也有化合价,如OH为负-1价。
例题:已知磷为+5价,氧为-2价,写出磷的这种化合物的化学式
解:
1.写出组成的元素:正价在前,负价在后,
2.求正负化合价绝对值的最小公倍数→
3.求各元素的原子数:最小公倍数/正价数(或负价数)=原子个数
4.原子个数写在元素符号右下角:→
5.检查正误:正负化合价代数和=0 →
P O
5×2=10
P:10/5=2 O:10/2=5
P2O5
+5×2+(-2)×5=0
根据化合价推写化学式(最小公倍数法)
+5 -2
⑴检验化学式的正误;
⑵根据化学式判断元素的化合价;
⑶根据元素的化合价推求实际存在物质的化学式。
判断依据:化合物中正负化合价之和等于零。
化合价的应用
有关计算化学式的计算
一定量的物质中某元素的质量=该物质的质量×该元素的质量分数。
难点突破
1、如图所示下列实验基本操作中,正确的是( )
【分析】①把试管放入桌面,用手拿橡皮塞硬往试管口按,易使试管压破;②加热试管内液体,所用火焰位置不规范,且管口不要冲着自己;③往试管内加固体药品时,先使试管横放,用药匙将药品送入试管底部;④往试管内倾倒液体时,试管要略微倾斜,瓶口紧挨着试管口,故选B。
A.①②③④ B.②③ C.③ D.②③④
B
2、以下是化学实验室内几种常用的实验装置,请回答:
3、检验A试管内的气体的方法是_____________________
4、检验B试管内的气体的方法是_____________________
5、通过电解水的实验,可以得到的结论是:
燃着的火焰接近气体,用若气体能燃烧火焰且呈淡蓝色,说明是氢气。
用带火星的木条接近气体,若木条复燃,说明是氧气
水电解产生氢气和氧气,水是由氢元素和氧元素组成的
A
B
3、右图是通电分解水的实验装置图,试回答下列问题:
(1)、电解水时常加入少量氢氧化钠或硫酸,
其目的是___________________________。
(2)、根据图可知:A试管内收集到的气体是
_______,B试管内收集到气体是_______。
增强水的导电性
氢气
氧气
(3)、检验A试管内的气体的方法是_____________________
(4)、检验B试管内的气体的方法是_____________________
(5)、通过电解水的实验,可以得到的结论是:
燃着的火焰接近气体,用若气体能燃烧火焰且呈淡蓝色,说明是氢气。
用带火星的木条接近气体,若木条复燃,说明是氧气
水电解产生氢气和氧气,水是由氢元素和氧元素组成的
4、下列有关原子、分子的说法错误的是 ( )
A.原子、分子都是构成物质的微粒
B.原子、分子总是在不断地运动
C.分子可以再分,原子不能再分
D.分子间有一定的间隔
C
5、如图是某元素的原子结构示意图。下列说法不正确的( )
A.该原子的质子数为12
B.该原子的核外有三个电子层
C.该原子的核外电子数为12
D.该原子在化学反应中容易得到2个电子
D
6、维生素C(化学式C6H8O6)能促进人体生长发育,增强人体对疾病的抵抗力。求:
(1)维生素C的相对分子质量是多少?
(2)求维生素C中,碳、氧、氢三种元素质量比.
(3)求88g维生素C中氢元素的质量.
解:(1)维生素C(化学式C6H8O6)的相对分子质量为6×12+8×1+6×16=176.
(2)维生素C(化学式C6H8O6)中碳、氧、氢三种元素质量比为(12×6):(16×6):8=9:12:1.
(3)88g维生素C(化学式C6H8O6)中氢元素的质量为88g×1×8
176
×100%=4g;
本题考查学生利用化学式进行相对分子质量、元素的质量比、元素的质量分数进行计算的能力!
、
会区分变化与性质,了解“对蜡烛及其燃的探究”和“对人体吸入的空气和呼出气体的探究”两个实验、熟练掌握仪器的使用以及化学实验的基本操作重要要领。
知
了解空气的成分、空气中氧气含量的测定、氧气的性质和制法,对于化合反应、分解反应、氧化反应、催化剂等概念的理解
期中复习要点
本课小结
了解分子、原子、离子都是构成物质的微粒,以及它们的性质,了解原子的构成,能够根据相对原子质量求算相对分子质量
认识水的组成,能够对物质进行分类;掌握化学式的书写及其意义,掌握化学式的相关计算。
作业布置
1.实验室制取氧气时,装药品的大试管口应 ( )
A.朝下 B.朝上 C.略向下倾斜 D.略向上倾斜
2.下面所列各项中,与元素的化学性质的关系最为密切的是( )
A.元素的相对原子质量 B.元素的核电荷数
C.原子的核外电子数 D.原子的最外层电子数
3.下列是某同学进行过滤操作时的一些做法,其中错误的是( )
A.让滤纸边缘低于漏斗口 B.直接向漏斗中倾倒待过滤的液体
C.让漏斗下端管口紧靠烧杯内壁 D.让漏斗中液面始终低于滤纸边缘
预习作业:
1.质量守恒定律的内容?
2.如何正确书写化学方程式?
3.会根据化学方程式进行简单计算。
同课章节目录
