鲁科版必修1第四章复习学案
图片预览



文档简介
第四章 材料家族中的元素 复习学案
第一节 硅 无机非金属材料
【基础知识】
一、硅 硅元素在自然界以SiO2及硅酸盐的形式存在.
1、物理性质: 晶体硅是有金属光泽的灰黑色固体,熔点高、硬度大、有脆性,导电性介于导体和绝缘体之间,是良好的半导体材料,可制成光电池等.
2、化学性质:
在常温下,硅的化学性质不活泼,除氢氟酸和强碱溶液外,不易与其他物质如氢气、氧气、氯气、硫酸、硝酸等反应。写出硅参与的反应的化学方程式
(1)与非金属单质反应
①硅与氟气反应:
________________________________________________________________________
②硅与氯气反应:
________________________________________________________________________
③硅与氧气反应:
________________________________________________________________________
(2)与氢氧化钠溶液反应
化学方程式:_______________________________________________
(3)与氢氟酸反应
化学方程式:________________________________
二、二氧化硅 1、物理性质:熔点高,硬度大,不溶于水。
2、化学性质:酸性氧化物(能与碱反应生成盐和水的氧化物)
①与水不反应
②与碱反应 (实验室装NaOH的试剂瓶用橡皮塞而不能用玻璃塞)
③与碱性氧化物反应 SiO2+CaOCaSiO3
特殊性质:能与唯一的酸(氢氟酸)反应 SiO2+4HF=SiF4↑+2H2O (玻璃瓶不能装氢氟酸)
三、硅酸 硅酸是一种不溶于水的白色胶状沉淀,弱酸性,酸性比H2CO3还弱。
思考:向Na2SiO3溶液中通入CO2气体有何现象:
实验室用可溶性硅酸盐与盐酸反应制备硅酸胶体:Na2SiO3+2HCl=H2SiO3(胶 体) 四、硅酸盐与无机非金属材料
1. 用氧化物的形式表示下列硅酸盐的组成:(如硅酸钠Na2SiO3表示成Na2O·SiO2)
1 硅酸钙:CaSiO3
2 高岭石:Al2(Si2O5)(OH)4
3 钠长石:NaAlSi3O8 。
2. 玻璃工业:
(1)制造普通玻璃的主要原料是 。
(2)制造玻璃的设备为 。
(3)制造玻璃的反应原理:
,
(4)普通玻璃的主要成分: 。
(5)玻璃的特点: 。
3. 水泥工业:以_ _和_ _为主要原料,经研磨、混合在 设备中煅烧,就得到普通的硅酸盐水泥。
(1)普通水泥的主要成分: 。
(2)水泥的特点: 。
(3)混凝土是指 。
4. 几种新型的无机非金属材料
(1)高温结构陶瓷:包括 。
(2)生物陶瓷:特点: 。
(3)压电陶瓷:具有 的陶瓷称为压电陶瓷,目前广泛应用的压电陶瓷主要成分为 。
压电陶瓷特点: 。压电陶瓷常用于 。五、认识复合材料
1、传统无机非金属材料的基本特征_________、_________、_______ ____,
新型无机非金属材料则具有_______._________。金属材料分为__________.,______________两大类。
2、复合材料是_____________________________________________________ 复合材料有两部分组成,一部分为_______,起_______作用;另一部分称为_________,起________作用。
3、合成树脂属于_________化合物,熔点_________._______导电、________熔化、水溶性_______、能溶于________._________有机溶剂。
复合材料 基体 增强体 主要性能
玻璃钢 合成树脂 玻璃纤维 强度高.密度小.耐化学腐蚀.绝缘性和机械加工性能好
碳纤维增强复合材料 合成树脂 碳纤维 韧性好.强度高.质轻
航空复合材料 金属 碳纤维.硼纤维.碳化硅纤维和氧化铝纤维等 耐高温..强度高.导电性好.不吸湿和不易老化
航天复合材料 陶瓷 碳纤维.碳化硅纤维.氧化硅纤维 耐高温,韧性强
【典型题目训练】
1.下列叙述正确的是 ( )
A.硝酸具有氧化性 B.光导纤维的主要成分是硅酸盐
C.次氯酸是一种强酸 D.钠的焰色为浅紫色
2.下列物质中,主要成分属于硅酸盐的是( )
A.烧碱 B.水泥 C.石灰石 D.胆矾
3.下列用于制造光导纤维的是( )
A.金刚石 B.大理石 C.铝合金 D.二氧化硅
4.下列物质中主要成分是硅酸盐的是( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
5.制备单质硅时,主要化学反应如下:① ② ③,下列对上述三个反应的叙述中,不正确的是( )
A. ①③为置换反应 B. ①②③均为氧化还原反应
C. ②为化合反应 D. 三个反应的反应物中硅元素均被氧化
6.在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为 ( )
A.36∶30 B.60∶36 C.2∶1 D.1∶2
7.实验室中盛放碱液的试剂瓶不能用玻璃塞,是因为(用化学方程式表示)___________________________。
8.普通玻璃是由_________________________等物质组成的
9.生产玻璃时,石灰石与石英反应的化学方程式为 。
10.玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、 ___________和____________ (填化学式)。
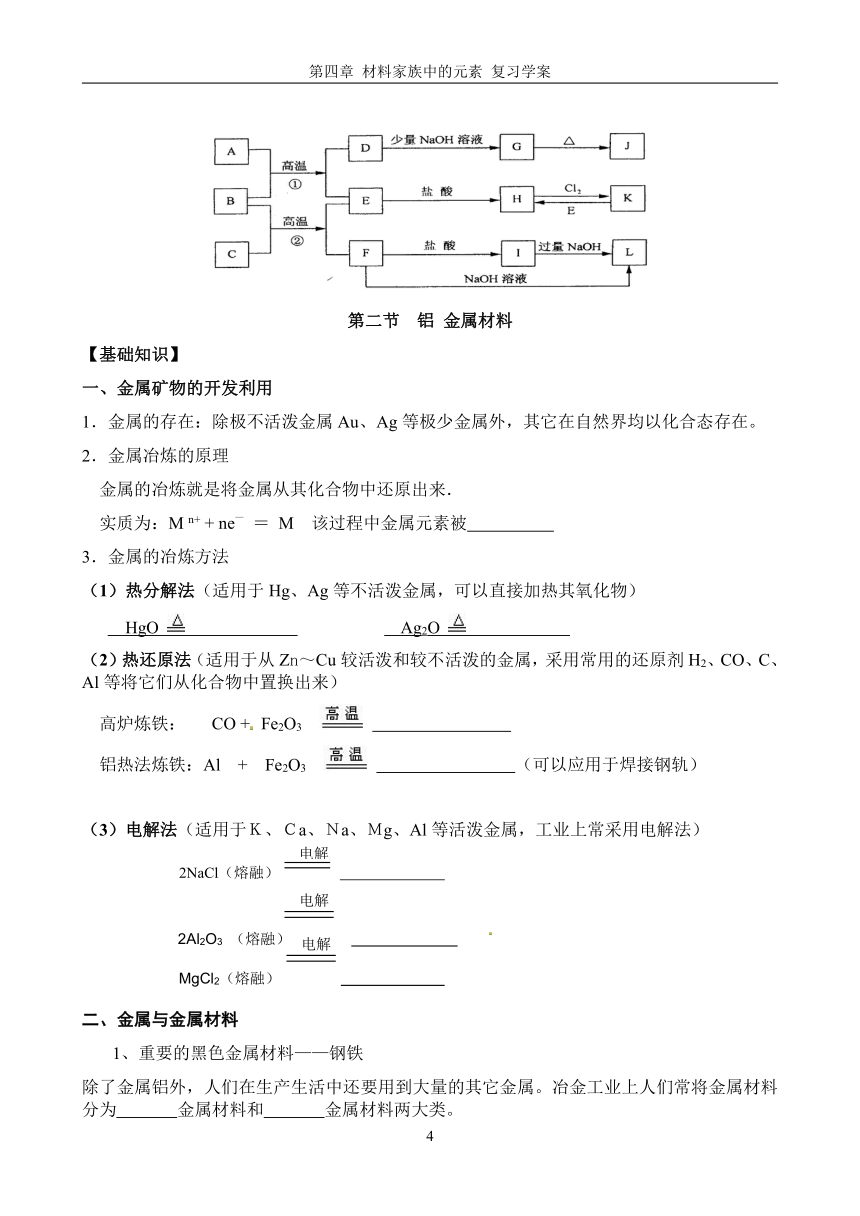
11.下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。请回答下列问题:
(1)D的电子式为___________。
(2)K的化学式为____________。
(3)写出B与C高温反应生成E和F的化学方程式:_________ _____。
(4)写出D与J的稀溶液反应生成G的离子方程式:___________ ___。
第二节 铝 金属材料
【基础知识】
一、金属矿物的开发利用
1.金属的存在:除极不活泼金属Au、Ag等极少金属外,其它在自然界均以化合态存在。
2.金属冶炼的原理
金属的冶炼就是将金属从其化合物中还原出来.
实质为:M n+ + ne— = M 该过程中金属元素被
3.金属的冶炼方法
(1)热分解法(适用于Hg、Ag等不活泼金属,可以直接加热其氧化物)
HgO Ag2O
(2)热还原法(适用于从Zn~Cu较活泼和较不活泼的金属,采用常用的还原剂H2、CO、C、Al等将它们从化合物中置换出来)
高炉炼铁: CO + Fe2O3
铝热法炼铁:Al + Fe2O3 (可以应用于焊接钢轨)
(3)电解法(适用于K、Ca、Na、Mg、Al等活泼金属,工业上常采用电解法)
二、金属与金属材料
1、 重要的黑色金属材料——钢铁
除了金属铝外,人们在生产生活中还要用到大量的其它金属。冶金工业上人们常将金属材料分为 金属材料和 金属材料两大类。
(1) 不锈钢的生产:
(2) 不锈钢的特点:
2、 几种有色金属材料——金、银、铜
(1)金属之最:延展性最好 ;导电导热最好的 ;硬度最大的 ; 熔沸点最高的 ;熔沸点最低的 ;
(2)金的物理性质
银的物理性质
金银的化学性质很稳定,可以被 腐蚀。
(3)铜的物理性质
铜的化学性质:铜绿的形成: 孔雀石分解:
Cu + O2 —— Cu + S ——
CuSO4·5H2O ——
CuO ——
CuSO4—— (4)核电厂金属 ;烟雾检测材料 ;21世纪的金属 ; 亲生物金属 。
三、铝及其化合物 (一).铝
1.存在:地壳中存在最多的金属元素是 。
2.物理性质:铝是 色金属,熔点 沸点 ,密度 ,导电性仅次于 、 、 。
3.化学性质 ①与氧气反应:
②铝与冷水不反应,与热水缓慢反应,一般情况下,铝表面的氧化膜阻止了与水的反应
③与非氧化性酸(盐酸和稀硫酸)反应:
常温下,铝遇浓硫酸、浓硝酸发生钝化现象。
④与强碱反应:
⑤铝热反应:(铝与氧化铁): 可用于焊接铁轨
a、 铝热反应定义:
b、 典型反应为:
c、 该反应属于 ,其中铝属于 剂,氧化铁是 剂。
d、 在该类反应中,铝的还原性大于金属氧化物中金属的还原性,在一定条件下该反应可能发生,这类氧化物还有 等。
e、 镁条的作用: ;氯酸钾的作用: 。
f、 反应现象为:
g、 反应的应用:
(二).铝的氧化物——氧化铝
1.Al2O3 白色难熔,是一种较好的耐火材料.
2. Al2O3 的两性——两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水)
(三). 铝的氢氧化物——氢氧化铝
(1)Al(OH)3的两性——两性氢氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水)
, 。
思考:1.为什么铝制容器不易用来盛放酸、酸梅汤和碱水等物质?为什么铝质器皿不易用沙子和钢丝球擦洗?
思考:2。下列图像哪一个是AlCl3溶液与NaOH溶液反应,哪一个是AlCl3溶液与氨水反应?
(2)Al(OH)3不稳定:
(3)制取:实验室常用铝盐(Al3+)与足量氨水制取Al(OH)3,
反应的离子方程式为:
(四).铝的重要的盐——明矾
明矾:十二水合硫酸铝钾 ,明矾常用作混凝剂,发生的离子方程式为 。
归纳整理:铝及其重要化合物之间的转化关系。
① ;②
③ ;④
⑤ ;⑥
⑦ ;⑧
【典型题目训练】
1.小明家里收藏了一件清代的铝制佛像,该佛像至今仍保存十分完好.该佛像未锈蚀的主要原因是( )
A.铝不易发生化学反应 B.铝的氧化物容易发生还原反应
C.铝不易被氧化 D.铝易氧化,但氧化铝具有保护内部铝的作用
2.实验室需要使AlCl3溶液中的Al3+离了全部沉淀出来,适宜用的试剂是( )
A.NaOH溶液 B.Ba(OH)2溶液 C.盐酸 D.氨水
3.下列离子方程式书写正确的是( )
A.澄清石 灰 水 跟 稀 硝 酸 反 应: Ca(OH)2+2H+=Ca2++2H2O
B.铁粉投入到硫酸铜溶液中:Fe +Cu2+=Fe2+ +Cu
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
D.钠和冷水反应 Na+2H2O=Na++2OH+H2↑
4.用铝热法还原下列物质,制得金属各1摩尔,消耗铝最少的是 ( )
A.MnO2 B.FeO C.Cr2O3 D.V2O5
5. 两份相同质量的铝粉,第一份与足量的氢氧化钠溶液反应,第二份和足量的盐酸反应。产生的气体物质的量( )
A.相等 B. 大于 C. 小于 D.无法确定
6.下列物之间的反应属于铝热反应的是( )
A.Al+HCl B.Al+H2SO4 C.Al+Fe3O4 D.Al+WO3
7.在铝和NaOH溶液的反应中,作为还原剂的是( )
A.水 B.铝 C.氢氧化钠 D.氢氧化钠和水
8.下列用途主要体现铝的物理性质的是( )
①家用铝锅②盛浓硝酸的容器③制导线④焊接钢轨⑤包装铝箔⑥炼钢的脱氧剂⑦做防锈油漆
A.①②③④ B.⑥⑦ C.①③⑤⑦ D.②④⑥
9.(2009年学业水平测试)在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为( )
A.0.225mol/L B.0.25mol/L C.0.45mol/L D.0.9mol/L
10、除去镁粉中混有的少量铝粉,可选用的试剂是( )
A.稀盐酸 B.稀硝酸 C.氢氧化钠溶液 D.硝酸铜溶液
11:把x溶液(或气体)慢慢加入(或通入)到一定量的y溶液中,产生的沉淀量与加入x物质的量的关系如图所示,符合图中曲线的是
A.x为CO2,y为Ca(OH)2 B.x为NH3·H2O,y为AlCl3
C.x为NaOH,y为AlCl3 D.x为HCl,y为Na[Al(OH)]4
12.在铝制易拉罐中收集一满罐CO2,加入过量浓氢氧化钠溶液,立即把口封闭。可以发现易拉罐“咔咔”作响,并变瘪了;过一会儿后,易拉罐又会作响并鼓起来。
(1)罐壁变瘪发生的反应方程式是____ _;
(2)罐再度鼓起发生反应的化学方程式是__ ______。
13、 某无色透明的稀溶液能与铝作用放出氢气,试分析下列离子中:H+、Ba2+、Mg2+、OH-、 SO32-、Cl-、CO32-、NO3-可能有哪些离子大量存在于此溶液中。
第一种情况,该溶液中有_______ _离子,可能有_________ _ 离子;
第二种情况,该溶液中有________ 离子,可能有_______ _离子。
14.钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不和非金属、强酸反应,红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体。该反应的化学方程式为 ,该反应的还原剂是 。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式: ;
(2)简述从上述所得产物中获取金属钛的步骤。
15.某课外活动小组设计了如图所示(夹持装置已略去)的一套装置,用H2和CuO冶炼Cu。准确称取3.180 g CuO放在硬质玻璃管内.已知:CuO—黑色、Cu2O—红色、Cu—红色。
试通过计算回答[①气体体积按标准状况计,②Ar(Cu)=63.5,Ar(O)=16.0,Ar(H)=1.00]:
(1)下列H2球较适合用于本实验的是__________(填选项编号)
A.500 mL H2 球 B.896 mL H2 球 C.1500 mL H2 球
(2)反应至黑色全部变为红色止,测量H2球的体积变为220 mL,固体质量变为2.700 g,碱石灰增重0.540 g。则:
①参加反应的H2的质量为:__________;
②假设红色物质为单一物质,则红色物质的化学式为_______________。
电解
2NaCl(熔融)
电解
①2Al2O3 (熔融)
(电解
乙MgCl2(熔融)
(高温
高温
1
第一节 硅 无机非金属材料
【基础知识】
一、硅 硅元素在自然界以SiO2及硅酸盐的形式存在.
1、物理性质: 晶体硅是有金属光泽的灰黑色固体,熔点高、硬度大、有脆性,导电性介于导体和绝缘体之间,是良好的半导体材料,可制成光电池等.
2、化学性质:
在常温下,硅的化学性质不活泼,除氢氟酸和强碱溶液外,不易与其他物质如氢气、氧气、氯气、硫酸、硝酸等反应。写出硅参与的反应的化学方程式
(1)与非金属单质反应
①硅与氟气反应:
________________________________________________________________________
②硅与氯气反应:
________________________________________________________________________
③硅与氧气反应:
________________________________________________________________________
(2)与氢氧化钠溶液反应
化学方程式:_______________________________________________
(3)与氢氟酸反应
化学方程式:________________________________
二、二氧化硅 1、物理性质:熔点高,硬度大,不溶于水。
2、化学性质:酸性氧化物(能与碱反应生成盐和水的氧化物)
①与水不反应
②与碱反应 (实验室装NaOH的试剂瓶用橡皮塞而不能用玻璃塞)
③与碱性氧化物反应 SiO2+CaOCaSiO3
特殊性质:能与唯一的酸(氢氟酸)反应 SiO2+4HF=SiF4↑+2H2O (玻璃瓶不能装氢氟酸)
三、硅酸 硅酸是一种不溶于水的白色胶状沉淀,弱酸性,酸性比H2CO3还弱。
思考:向Na2SiO3溶液中通入CO2气体有何现象:
实验室用可溶性硅酸盐与盐酸反应制备硅酸胶体:Na2SiO3+2HCl=H2SiO3(胶 体) 四、硅酸盐与无机非金属材料
1. 用氧化物的形式表示下列硅酸盐的组成:(如硅酸钠Na2SiO3表示成Na2O·SiO2)
1 硅酸钙:CaSiO3
2 高岭石:Al2(Si2O5)(OH)4
3 钠长石:NaAlSi3O8 。
2. 玻璃工业:
(1)制造普通玻璃的主要原料是 。
(2)制造玻璃的设备为 。
(3)制造玻璃的反应原理:
,
(4)普通玻璃的主要成分: 。
(5)玻璃的特点: 。
3. 水泥工业:以_ _和_ _为主要原料,经研磨、混合在 设备中煅烧,就得到普通的硅酸盐水泥。
(1)普通水泥的主要成分: 。
(2)水泥的特点: 。
(3)混凝土是指 。
4. 几种新型的无机非金属材料
(1)高温结构陶瓷:包括 。
(2)生物陶瓷:特点: 。
(3)压电陶瓷:具有 的陶瓷称为压电陶瓷,目前广泛应用的压电陶瓷主要成分为 。
压电陶瓷特点: 。压电陶瓷常用于 。五、认识复合材料
1、传统无机非金属材料的基本特征_________、_________、_______ ____,
新型无机非金属材料则具有_______._________。金属材料分为__________.,______________两大类。
2、复合材料是_____________________________________________________ 复合材料有两部分组成,一部分为_______,起_______作用;另一部分称为_________,起________作用。
3、合成树脂属于_________化合物,熔点_________._______导电、________熔化、水溶性_______、能溶于________._________有机溶剂。
复合材料 基体 增强体 主要性能
玻璃钢 合成树脂 玻璃纤维 强度高.密度小.耐化学腐蚀.绝缘性和机械加工性能好
碳纤维增强复合材料 合成树脂 碳纤维 韧性好.强度高.质轻
航空复合材料 金属 碳纤维.硼纤维.碳化硅纤维和氧化铝纤维等 耐高温..强度高.导电性好.不吸湿和不易老化
航天复合材料 陶瓷 碳纤维.碳化硅纤维.氧化硅纤维 耐高温,韧性强
【典型题目训练】
1.下列叙述正确的是 ( )
A.硝酸具有氧化性 B.光导纤维的主要成分是硅酸盐
C.次氯酸是一种强酸 D.钠的焰色为浅紫色
2.下列物质中,主要成分属于硅酸盐的是( )
A.烧碱 B.水泥 C.石灰石 D.胆矾
3.下列用于制造光导纤维的是( )
A.金刚石 B.大理石 C.铝合金 D.二氧化硅
4.下列物质中主要成分是硅酸盐的是( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
5.制备单质硅时,主要化学反应如下:① ② ③,下列对上述三个反应的叙述中,不正确的是( )
A. ①③为置换反应 B. ①②③均为氧化还原反应
C. ②为化合反应 D. 三个反应的反应物中硅元素均被氧化
6.在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为 ( )
A.36∶30 B.60∶36 C.2∶1 D.1∶2
7.实验室中盛放碱液的试剂瓶不能用玻璃塞,是因为(用化学方程式表示)___________________________。
8.普通玻璃是由_________________________等物质组成的
9.生产玻璃时,石灰石与石英反应的化学方程式为 。
10.玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、 ___________和____________ (填化学式)。
11.下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。请回答下列问题:
(1)D的电子式为___________。
(2)K的化学式为____________。
(3)写出B与C高温反应生成E和F的化学方程式:_________ _____。
(4)写出D与J的稀溶液反应生成G的离子方程式:___________ ___。
第二节 铝 金属材料
【基础知识】
一、金属矿物的开发利用
1.金属的存在:除极不活泼金属Au、Ag等极少金属外,其它在自然界均以化合态存在。
2.金属冶炼的原理
金属的冶炼就是将金属从其化合物中还原出来.
实质为:M n+ + ne— = M 该过程中金属元素被
3.金属的冶炼方法
(1)热分解法(适用于Hg、Ag等不活泼金属,可以直接加热其氧化物)
HgO Ag2O
(2)热还原法(适用于从Zn~Cu较活泼和较不活泼的金属,采用常用的还原剂H2、CO、C、Al等将它们从化合物中置换出来)
高炉炼铁: CO + Fe2O3
铝热法炼铁:Al + Fe2O3 (可以应用于焊接钢轨)
(3)电解法(适用于K、Ca、Na、Mg、Al等活泼金属,工业上常采用电解法)
二、金属与金属材料
1、 重要的黑色金属材料——钢铁
除了金属铝外,人们在生产生活中还要用到大量的其它金属。冶金工业上人们常将金属材料分为 金属材料和 金属材料两大类。
(1) 不锈钢的生产:
(2) 不锈钢的特点:
2、 几种有色金属材料——金、银、铜
(1)金属之最:延展性最好 ;导电导热最好的 ;硬度最大的 ; 熔沸点最高的 ;熔沸点最低的 ;
(2)金的物理性质
银的物理性质
金银的化学性质很稳定,可以被 腐蚀。
(3)铜的物理性质
铜的化学性质:铜绿的形成: 孔雀石分解:
Cu + O2 —— Cu + S ——
CuSO4·5H2O ——
CuO ——
CuSO4—— (4)核电厂金属 ;烟雾检测材料 ;21世纪的金属 ; 亲生物金属 。
三、铝及其化合物 (一).铝
1.存在:地壳中存在最多的金属元素是 。
2.物理性质:铝是 色金属,熔点 沸点 ,密度 ,导电性仅次于 、 、 。
3.化学性质 ①与氧气反应:
②铝与冷水不反应,与热水缓慢反应,一般情况下,铝表面的氧化膜阻止了与水的反应
③与非氧化性酸(盐酸和稀硫酸)反应:
常温下,铝遇浓硫酸、浓硝酸发生钝化现象。
④与强碱反应:
⑤铝热反应:(铝与氧化铁): 可用于焊接铁轨
a、 铝热反应定义:
b、 典型反应为:
c、 该反应属于 ,其中铝属于 剂,氧化铁是 剂。
d、 在该类反应中,铝的还原性大于金属氧化物中金属的还原性,在一定条件下该反应可能发生,这类氧化物还有 等。
e、 镁条的作用: ;氯酸钾的作用: 。
f、 反应现象为:
g、 反应的应用:
(二).铝的氧化物——氧化铝
1.Al2O3 白色难熔,是一种较好的耐火材料.
2. Al2O3 的两性——两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水)
(三). 铝的氢氧化物——氢氧化铝
(1)Al(OH)3的两性——两性氢氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水)
, 。
思考:1.为什么铝制容器不易用来盛放酸、酸梅汤和碱水等物质?为什么铝质器皿不易用沙子和钢丝球擦洗?
思考:2。下列图像哪一个是AlCl3溶液与NaOH溶液反应,哪一个是AlCl3溶液与氨水反应?
(2)Al(OH)3不稳定:
(3)制取:实验室常用铝盐(Al3+)与足量氨水制取Al(OH)3,
反应的离子方程式为:
(四).铝的重要的盐——明矾
明矾:十二水合硫酸铝钾 ,明矾常用作混凝剂,发生的离子方程式为 。
归纳整理:铝及其重要化合物之间的转化关系。
① ;②
③ ;④
⑤ ;⑥
⑦ ;⑧
【典型题目训练】
1.小明家里收藏了一件清代的铝制佛像,该佛像至今仍保存十分完好.该佛像未锈蚀的主要原因是( )
A.铝不易发生化学反应 B.铝的氧化物容易发生还原反应
C.铝不易被氧化 D.铝易氧化,但氧化铝具有保护内部铝的作用
2.实验室需要使AlCl3溶液中的Al3+离了全部沉淀出来,适宜用的试剂是( )
A.NaOH溶液 B.Ba(OH)2溶液 C.盐酸 D.氨水
3.下列离子方程式书写正确的是( )
A.澄清石 灰 水 跟 稀 硝 酸 反 应: Ca(OH)2+2H+=Ca2++2H2O
B.铁粉投入到硫酸铜溶液中:Fe +Cu2+=Fe2+ +Cu
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
D.钠和冷水反应 Na+2H2O=Na++2OH+H2↑
4.用铝热法还原下列物质,制得金属各1摩尔,消耗铝最少的是 ( )
A.MnO2 B.FeO C.Cr2O3 D.V2O5
5. 两份相同质量的铝粉,第一份与足量的氢氧化钠溶液反应,第二份和足量的盐酸反应。产生的气体物质的量( )
A.相等 B. 大于 C. 小于 D.无法确定
6.下列物之间的反应属于铝热反应的是( )
A.Al+HCl B.Al+H2SO4 C.Al+Fe3O4 D.Al+WO3
7.在铝和NaOH溶液的反应中,作为还原剂的是( )
A.水 B.铝 C.氢氧化钠 D.氢氧化钠和水
8.下列用途主要体现铝的物理性质的是( )
①家用铝锅②盛浓硝酸的容器③制导线④焊接钢轨⑤包装铝箔⑥炼钢的脱氧剂⑦做防锈油漆
A.①②③④ B.⑥⑦ C.①③⑤⑦ D.②④⑥
9.(2009年学业水平测试)在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为( )
A.0.225mol/L B.0.25mol/L C.0.45mol/L D.0.9mol/L
10、除去镁粉中混有的少量铝粉,可选用的试剂是( )
A.稀盐酸 B.稀硝酸 C.氢氧化钠溶液 D.硝酸铜溶液
11:把x溶液(或气体)慢慢加入(或通入)到一定量的y溶液中,产生的沉淀量与加入x物质的量的关系如图所示,符合图中曲线的是
A.x为CO2,y为Ca(OH)2 B.x为NH3·H2O,y为AlCl3
C.x为NaOH,y为AlCl3 D.x为HCl,y为Na[Al(OH)]4
12.在铝制易拉罐中收集一满罐CO2,加入过量浓氢氧化钠溶液,立即把口封闭。可以发现易拉罐“咔咔”作响,并变瘪了;过一会儿后,易拉罐又会作响并鼓起来。
(1)罐壁变瘪发生的反应方程式是____ _;
(2)罐再度鼓起发生反应的化学方程式是__ ______。
13、 某无色透明的稀溶液能与铝作用放出氢气,试分析下列离子中:H+、Ba2+、Mg2+、OH-、 SO32-、Cl-、CO32-、NO3-可能有哪些离子大量存在于此溶液中。
第一种情况,该溶液中有_______ _离子,可能有_________ _ 离子;
第二种情况,该溶液中有________ 离子,可能有_______ _离子。
14.钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不和非金属、强酸反应,红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体。该反应的化学方程式为 ,该反应的还原剂是 。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式: ;
(2)简述从上述所得产物中获取金属钛的步骤。
15.某课外活动小组设计了如图所示(夹持装置已略去)的一套装置,用H2和CuO冶炼Cu。准确称取3.180 g CuO放在硬质玻璃管内.已知:CuO—黑色、Cu2O—红色、Cu—红色。
试通过计算回答[①气体体积按标准状况计,②Ar(Cu)=63.5,Ar(O)=16.0,Ar(H)=1.00]:
(1)下列H2球较适合用于本实验的是__________(填选项编号)
A.500 mL H2 球 B.896 mL H2 球 C.1500 mL H2 球
(2)反应至黑色全部变为红色止,测量H2球的体积变为220 mL,固体质量变为2.700 g,碱石灰增重0.540 g。则:
①参加反应的H2的质量为:__________;
②假设红色物质为单一物质,则红色物质的化学式为_______________。
电解
2NaCl(熔融)
电解
①2Al2O3 (熔融)
(电解
乙MgCl2(熔融)
(高温
高温
1
