2022-2023学年高二化学苏教版(2020)选择性必修1专题1第二单元化学电源课件(30张ppt)
文档属性
| 名称 | 2022-2023学年高二化学苏教版(2020)选择性必修1专题1第二单元化学电源课件(30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 42.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 22:07:53 | ||
图片预览








文档简介
(共30张PPT)
专题一化学反应的热效应
第二课时 化学电源
第二单元化学能与电能的转化
核心素养目标:
1.通过对常见化学电源的分析,建立对原电池过程系统认识的思维模型,提高对原电池本质的认识
2.增强科技意识,不断研发新型电池,满足人类社会发展的需求。积极回收利用废旧电池减少其对环境的污染。
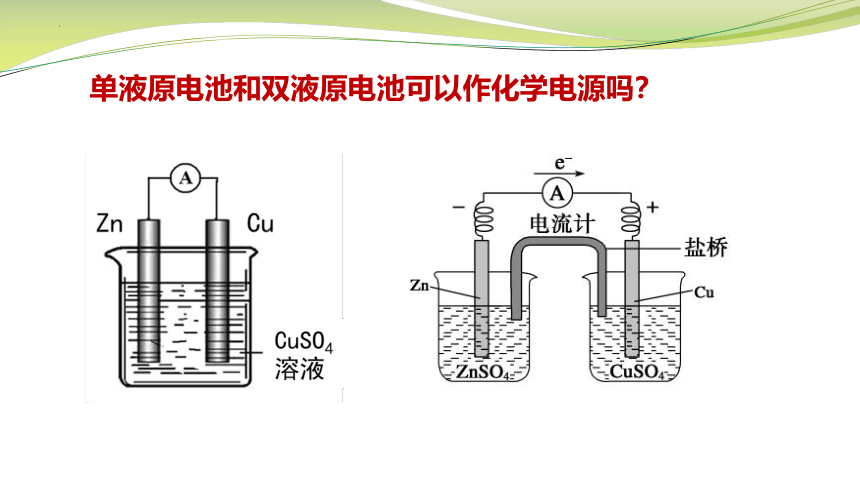
单液原电池和双液原电池可以作化学电源吗?
便于携带、易于维护
内阻小
质量小
单位质量或单位体积输出的能量多
价格便宜、反复使用
体积小
供能稳定、连续工作
寿命长
如何实现?
……
化学电源
能量转化效率高
理想的化学
电源
世界上第一个化学电源—伏打电堆
电动车专用电池
手表电源
手机电源
笔记本电源
常见的化学电源
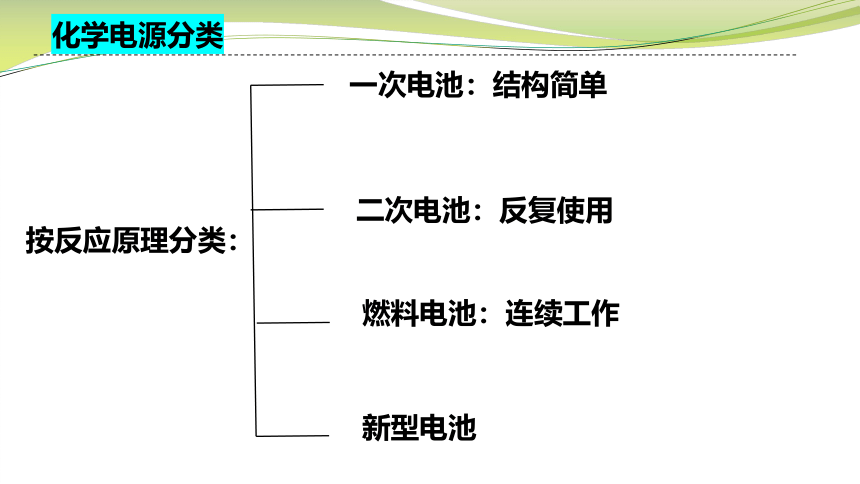
化学电源分类
一次电池:结构简单
二次电池:反复使用
燃料电池:连续工作
新型电池
按反应原理分类:
一、一次电池
碱性干电池
银锌电池
(干电池)
一次电池中发生氧化还原反应的物质大部分被消耗后就不能再使用。使用最广泛的一次电池是干电池,如普通锌锰干电池、碱性锌锰电池等。
优点:
总反应为: Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2 + 2MnO(OH)
负极( ):
正极( ):
Zn
C
制作简单、价格便宜
缺点:
放电时间短、放电后电压下降较快,漏液等
(一)普通锌锰干电池
任务1 ——入微一次电池
回归本源:根据提供的总反应方程,书写电极式。
Zn+2NH3-2e-==Zn(NH3)22+
2MnO2+2NH4++2e-==2MnOOH+2NH3
碱性锌锰电池的构造示意图
负极:
Zn+2OH--2e-===Zn(OH)2
正极:
2MnO2+2H2O+2e-===2MnOOH+2OH-
碱性锌锰电池总反应式:
Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2
优点:
性能优越,比能量大,能提供较大电流并连续放电。
(二)碱性锌锰电池
任务1 ——入微一次电池
回归本源:根据提供的总反应方程,书写电极式。
只能一次使用,不能充电;价格较贵
缺点:
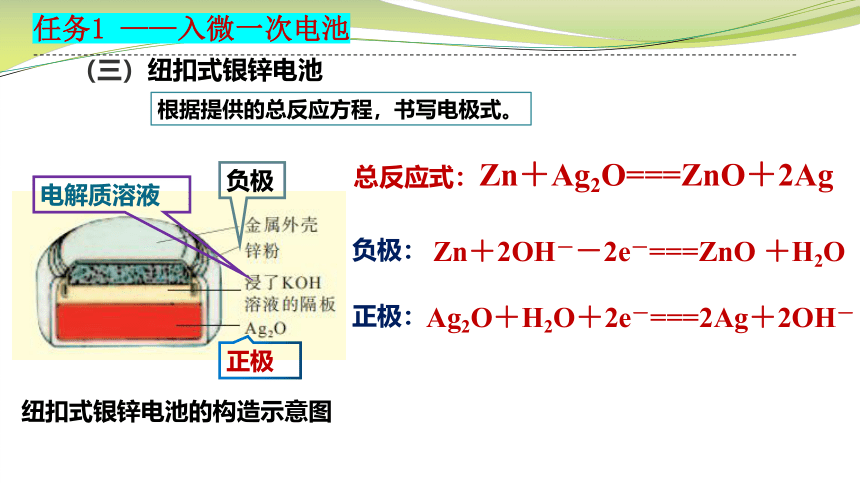
纽扣式银锌电池的构造示意图
Ag2O+H2O+2e-===2Ag+2OH-
负极
正极
电解质溶液
总反应式:Zn+Ag2O===ZnO+2Ag
负极:
正极:
Zn+2OH--2e-===ZnO +H2O
(三)纽扣式银锌电池
任务1 ——入微一次电池
根据提供的总反应方程,书写电极式。
二、二次电池
二次电池又称为充电电池或蓄电池,放电后可以再充电使活性物质获得再生,因此二次电池可以多次重复使用。铅蓄电池是最常见的二次电池。
铅蓄电池
(一)铅蓄电池
负极:
正极:
Pb+SO4 2--2e-=PbSO4
Pb
PbO2
硫酸溶液
电解质:
PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
思考:放电过程中,
负极质量的变化是 ,电解质溶液pH的变化是 。
放电过程
增大
增大
任务2:揭秘二次电池
(一)铅蓄电池
阴极(发生还原反应):
阳极(发生氧化反应)
PbSO4+2e-===Pb+SO42-
PbSO4+2H2O-2e-===PbO2+4H++SO42-
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
充电过程
充电时:
铅蓄电池正极与直流电源正极相连,
负极与直流电源负极相连。
任务2:揭秘 二次电池
铅酸蓄电池的构造示意图
缺点:
比能量低,笨重,
废弃后污染环境。
铅蓄电池优点
电压稳定
使用方便
安全可靠
价格低廉
任务2:揭秘二次电池
(一)铅蓄电池
任务2:揭秘二次电池
随着信息技术的发展,为了适应移动通信、便携式电脑和各种电子产品等的广泛使用,科研工作者不断研制出小型化、高比能量、工作寿命长、不需要特殊维护的二次电池。目前已开发出镍镉电池、镍氢电池、银锌电池、锂电池和锂离子电池等新型二次电池。
锂离子电池的工作原理示意图
电池总反应:LixC6+Li(1-x)CoO2=LiCoO2+6C
(二)钴酸锂-石墨锂电池
负极:
Li(1-x)CoO2+xLi++xe-=LiCoO2
LixC6-xe-=6C+xLi+
正极:
该电池电解质可以用水溶液吗?
否
任务2:揭秘二次电池
中国的锂电池
三、燃料电池
燃料电池是利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。
任务3:探究燃料电池
1.氢氧燃料电池(碱性介质)
负极:
正极:
电解质溶液:氢氧化钾溶液
电池总反应: 2H2 + O2 = H2O
2H2-4e-+4OH-===4H2O
O2+2H2O+4e-===4OH-
氢气
氧气
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
2.氢氧燃料电池(酸性介质)
负极:氢气
正极: 氧气
电解质溶液:硫酸
电池总反应: 2H2 + O2 = H2O
任务3:探究燃料电池
燃料电池的优点:
①燃料电池的氧化剂和还原剂不是储藏在电池内部,而是在工作时不断从外部输 入,同时将电极反应产物不断排出电池,因此燃料电池能连续不断地提供电能。
2022北京冬奥会氢能源用车
②燃料电池的能量转化效率远高于普通燃料燃烧的能量转换效率。
③应用燃料电池的发电站,具有能量转化效率远高,废弃物排放少,运行噪音小等优点。
3.甲烷燃料电池
名称 电解质 电极反应和总反应
甲烷燃料电池 KOH 总反应:CH4+2O2+2KOH===K2CO3+3H2O
正极:
负极:
H2SO4 总反应:CH4+2O2===CO2+2H2O
正极:
负极:
2O2+4H2O+8e-===8OH-
CH4+10OH--8e-===CO+7H2O
2O2+8H++8e-===4H2O
CH4-8e-+2H2O===CO2+8H+
任务3:探究燃料电池
课堂小结
伏打电堆等
电池起源
普通锌锰干电池,
碱性锌锰干电池
一次电池
铅蓄电池,锂离子电池
二次电池
燃料电池
新型电池
氢氧燃料电池
纸电池,
石墨烯电池
化学电源的发展推进
人类文明的发展进程
当堂练习
1.关于化学电源:①银锌纽扣电池;②氢氧燃料电池;③锌锰干电池;④铅蓄电池;⑤锂电池,下列有关说法正确的是( )A. ②和③都属于绿色电池 B. ①和④都属于二次电池C. ①和③都属于一次电池 D. ⑤的电解液可为水溶液
√
2.在碱性锌锰电池中,已知氢氧化钾为电解质,发生的电池总反应为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。下列有关该电池的电极反应式的书写正确的是
A.负极反应式为Zn-2e-===Zn2+
B.负极反应式为Zn+2H2O-2e-===Zn(OH)2+2H+
C.正极反应式为2MnO2+2H++2e-===2MnO(OH)
D.正极反应式为2MnO2+2H2O+2e-===2MnOOH+2OH-
√
当堂练习
3.液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述错误的是
A.b电极发生氧化反应
B.a电极的电极反应式:N2H4+4OH--4e-
===N2+4H2O
C.放电时,电流从b电极经过负载流向a电极
D.其中的离子交换膜需选用阴离子交换膜
√
当堂练习
谢谢观看
专题一化学反应的热效应
第二课时 化学电源
第二单元化学能与电能的转化
核心素养目标:
1.通过对常见化学电源的分析,建立对原电池过程系统认识的思维模型,提高对原电池本质的认识
2.增强科技意识,不断研发新型电池,满足人类社会发展的需求。积极回收利用废旧电池减少其对环境的污染。
单液原电池和双液原电池可以作化学电源吗?
便于携带、易于维护
内阻小
质量小
单位质量或单位体积输出的能量多
价格便宜、反复使用
体积小
供能稳定、连续工作
寿命长
如何实现?
……
化学电源
能量转化效率高
理想的化学
电源
世界上第一个化学电源—伏打电堆
电动车专用电池
手表电源
手机电源
笔记本电源
常见的化学电源
化学电源分类
一次电池:结构简单
二次电池:反复使用
燃料电池:连续工作
新型电池
按反应原理分类:
一、一次电池
碱性干电池
银锌电池
(干电池)
一次电池中发生氧化还原反应的物质大部分被消耗后就不能再使用。使用最广泛的一次电池是干电池,如普通锌锰干电池、碱性锌锰电池等。
优点:
总反应为: Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2 + 2MnO(OH)
负极( ):
正极( ):
Zn
C
制作简单、价格便宜
缺点:
放电时间短、放电后电压下降较快,漏液等
(一)普通锌锰干电池
任务1 ——入微一次电池
回归本源:根据提供的总反应方程,书写电极式。
Zn+2NH3-2e-==Zn(NH3)22+
2MnO2+2NH4++2e-==2MnOOH+2NH3
碱性锌锰电池的构造示意图
负极:
Zn+2OH--2e-===Zn(OH)2
正极:
2MnO2+2H2O+2e-===2MnOOH+2OH-
碱性锌锰电池总反应式:
Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2
优点:
性能优越,比能量大,能提供较大电流并连续放电。
(二)碱性锌锰电池
任务1 ——入微一次电池
回归本源:根据提供的总反应方程,书写电极式。
只能一次使用,不能充电;价格较贵
缺点:
纽扣式银锌电池的构造示意图
Ag2O+H2O+2e-===2Ag+2OH-
负极
正极
电解质溶液
总反应式:Zn+Ag2O===ZnO+2Ag
负极:
正极:
Zn+2OH--2e-===ZnO +H2O
(三)纽扣式银锌电池
任务1 ——入微一次电池
根据提供的总反应方程,书写电极式。
二、二次电池
二次电池又称为充电电池或蓄电池,放电后可以再充电使活性物质获得再生,因此二次电池可以多次重复使用。铅蓄电池是最常见的二次电池。
铅蓄电池
(一)铅蓄电池
负极:
正极:
Pb+SO4 2--2e-=PbSO4
Pb
PbO2
硫酸溶液
电解质:
PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
思考:放电过程中,
负极质量的变化是 ,电解质溶液pH的变化是 。
放电过程
增大
增大
任务2:揭秘二次电池
(一)铅蓄电池
阴极(发生还原反应):
阳极(发生氧化反应)
PbSO4+2e-===Pb+SO42-
PbSO4+2H2O-2e-===PbO2+4H++SO42-
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
充电过程
充电时:
铅蓄电池正极与直流电源正极相连,
负极与直流电源负极相连。
任务2:揭秘 二次电池
铅酸蓄电池的构造示意图
缺点:
比能量低,笨重,
废弃后污染环境。
铅蓄电池优点
电压稳定
使用方便
安全可靠
价格低廉
任务2:揭秘二次电池
(一)铅蓄电池
任务2:揭秘二次电池
随着信息技术的发展,为了适应移动通信、便携式电脑和各种电子产品等的广泛使用,科研工作者不断研制出小型化、高比能量、工作寿命长、不需要特殊维护的二次电池。目前已开发出镍镉电池、镍氢电池、银锌电池、锂电池和锂离子电池等新型二次电池。
锂离子电池的工作原理示意图
电池总反应:LixC6+Li(1-x)CoO2=LiCoO2+6C
(二)钴酸锂-石墨锂电池
负极:
Li(1-x)CoO2+xLi++xe-=LiCoO2
LixC6-xe-=6C+xLi+
正极:
该电池电解质可以用水溶液吗?
否
任务2:揭秘二次电池
中国的锂电池
三、燃料电池
燃料电池是利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。
任务3:探究燃料电池
1.氢氧燃料电池(碱性介质)
负极:
正极:
电解质溶液:氢氧化钾溶液
电池总反应: 2H2 + O2 = H2O
2H2-4e-+4OH-===4H2O
O2+2H2O+4e-===4OH-
氢气
氧气
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
2.氢氧燃料电池(酸性介质)
负极:氢气
正极: 氧气
电解质溶液:硫酸
电池总反应: 2H2 + O2 = H2O
任务3:探究燃料电池
燃料电池的优点:
①燃料电池的氧化剂和还原剂不是储藏在电池内部,而是在工作时不断从外部输 入,同时将电极反应产物不断排出电池,因此燃料电池能连续不断地提供电能。
2022北京冬奥会氢能源用车
②燃料电池的能量转化效率远高于普通燃料燃烧的能量转换效率。
③应用燃料电池的发电站,具有能量转化效率远高,废弃物排放少,运行噪音小等优点。
3.甲烷燃料电池
名称 电解质 电极反应和总反应
甲烷燃料电池 KOH 总反应:CH4+2O2+2KOH===K2CO3+3H2O
正极:
负极:
H2SO4 总反应:CH4+2O2===CO2+2H2O
正极:
负极:
2O2+4H2O+8e-===8OH-
CH4+10OH--8e-===CO+7H2O
2O2+8H++8e-===4H2O
CH4-8e-+2H2O===CO2+8H+
任务3:探究燃料电池
课堂小结
伏打电堆等
电池起源
普通锌锰干电池,
碱性锌锰干电池
一次电池
铅蓄电池,锂离子电池
二次电池
燃料电池
新型电池
氢氧燃料电池
纸电池,
石墨烯电池
化学电源的发展推进
人类文明的发展进程
当堂练习
1.关于化学电源:①银锌纽扣电池;②氢氧燃料电池;③锌锰干电池;④铅蓄电池;⑤锂电池,下列有关说法正确的是( )A. ②和③都属于绿色电池 B. ①和④都属于二次电池C. ①和③都属于一次电池 D. ⑤的电解液可为水溶液
√
2.在碱性锌锰电池中,已知氢氧化钾为电解质,发生的电池总反应为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。下列有关该电池的电极反应式的书写正确的是
A.负极反应式为Zn-2e-===Zn2+
B.负极反应式为Zn+2H2O-2e-===Zn(OH)2+2H+
C.正极反应式为2MnO2+2H++2e-===2MnO(OH)
D.正极反应式为2MnO2+2H2O+2e-===2MnOOH+2OH-
√
当堂练习
3.液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述错误的是
A.b电极发生氧化反应
B.a电极的电极反应式:N2H4+4OH--4e-
===N2+4H2O
C.放电时,电流从b电极经过负载流向a电极
D.其中的离子交换膜需选用阴离子交换膜
√
当堂练习
谢谢观看
