2022-2023学年上学期高一化学人教版(2019)必修第一册1-2.1.1.单质钠—活泼的金属单质课件(30张ppt)
文档属性
| 名称 | 2022-2023学年上学期高一化学人教版(2019)必修第一册1-2.1.1.单质钠—活泼的金属单质课件(30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 90.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 22:08:31 | ||
图片预览







文档简介
(共21张PPT)
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
浩瀚的大海美丽而富饶,海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。
第一节 钠及其化合物
单质钠
—活泼的金属单质
自然界中并不存在游离的钠,钠元素都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4。大多储存在海水中。
19世纪初(1807年),英国化学家戴维在实验室中首次制得了钠。
食盐( NaCl )
芒硝( Na2SO4·10H2O)
天然存在的钠的化合物
天然碱(碳酸钠、碳酸氢钠)
硝石(NaNO3)
生活中含钠元素的物质
生理盐水NaCl注射液
食盐:NaCl
纯碱Na2CO3
胃药(抗酸药):NaHCO3
发酵粉 NaHCO3
火碱(烧碱)NaOH
谷氨酸钠
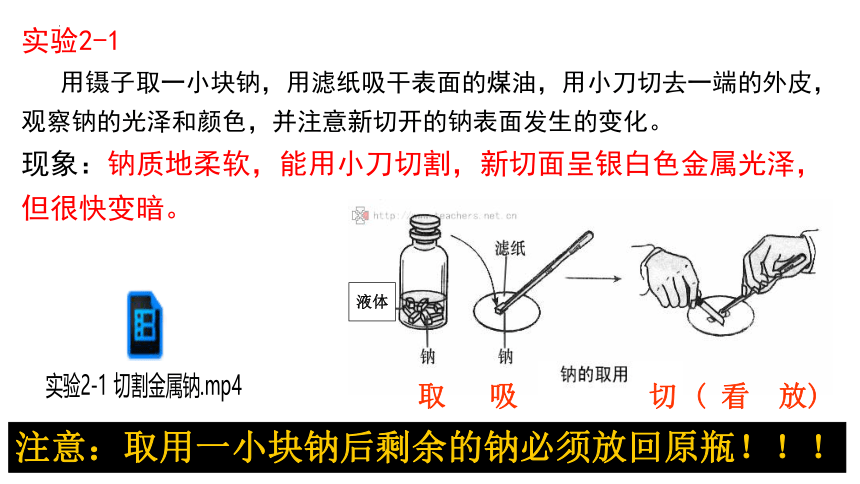
实验2-1
用镊子取一小块钠,用滤纸吸干表面的煤油,用小刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠表面发生的变化。
现象:钠质地柔软,能用小刀切割,新切面呈银白色金属光泽,但很快变暗。
液体
取 吸 切 ( 看 放)
注意:取用一小块钠后剩余的钠必须放回原瓶!!!
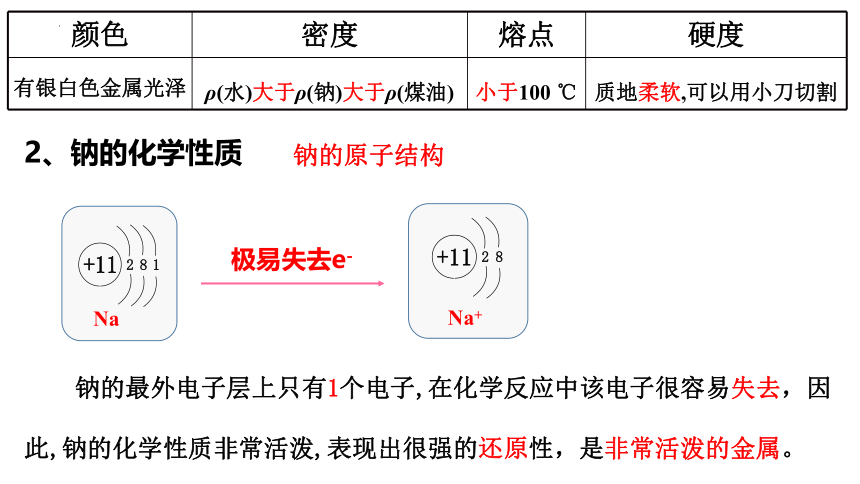
1、钠的物理性质
颜色:
银白色
金属光泽的固体
状态:
硬度:
质软,可用小刀切割
☆钠的取用→镊子(不能用手接触)
☆煤油要用滤纸擦干
☆切割在滤纸或玻璃片上进行
熔、沸点较低;
密度较小
硬度小
钠的原子结构
Na
Na+
极易失去e-
钠的最外电子层上只有1个电子,在化学反应中该电子很容易失去,因此,钠的化学性质非常活泼,表现出很强的还原性,是非常活泼的金属。
2、钠的化学性质
颜色 密度 熔点 硬度
有银白色金属光泽 ρ(水)大于ρ(钠)大于ρ(煤油) 小于100 ℃ 质地柔软,可以用小刀切割
实验说明钠的化学性质很活泼,常温下极易与空气中的氧气发生反应
4Na+O2=2Na2O
白色
钠与氧气反应迅速,但钠与煤油不反应,且密度大于煤油,故钠可以保存在煤油或石蜡油中,以隔绝空气。
①常温下氧气的反应
(1)钠与氧气反应
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大小的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验步骤 将干燥的坩埚加热,同时切取一块绿豆大小的钠,迅速投到坩埚中,继续加热至钠熔化后撤掉酒精灯
实验现象
实验结论
钠受热熔化后表面变白变成闪亮的小球,然后与氧气剧烈反应并放出大量的热,发出黄色火焰,生成一种淡黄色固体
钠的熔点较低,钠的化学性质非常活泼,常温下极易与空气中的氧气反应,加热时反应更剧烈
②在加热的条件下与氧气的反应
2Na+O2 Na2O2
点燃或
加热
特殊的氧化物——过氧化钠(Na2O2),淡黄色固体
+1 -1
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
熔点低
2Na + O2
△
【结论】钠在加热的条件下与能跟氧气反应,生成了淡黄色的过氧化钠。
常温下
4Na + O2 == 2Na2O
(白色)
加热下
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
0
0
+1
-2
失去4e-,化合价升高,被氧化
得到4e-,化合价降低,被还原
不稳定
稳定
△
钠与氧气反应
2Na +O2 == Na2O2 (淡黄色)
通过实验2-1和2-2可知:金属钠的化学性质很活泼,在常温和加热条件下都能与氧气反应。条件不同,现象不同,产物也不同,跟氧气的量、纯度等无关。
①钠与硫混合研磨生成Na2S:2Na+S===Na2S (研磨时容易爆炸)
②在氯气中燃烧:2Na+Cl2 2NaCl (产生黄色火焰,生成白烟)
③与氢气反应生成NaH:2Na+H2 NaH(金属氢化物中,氢为-1价)
④与氮气反应生成Na3N:6Na+N2 2Na3N
钠除了和非金属单质氧气反应还能和氯气、硫、氮气、氢气等非金属单质反应。
1.判断正误(正确的打“√”,错误的打“×”)
(1)取用钠时,可以用手直接接触它( )
(2)金属钠能存放于煤油中,也可存放于CCl4中( )
(3)常温下,钠与氧气反应生成淡黄色固体( )
(4)钠与氧气反应时,条件不同,产物也不同( )
(5)实验中取出的药品都不能再放回原瓶( )
(6)钠在自然界中存在的形态只有化合态( )
(7)单质钠在氧化还原反应中既可做还原剂,又可做氧化剂。( )
(8)常温下,钠与过量氧气反应生成Na2O2。( )
(9)等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数均相同
( )
×
×
×
×
×
×
√
√
√
2.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中,正确的是( )A.钠是银白色金属,熔点低,硬度大B.钠放置在空气中,会迅速被氧化生成淡黄色的氧化钠C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰D.金属钠可存放于烧杯中
C
解析:A中,钠的硬度小,可用小刀切割;B中,放置在空气中,钠被缓慢氧化生成白色的Na2O;D中,钠与氧气反应,应密闭保存。
3、取一块金属钠放在燃烧匙里加热,观察到下列现象:(1)金属熔化(2)燃烧后得白色固体(3)燃烧室火焰为黄色(4)燃烧生成浅黄色固体物质,其中描述正确的是( )
A.(1)(2) B .(2)(3) C .(1)(4) D .(1)(3)(4)
D
A
4、下列有关金属钠的说法中,错误的是( )
A.钠只有在加热的条件下才能与氧气反应
B.钠与氧气反应的产物与反应条件有关
C.钠在反应中易失电子,表现出还原性
D.钠应保存在煤油中
4.2019年3月21日,某化工有限公司发生特别重大爆炸事故,事故发生后,公司有关人员抓紧处理剩余危化品和污染物,加强空气、土壤、饮用水源等环境监测,严防发生次生事故。钠燃烧也易引发事故。下列现象或性质能体现钠的物理性质的是 ( )
①钠燃烧时发出黄色的火焰 ②钠燃烧时生成过氧化钠 ③熔点低 ④密度比水小 ⑤热和电的良导体 ⑥钠有很强的还原性
A.①③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.①③④⑤
D
解析:①钠燃烧时发出黄色的火焰,是钠的焰色试验,属于物理性质;②钠燃烧时生成过氧化钠,生成了新物质,属于化学性质;③熔点低,属于物理性质;④密度比水小,属于物理性质;⑤热和电的良导体,属于物理性质;⑥钠有很强的还原性,在反应中失去电子,属于化学性质。
5.下列各组物质中的两种物质发生反应时,反应条件或反应物用量的改变,对生成物没有影响的是
A.Fe和O2 B.Na和O2 C.Zn和盐酸 D.C和O2
解析: Fe和O2在潮湿的空气中会生成三氧化二铁,在点燃的条件下会生成四氧化三铁,产物与反应条件有关,A项不正确;
钠与氧气在常温下生成氧化钠,在加热条件下生成过氧化钠,产物与反应条件有关,B项不正确;
Zn和盐酸反应只生成氯化锌和氢气,反应条件或反应物用量的改变,对生成物没有影响,C项正确;
碳与足量氧气反应生成二氧化碳,与少量氧气反应生成一氧化碳,产物与氧气的用量有关,D项不正确。
C
6.实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸吸干表面的煤油,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是
A.钠在常温下是固体 B.钠的熔点很低
C.钠具有银白色的金属光泽 D.金属钠很软
解析: 从题干中“取出一小块金属钠”知钠在常温下是固体;“用小刀切开”说明钠很软;切开后可看到钠具有银白色的金属光泽;没有加热将钠熔化,因此不能得出其熔点很低的性质。
B
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
浩瀚的大海美丽而富饶,海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。
第一节 钠及其化合物
单质钠
—活泼的金属单质
自然界中并不存在游离的钠,钠元素都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4。大多储存在海水中。
19世纪初(1807年),英国化学家戴维在实验室中首次制得了钠。
食盐( NaCl )
芒硝( Na2SO4·10H2O)
天然存在的钠的化合物
天然碱(碳酸钠、碳酸氢钠)
硝石(NaNO3)
生活中含钠元素的物质
生理盐水NaCl注射液
食盐:NaCl
纯碱Na2CO3
胃药(抗酸药):NaHCO3
发酵粉 NaHCO3
火碱(烧碱)NaOH
谷氨酸钠
实验2-1
用镊子取一小块钠,用滤纸吸干表面的煤油,用小刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠表面发生的变化。
现象:钠质地柔软,能用小刀切割,新切面呈银白色金属光泽,但很快变暗。
液体
取 吸 切 ( 看 放)
注意:取用一小块钠后剩余的钠必须放回原瓶!!!
1、钠的物理性质
颜色:
银白色
金属光泽的固体
状态:
硬度:
质软,可用小刀切割
☆钠的取用→镊子(不能用手接触)
☆煤油要用滤纸擦干
☆切割在滤纸或玻璃片上进行
熔、沸点较低;
密度较小
硬度小
钠的原子结构
Na
Na+
极易失去e-
钠的最外电子层上只有1个电子,在化学反应中该电子很容易失去,因此,钠的化学性质非常活泼,表现出很强的还原性,是非常活泼的金属。
2、钠的化学性质
颜色 密度 熔点 硬度
有银白色金属光泽 ρ(水)大于ρ(钠)大于ρ(煤油) 小于100 ℃ 质地柔软,可以用小刀切割
实验说明钠的化学性质很活泼,常温下极易与空气中的氧气发生反应
4Na+O2=2Na2O
白色
钠与氧气反应迅速,但钠与煤油不反应,且密度大于煤油,故钠可以保存在煤油或石蜡油中,以隔绝空气。
①常温下氧气的反应
(1)钠与氧气反应
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大小的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验步骤 将干燥的坩埚加热,同时切取一块绿豆大小的钠,迅速投到坩埚中,继续加热至钠熔化后撤掉酒精灯
实验现象
实验结论
钠受热熔化后表面变白变成闪亮的小球,然后与氧气剧烈反应并放出大量的热,发出黄色火焰,生成一种淡黄色固体
钠的熔点较低,钠的化学性质非常活泼,常温下极易与空气中的氧气反应,加热时反应更剧烈
②在加热的条件下与氧气的反应
2Na+O2 Na2O2
点燃或
加热
特殊的氧化物——过氧化钠(Na2O2),淡黄色固体
+1 -1
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
熔点低
2Na + O2
△
【结论】钠在加热的条件下与能跟氧气反应,生成了淡黄色的过氧化钠。
常温下
4Na + O2 == 2Na2O
(白色)
加热下
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
0
0
+1
-2
失去4e-,化合价升高,被氧化
得到4e-,化合价降低,被还原
不稳定
稳定
△
钠与氧气反应
2Na +O2 == Na2O2 (淡黄色)
通过实验2-1和2-2可知:金属钠的化学性质很活泼,在常温和加热条件下都能与氧气反应。条件不同,现象不同,产物也不同,跟氧气的量、纯度等无关。
①钠与硫混合研磨生成Na2S:2Na+S===Na2S (研磨时容易爆炸)
②在氯气中燃烧:2Na+Cl2 2NaCl (产生黄色火焰,生成白烟)
③与氢气反应生成NaH:2Na+H2 NaH(金属氢化物中,氢为-1价)
④与氮气反应生成Na3N:6Na+N2 2Na3N
钠除了和非金属单质氧气反应还能和氯气、硫、氮气、氢气等非金属单质反应。
1.判断正误(正确的打“√”,错误的打“×”)
(1)取用钠时,可以用手直接接触它( )
(2)金属钠能存放于煤油中,也可存放于CCl4中( )
(3)常温下,钠与氧气反应生成淡黄色固体( )
(4)钠与氧气反应时,条件不同,产物也不同( )
(5)实验中取出的药品都不能再放回原瓶( )
(6)钠在自然界中存在的形态只有化合态( )
(7)单质钠在氧化还原反应中既可做还原剂,又可做氧化剂。( )
(8)常温下,钠与过量氧气反应生成Na2O2。( )
(9)等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数均相同
( )
×
×
×
×
×
×
√
√
√
2.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中,正确的是( )A.钠是银白色金属,熔点低,硬度大B.钠放置在空气中,会迅速被氧化生成淡黄色的氧化钠C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰D.金属钠可存放于烧杯中
C
解析:A中,钠的硬度小,可用小刀切割;B中,放置在空气中,钠被缓慢氧化生成白色的Na2O;D中,钠与氧气反应,应密闭保存。
3、取一块金属钠放在燃烧匙里加热,观察到下列现象:(1)金属熔化(2)燃烧后得白色固体(3)燃烧室火焰为黄色(4)燃烧生成浅黄色固体物质,其中描述正确的是( )
A.(1)(2) B .(2)(3) C .(1)(4) D .(1)(3)(4)
D
A
4、下列有关金属钠的说法中,错误的是( )
A.钠只有在加热的条件下才能与氧气反应
B.钠与氧气反应的产物与反应条件有关
C.钠在反应中易失电子,表现出还原性
D.钠应保存在煤油中
4.2019年3月21日,某化工有限公司发生特别重大爆炸事故,事故发生后,公司有关人员抓紧处理剩余危化品和污染物,加强空气、土壤、饮用水源等环境监测,严防发生次生事故。钠燃烧也易引发事故。下列现象或性质能体现钠的物理性质的是 ( )
①钠燃烧时发出黄色的火焰 ②钠燃烧时生成过氧化钠 ③熔点低 ④密度比水小 ⑤热和电的良导体 ⑥钠有很强的还原性
A.①③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.①③④⑤
D
解析:①钠燃烧时发出黄色的火焰,是钠的焰色试验,属于物理性质;②钠燃烧时生成过氧化钠,生成了新物质,属于化学性质;③熔点低,属于物理性质;④密度比水小,属于物理性质;⑤热和电的良导体,属于物理性质;⑥钠有很强的还原性,在反应中失去电子,属于化学性质。
5.下列各组物质中的两种物质发生反应时,反应条件或反应物用量的改变,对生成物没有影响的是
A.Fe和O2 B.Na和O2 C.Zn和盐酸 D.C和O2
解析: Fe和O2在潮湿的空气中会生成三氧化二铁,在点燃的条件下会生成四氧化三铁,产物与反应条件有关,A项不正确;
钠与氧气在常温下生成氧化钠,在加热条件下生成过氧化钠,产物与反应条件有关,B项不正确;
Zn和盐酸反应只生成氯化锌和氢气,反应条件或反应物用量的改变,对生成物没有影响,C项正确;
碳与足量氧气反应生成二氧化碳,与少量氧气反应生成一氧化碳,产物与氧气的用量有关,D项不正确。
C
6.实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸吸干表面的煤油,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是
A.钠在常温下是固体 B.钠的熔点很低
C.钠具有银白色的金属光泽 D.金属钠很软
解析: 从题干中“取出一小块金属钠”知钠在常温下是固体;“用小刀切开”说明钠很软;切开后可看到钠具有银白色的金属光泽;没有加热将钠熔化,因此不能得出其熔点很低的性质。
B
