5.2 金属矿物 铁的冶炼 课件-九年级化学(沪教版)上册(共14张PPT)
文档属性
| 名称 | 5.2 金属矿物 铁的冶炼 课件-九年级化学(沪教版)上册(共14张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 16:38:29 | ||
图片预览





文档简介
(共14张PPT)
第二节 金属矿物 铁的冶炼
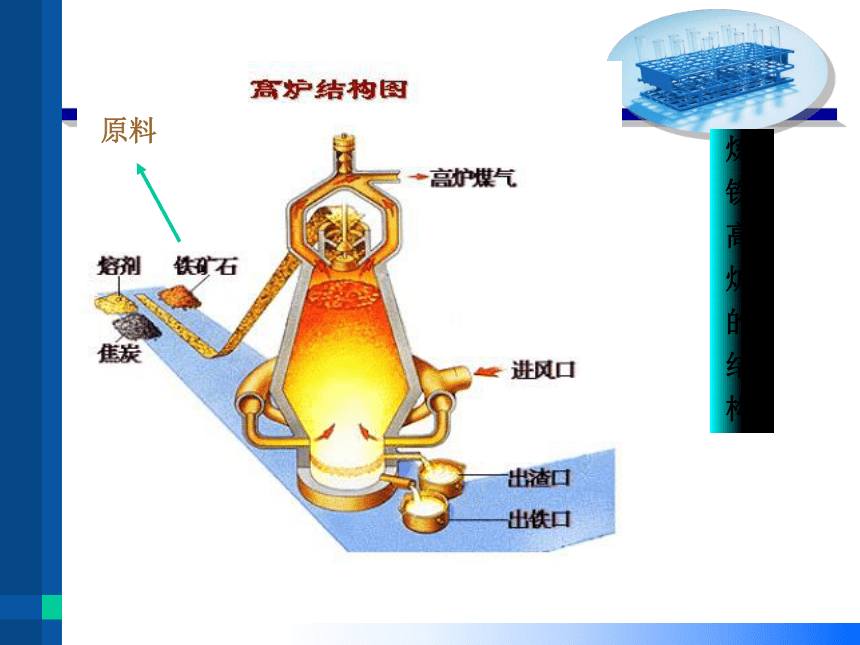
原料
炼 铁 高 炉 的 结 构
工业炼铁
2.原料:
主要反应:
高炉
铁矿石、焦炭、空气、石灰石
①提供热源 ②提供CO
1.设备:
3.作用:
铁矿石:提供铁元素
焦炭:
空气:提供氧气
石灰石:将矿石中二氧化硅转成炉渣除去
Fe2O3 + 3CO === 2Fe + 3CO2
高温
以生铁为原料,利用氧气或铁的氧化物将一部分碳等杂质变为气体或炉渣而除去的过程。
目的:
降碳、调硅锰、除硫磷。
原理:
工业炼钢
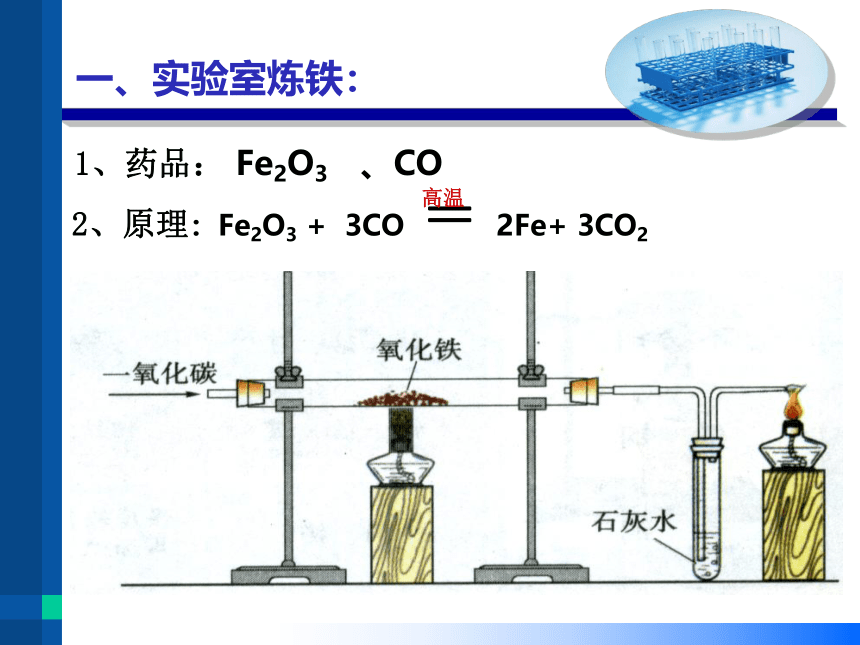
一、实验室炼铁:
1、药品: Fe2O3 、CO
2、原理:Fe2O3 + 3CO = 2Fe+ 3CO2
高温
3、实验步骤:
(1)反应前先检查装置的____
(2)装入药品,连接好装置
(3)实验开始,先通CO气体,再点燃酒精灯加热
(4)观察氧化铁的颜色变化和石灰水的变化
(5)反应结束,先停止加热,后停止通CO气体
气密性
(CO:
早出晚归
酒精灯:
迟到早退)
A处:固体由红色变成黑色
B处:澄清石灰水变浑浊
C处:气体燃烧产生淡蓝色火焰
A
B
C
4、实验现象:
5、注意事项
(1)实验开始,先通CO气体,再点燃酒精灯加热目的:
排尽装置中的空气,以防加热时发生爆炸
(2)反应结束,先停止加热,后停止通CO气体目的:
防止铁在较高的温度下重新被氧化
(3)为什么要进行尾气处理?
因为CO有毒会污染空气
(4)对尾气处理的方法:a.放一个酒精灯点燃
b.放一个气球收集
由于不同的金属的化学活动性不同,因此,常采用不同的冶炼方法。热还原法、电解法、热分解法等。
利用还原剂在高温下将金属从化合物中还原出来。
Fe2O3 + 3CO === 2Fe + 3CO2
WO3 + 3H2 === W + 3H2O
2CuO + C === 2Cu + CO2
高温
高温
高温
金属氧化物跟焦碳、氢气、一氧化碳等物质反应,失去氧转化为金属的过程称为金属氧化物的还原。
金属的常用冶炼方法
Fe2O3+3CO ==== 2Fe+3CO2
高温
Fe2O3+3H2 ==== 2Fe+3H2O
高温
2Fe2O3+3C ==== 4Fe+3CO2↑
高温
在金属活动性顺序中,K、Ca、Na、Al等活泼金属的还原性很强,都很容易失去电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,只能用通电分解其熔融盐或氧化物的方法来冶炼。
2Al2O3====4Al + 3O2↑ 2NaCl====2Na + Cl2↑
通电
通电
金属的常用冶炼方法
有关杂质问题的计算
例1、1000t含杂质20%的赤铁矿石中含氧化铁的质量是多少?
氧化铁的质量: 1000t× ( 1- 20% )=800t
纯物质的质量=不纯物质的质量×物质的质量分数
例2、计算多少吨生铁中含铁的质量分数为96%,
含铁560t?
生铁的质量: 560t÷96%=583.3t
不纯物质的质量=纯物质的质量÷物质的质量分数
例3:用1000t含氧化铁80%的赤铁矿石,理
论上可以炼出含铁96%的生铁多少吨?
注意:带入化学方程式计算的数据应是纯净物的质量
赤铁矿石—氧化铁—铁—生铁
1000t×80% ×70%÷96%=583.3t
生铁的质量:
第二节 金属矿物 铁的冶炼
原料
炼 铁 高 炉 的 结 构
工业炼铁
2.原料:
主要反应:
高炉
铁矿石、焦炭、空气、石灰石
①提供热源 ②提供CO
1.设备:
3.作用:
铁矿石:提供铁元素
焦炭:
空气:提供氧气
石灰石:将矿石中二氧化硅转成炉渣除去
Fe2O3 + 3CO === 2Fe + 3CO2
高温
以生铁为原料,利用氧气或铁的氧化物将一部分碳等杂质变为气体或炉渣而除去的过程。
目的:
降碳、调硅锰、除硫磷。
原理:
工业炼钢
一、实验室炼铁:
1、药品: Fe2O3 、CO
2、原理:Fe2O3 + 3CO = 2Fe+ 3CO2
高温
3、实验步骤:
(1)反应前先检查装置的____
(2)装入药品,连接好装置
(3)实验开始,先通CO气体,再点燃酒精灯加热
(4)观察氧化铁的颜色变化和石灰水的变化
(5)反应结束,先停止加热,后停止通CO气体
气密性
(CO:
早出晚归
酒精灯:
迟到早退)
A处:固体由红色变成黑色
B处:澄清石灰水变浑浊
C处:气体燃烧产生淡蓝色火焰
A
B
C
4、实验现象:
5、注意事项
(1)实验开始,先通CO气体,再点燃酒精灯加热目的:
排尽装置中的空气,以防加热时发生爆炸
(2)反应结束,先停止加热,后停止通CO气体目的:
防止铁在较高的温度下重新被氧化
(3)为什么要进行尾气处理?
因为CO有毒会污染空气
(4)对尾气处理的方法:a.放一个酒精灯点燃
b.放一个气球收集
由于不同的金属的化学活动性不同,因此,常采用不同的冶炼方法。热还原法、电解法、热分解法等。
利用还原剂在高温下将金属从化合物中还原出来。
Fe2O3 + 3CO === 2Fe + 3CO2
WO3 + 3H2 === W + 3H2O
2CuO + C === 2Cu + CO2
高温
高温
高温
金属氧化物跟焦碳、氢气、一氧化碳等物质反应,失去氧转化为金属的过程称为金属氧化物的还原。
金属的常用冶炼方法
Fe2O3+3CO ==== 2Fe+3CO2
高温
Fe2O3+3H2 ==== 2Fe+3H2O
高温
2Fe2O3+3C ==== 4Fe+3CO2↑
高温
在金属活动性顺序中,K、Ca、Na、Al等活泼金属的还原性很强,都很容易失去电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,只能用通电分解其熔融盐或氧化物的方法来冶炼。
2Al2O3====4Al + 3O2↑ 2NaCl====2Na + Cl2↑
通电
通电
金属的常用冶炼方法
有关杂质问题的计算
例1、1000t含杂质20%的赤铁矿石中含氧化铁的质量是多少?
氧化铁的质量: 1000t× ( 1- 20% )=800t
纯物质的质量=不纯物质的质量×物质的质量分数
例2、计算多少吨生铁中含铁的质量分数为96%,
含铁560t?
生铁的质量: 560t÷96%=583.3t
不纯物质的质量=纯物质的质量÷物质的质量分数
例3:用1000t含氧化铁80%的赤铁矿石,理
论上可以炼出含铁96%的生铁多少吨?
注意:带入化学方程式计算的数据应是纯净物的质量
赤铁矿石—氧化铁—铁—生铁
1000t×80% ×70%÷96%=583.3t
生铁的质量:
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
