高中化学人教版(2019)必修第一册4.3.1离子键(学案)(无答案)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册4.3.1离子键(学案)(无答案) | 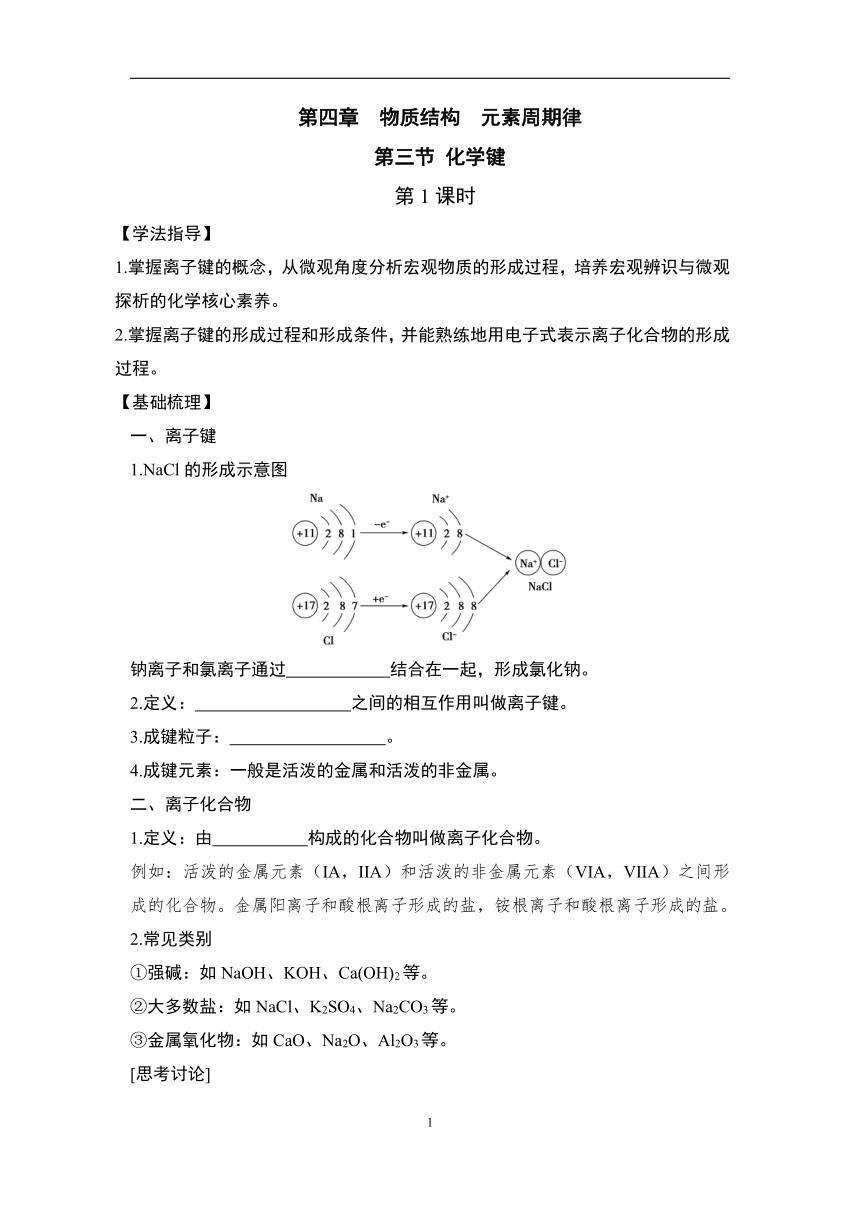 | |
| 格式 | docx | ||
| 文件大小 | 98.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 22:24:06 | ||
图片预览

文档简介
第四章 物质结构 元素周期律
第三节 化学键
第1课时
【学法指导】
1.掌握离子键的概念,从微观角度分析宏观物质的形成过程,培养宏观辨识与微观探析的化学核心素养。
2.掌握离子键的形成过程和形成条件,并能熟练地用电子式表示离子化合物的形成过程。
【基础梳理】
一、离子键
1.NaCl的形成示意图
钠离子和氯离子通过 结合在一起,形成氯化钠。
2.定义: 之间的相互作用叫做离子键。
3.成键粒子: 。
4.成键元素:一般是活泼的金属和活泼的非金属。
二、离子化合物
1.定义:由 构成的化合物叫做离子化合物。
例如:活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间形成的化合物。金属阳离子和酸根离子形成的盐,铵根离子和酸根离子形成的盐。
2.常见类别
①强碱:如NaOH、KOH、Ca(OH)2等。
②大多数盐:如NaCl、K2SO4、Na2CO3等。
③金属氧化物:如CaO、Na2O、Al2O3等。
[思考讨论]
离子化合物一定含金属元素吗?举例说明。
“离子化合物一定含有离子键,含有离子键的物质一定是离子化合物”。这种说法对吗
5.电子式
(1)概念:在元素符号周围用“·”或“×”来表示原子的 (价电子)排布的式子。
(2)电子式的书写
①原子的电子式:
②阳离子的电子式:Mg2+ 、Na+
③阴离子的电子式:画出最外层电子数,而且还应用于括号“[ ]” 括起来,并在右上角标出“n—”电荷字样。
Cl—: O2— :
(3)离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并。
NaCl
Na2O
MgCl2
4.用电子式表示离子化合物的形成过程。
书写要点:
1.生成物阴离子要用方括号[ ]括起来;相同离子不能合并写
2.形成符号“→” ;用箭头标明电子转移方向。
【课堂练习】
1.判断 (正确的打“√”,错误的打“×”)
(1)阴、阳离子之间的静电吸引形成离子键。 ( )
(2)金属与非金属形成的化合物一定为离子化合物。 ( )
(3)所有氧化物均为离子化合物。 ( )
(4)NaH为离子化合物,含有离子键。 ( )
2.有下列常见物质:①Na ②NaCl ③NaOH ④CaO ⑤Na2CO3 ⑥NaHCO3 ⑦CO2 ⑧H2SO4 ⑨Na2SO4 ⑩CaCl2
请思考探究下列问题
(1)含有离子键的物质有________(填序号,下同)。
(2)含有离子键的盐有________。
(3)属于离子化合物的有________。
3.下列各项中表达正确的是( )
CaH2的形成过程
4.下列物质中不含离子键的是( )
A.HCl B.NH4NO3 C.CaSO4 D.NaH
5.用电子式表示下列化合物的形成过程。
(1)碘化钙:___________________________________________。
(2)硫化钠:___________________________________________。
(3)氯化钾:___________________________________________。
2
第三节 化学键
第1课时
【学法指导】
1.掌握离子键的概念,从微观角度分析宏观物质的形成过程,培养宏观辨识与微观探析的化学核心素养。
2.掌握离子键的形成过程和形成条件,并能熟练地用电子式表示离子化合物的形成过程。
【基础梳理】
一、离子键
1.NaCl的形成示意图
钠离子和氯离子通过 结合在一起,形成氯化钠。
2.定义: 之间的相互作用叫做离子键。
3.成键粒子: 。
4.成键元素:一般是活泼的金属和活泼的非金属。
二、离子化合物
1.定义:由 构成的化合物叫做离子化合物。
例如:活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间形成的化合物。金属阳离子和酸根离子形成的盐,铵根离子和酸根离子形成的盐。
2.常见类别
①强碱:如NaOH、KOH、Ca(OH)2等。
②大多数盐:如NaCl、K2SO4、Na2CO3等。
③金属氧化物:如CaO、Na2O、Al2O3等。
[思考讨论]
离子化合物一定含金属元素吗?举例说明。
“离子化合物一定含有离子键,含有离子键的物质一定是离子化合物”。这种说法对吗
5.电子式
(1)概念:在元素符号周围用“·”或“×”来表示原子的 (价电子)排布的式子。
(2)电子式的书写
①原子的电子式:
②阳离子的电子式:Mg2+ 、Na+
③阴离子的电子式:画出最外层电子数,而且还应用于括号“[ ]” 括起来,并在右上角标出“n—”电荷字样。
Cl—: O2— :
(3)离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并。
NaCl
Na2O
MgCl2
4.用电子式表示离子化合物的形成过程。
书写要点:
1.生成物阴离子要用方括号[ ]括起来;相同离子不能合并写
2.形成符号“→” ;用箭头标明电子转移方向。
【课堂练习】
1.判断 (正确的打“√”,错误的打“×”)
(1)阴、阳离子之间的静电吸引形成离子键。 ( )
(2)金属与非金属形成的化合物一定为离子化合物。 ( )
(3)所有氧化物均为离子化合物。 ( )
(4)NaH为离子化合物,含有离子键。 ( )
2.有下列常见物质:①Na ②NaCl ③NaOH ④CaO ⑤Na2CO3 ⑥NaHCO3 ⑦CO2 ⑧H2SO4 ⑨Na2SO4 ⑩CaCl2
请思考探究下列问题
(1)含有离子键的物质有________(填序号,下同)。
(2)含有离子键的盐有________。
(3)属于离子化合物的有________。
3.下列各项中表达正确的是( )
CaH2的形成过程
4.下列物质中不含离子键的是( )
A.HCl B.NH4NO3 C.CaSO4 D.NaH
5.用电子式表示下列化合物的形成过程。
(1)碘化钙:___________________________________________。
(2)硫化钠:___________________________________________。
(3)氯化钾:___________________________________________。
2
