高中化学人教版(2019)必修第一册4.3.2共价键 分子间作用力(学案)(无答案)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册4.3.2共价键 分子间作用力(学案)(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 155.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 22:25:43 | ||
图片预览

文档简介
第四章 物质结构 元素周期律
第三节 化学键
第2课时
【学法指导】
1.理解共价键的概念,初步掌握共价键的形成,加深电子对的理解。
2.熟练掌握用电子式表示共价分子的形成过程和分子结构。
3.理解极性键、非极性键、化学键的概念。
【基础梳理】
一、共价键 共价化合物
1.共价键的形成过程
(1)氯分子的形成过程
→→→
用电子式表示其形成过程: 。
(2)共价键
①概念:原子间通过 所形成的相互作用。
②成键微粒: 。
③成键元素:一般是同种的或不同种的非金属元素。
④成键条件:成键前原子最外层电子未达到饱和状态。
⑤分类
(3)共价键的表示方法
①电子式:写出H2 、 N2 、 HCl 、 H2O 、 HF的电子式
②结构式:用一根短线表示一对共用电子对,表示如下:
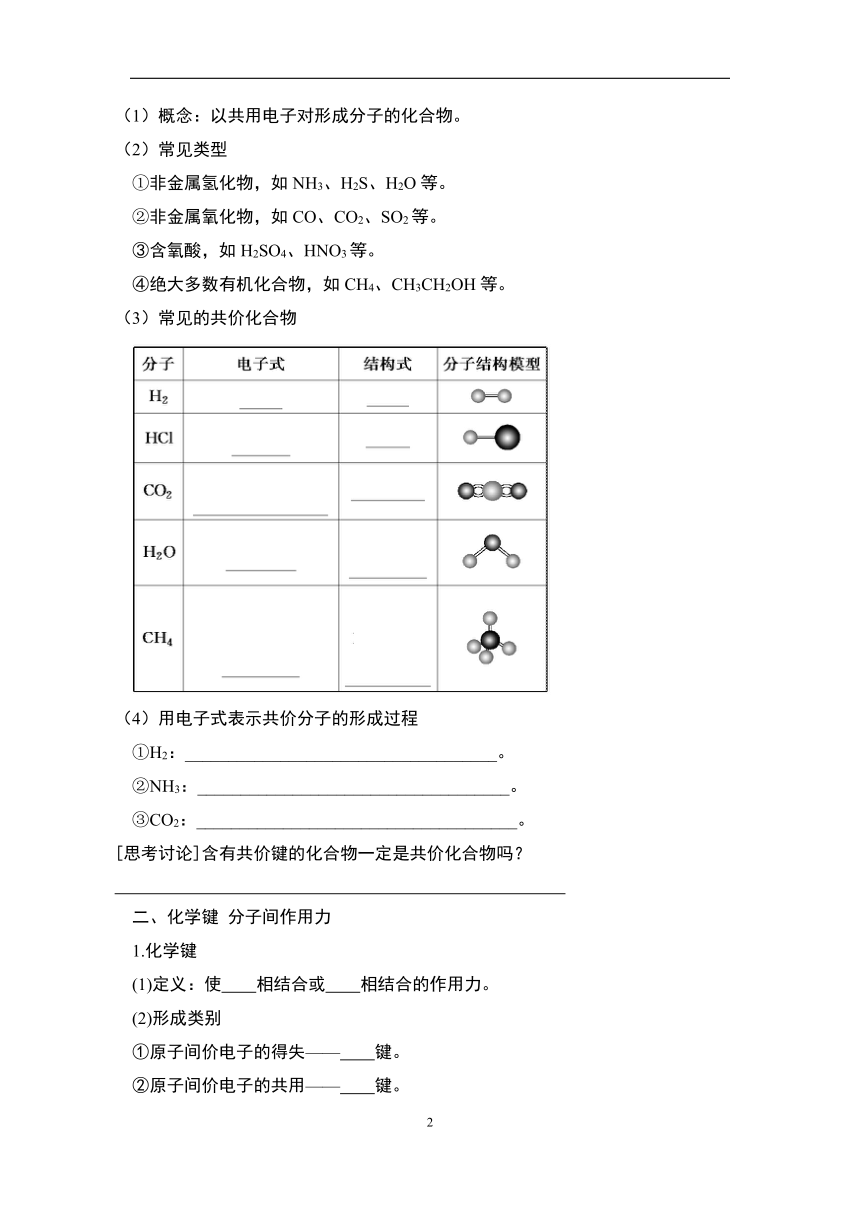
2.共价化合物
(1)概念:以共用电子对形成分子的化合物。
(2)常见类型
①非金属氢化物,如NH3、H2S、H2O等。
②非金属氧化物,如CO、CO2、SO2等。
③含氧酸,如H2SO4、HNO3等。
④绝大多数有机化合物,如CH4、CH3CH2OH等。
(3)常见的共价化合物
(4)用电子式表示共价分子的形成过程
①H2:____________________________________。
②NH3:____________________________________。
③CO2:_____________________________________。
[思考讨论]含有共价键的化合物一定是共价化合物吗?
二、化学键 分子间作用力
1.化学键
(1)定义:使 相结合或 相结合的作用力。
(2)形成类别
①原子间价电子的得失—— 键。
②原子间价电子的共用—— 键。
(3)化学反应的本质:一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
2.分子间作用力
(1)定义:把 聚集在一起的作用力叫做分子间作用力,又叫范德华力。
(2)特征:
①分子间作用力只存在于 之间,如共价化合物、某些非金属单质和稀有气体分子之间;
②分子间作用力比化学键 的多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
③一般说来,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越 ,物质的熔、沸点也就越 ,如卤素单质的熔沸点:F2<Cl2<Br2<I2。
3.氢键
(1)定义:分子间存在的一种比范德华力稍 的相互作用。
(2)形成条件:除H外,形成氢键的原子通常有 。
(3)氢键存在广泛,如、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点 。
【课堂练习】
1.下列叙述中,不正确的是( )
A.含有共价键的物质一定是共价化合物
B.H2O2中既含有极性键又含有非极性键
C.CaO和NaCl晶体熔化时要破坏离子键
D.H2SO4熔融态不导电
2.下列分子的电子式书写正确的是( )
A.氨气 B.四氯化碳
C.氮气 D.二氧化碳
3.关于化学键的下列叙述中,正确的是( )
①化学键只存在于分子之间 ②化学键只存在于相邻原子或离子之间 ③化学键是一种静电作用 ④化学键是相邻原子之间强烈的相互吸引 ⑤离子化合物可能含共价键 ⑥共价化合物可能含离子键 ⑦金属和非金属只能形成离子键 ⑧两个非金属和非金属原子间只能形成共价键
A.②③④⑦ B.②③⑤⑧ C.②④⑤⑥ D.①③⑤⑧
4.下列用电子式表示物质的形成过程,正确的是( )
C.
5.关于氢键,下列说法不正确的是( )
A.HF的沸点比HCl的沸点高是由于HF分子间存在氢键
B.水在结冰时体积膨胀,是由于水分子之间存在氢键
C.NH3的稳定性很强,是因为其分子间能形成氢键
D.在氨水中水分子和氨分子之间也存在着氢键
2
第三节 化学键
第2课时
【学法指导】
1.理解共价键的概念,初步掌握共价键的形成,加深电子对的理解。
2.熟练掌握用电子式表示共价分子的形成过程和分子结构。
3.理解极性键、非极性键、化学键的概念。
【基础梳理】
一、共价键 共价化合物
1.共价键的形成过程
(1)氯分子的形成过程
→→→
用电子式表示其形成过程: 。
(2)共价键
①概念:原子间通过 所形成的相互作用。
②成键微粒: 。
③成键元素:一般是同种的或不同种的非金属元素。
④成键条件:成键前原子最外层电子未达到饱和状态。
⑤分类
(3)共价键的表示方法
①电子式:写出H2 、 N2 、 HCl 、 H2O 、 HF的电子式
②结构式:用一根短线表示一对共用电子对,表示如下:
2.共价化合物
(1)概念:以共用电子对形成分子的化合物。
(2)常见类型
①非金属氢化物,如NH3、H2S、H2O等。
②非金属氧化物,如CO、CO2、SO2等。
③含氧酸,如H2SO4、HNO3等。
④绝大多数有机化合物,如CH4、CH3CH2OH等。
(3)常见的共价化合物
(4)用电子式表示共价分子的形成过程
①H2:____________________________________。
②NH3:____________________________________。
③CO2:_____________________________________。
[思考讨论]含有共价键的化合物一定是共价化合物吗?
二、化学键 分子间作用力
1.化学键
(1)定义:使 相结合或 相结合的作用力。
(2)形成类别
①原子间价电子的得失—— 键。
②原子间价电子的共用—— 键。
(3)化学反应的本质:一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
2.分子间作用力
(1)定义:把 聚集在一起的作用力叫做分子间作用力,又叫范德华力。
(2)特征:
①分子间作用力只存在于 之间,如共价化合物、某些非金属单质和稀有气体分子之间;
②分子间作用力比化学键 的多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
③一般说来,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越 ,物质的熔、沸点也就越 ,如卤素单质的熔沸点:F2<Cl2<Br2<I2。
3.氢键
(1)定义:分子间存在的一种比范德华力稍 的相互作用。
(2)形成条件:除H外,形成氢键的原子通常有 。
(3)氢键存在广泛,如、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点 。
【课堂练习】
1.下列叙述中,不正确的是( )
A.含有共价键的物质一定是共价化合物
B.H2O2中既含有极性键又含有非极性键
C.CaO和NaCl晶体熔化时要破坏离子键
D.H2SO4熔融态不导电
2.下列分子的电子式书写正确的是( )
A.氨气 B.四氯化碳
C.氮气 D.二氧化碳
3.关于化学键的下列叙述中,正确的是( )
①化学键只存在于分子之间 ②化学键只存在于相邻原子或离子之间 ③化学键是一种静电作用 ④化学键是相邻原子之间强烈的相互吸引 ⑤离子化合物可能含共价键 ⑥共价化合物可能含离子键 ⑦金属和非金属只能形成离子键 ⑧两个非金属和非金属原子间只能形成共价键
A.②③④⑦ B.②③⑤⑧ C.②④⑤⑥ D.①③⑤⑧
4.下列用电子式表示物质的形成过程,正确的是( )
C.
5.关于氢键,下列说法不正确的是( )
A.HF的沸点比HCl的沸点高是由于HF分子间存在氢键
B.水在结冰时体积膨胀,是由于水分子之间存在氢键
C.NH3的稳定性很强,是因为其分子间能形成氢键
D.在氨水中水分子和氨分子之间也存在着氢键
2
