第12章《盐》基础练习 九年级化学京改版(2013)下册(有答案)
文档属性
| 名称 | 第12章《盐》基础练习 九年级化学京改版(2013)下册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 167.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 20:43:36 | ||
图片预览



文档简介
第12章《盐》基础练习
一、单选题
1.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
2.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
3.下列物质的用途是利用其物理性质的是
A.煤用于发电
B.铜丝作导线
C.氮气作保护气
D.小苏打用于发酵
4.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
5.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
6.下列物质的化学式书写、俗名都正确的是( )
选项 名称 化学式 俗名
A 乙醇 CH3CH2OH 酒精
B 氧化钙 CaO 熟石灰
C 碳酸氢钠 Na2CO3 苏打
D 氯化钠 NaCl 食盐
A.A B.B C.C D.D
7.某同学将一定量的Na2CO3与Ba(OH)2溶液混合,要想检验反应后Ba(OH)2是否过量,应选用的试剂是( )
A.酚酞 B.CuCl2溶液 C.Na2CO3溶液 D.NaCl溶液
8.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
9.下列说法正确的是
A.洗洁精和汽油都能清洗油污,其原理相同
B.不饱和溶液转化为饱和溶液,溶质质量分数一定增大
C.某物质与熟石灰研磨,无刺激性气味,该物质一定不是氮肥
D.合金的硬度一般比各成分金属大,熔点一般比各成分金属低
10.某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液为酸性
B.b点恰好完全反应
C.c点溶液的溶质为硫酸
D.b、c两点沉淀质量相等
11.为鉴别失去标签的稀盐酸稀硫酸、NaOH和四种溶液,设计如下实验:
下面对试剂①、试剂②和试剂③的选择,合理的是( )
A.①酚酞 ②BaCl2 ③CuSO4
B.①酚酞 ②AgNO3 ③Na2CO3
C.①石蕊 ②BaCl2 ③Na2CO3
D.①石蕊 ②AgNO3 ③CuSO4
二、简答题
12.合理使用化肥可提高农作物产量。下图是生产尿素的微观示意图。回答问题。
(1)A物质中氮元素的化合价是_____。D物质的化学式是_____。
(2)下列与尿素不属于同类肥料的是_____。
A.NH4HCO3 B.NH4Cl C.K2SO4
13.认真分析下列各图,回答相关问题。
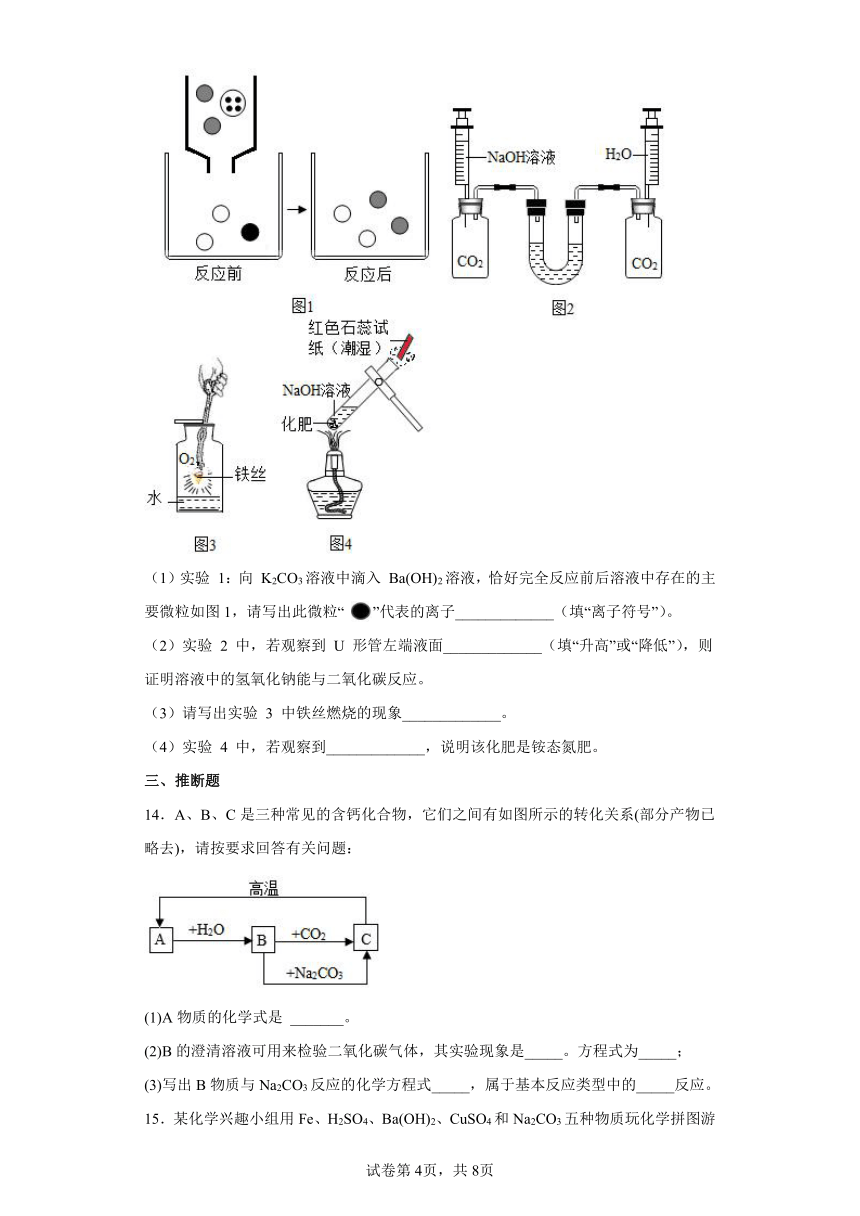
(1)实验 1:向 K2CO3溶液中滴入 Ba(OH)2溶液,恰好完全反应前后溶液中存在的主要微粒如图1,请写出此微粒“ ”代表的离子_____________(填“离子符号”)。
(2)实验 2 中,若观察到 U 形管左端液面_____________(填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应。
(3)请写出实验 3 中铁丝燃烧的现象_____________。
(4)实验 4 中,若观察到_____________,说明该化肥是铵态氮肥。
三、推断题
14.A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物已略去),请按要求回答有关问题:
(1)A物质的化学式是 _______。
(2)B的澄清溶液可用来检验二氧化碳气体,其实验现象是_____。方程式为_____;
(3)写出B物质与Na2CO3反应的化学方程式_____,属于基本反应类型中的_____反应。
15.某化学兴趣小组用Fe、H2SO4、Ba(OH)2、CuSO4和Na2CO3五种物质玩化学拼图游戏(见下图),游戏规则要求图中相邻物质之间能发生化学反应,其中 C 物质的溶液呈蓝色,A 与 E 反应产生的气体是光合作用的原料之一。
(1)A物质的俗称是____________,E物质的用途是____________。
(2)B与E反应的化学方程式为____________________;D与E反应的基本类型是______________。
(3)按游戏规则,CaCO3____________(填“能”或“不能”)替代A物质。
四、实验题
16.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
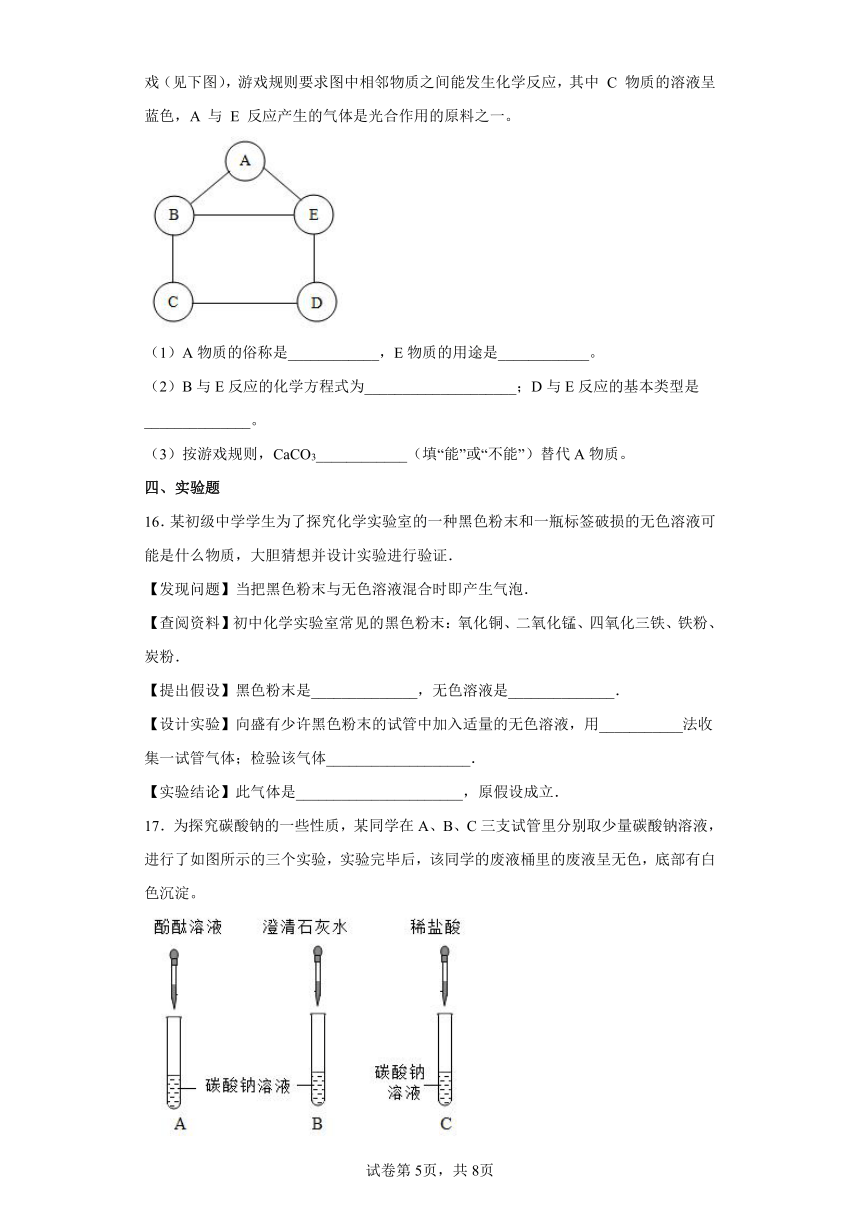
17.为探究碳酸钠的一些性质,某同学在A、B、C三支试管里分别取少量碳酸钠溶液,进行了如图所示的三个实验,实验完毕后,该同学的废液桶里的废液呈无色,底部有白色沉淀。
(1)根据以上情况推知试管C中哪种反应物有剩余_____?
(2)废液桶中一定含有什么溶质_____(除酚酞外)
(3)写出废液桶内一定发生的反应的化学方程式_____(写一个即可)。
18.碳酸钙是一种常见的物质,在自然界中分布很广。
①检验甲、乙和丙三种均含钙元素的物质中是否含有碳酸钙。取三种物质各xg,分别进行如下实验。
现象 物质 甲 乙 丙
I中是否产生气体 否 是 是
II中是否产生沉淀 否 是 否
结论:含有碳酸钙的物质是______(选填“甲”、“乙”或“丙”)。
将xg丙磨成粉末,重复上述实验,观察到的现象是______(选填编号)。
a I中产生气体的量更多 b I中产生气泡的速率更快 c II中产生沉淀
②用石灰石为原料制取二氧化碳。
I实验室制取二氧化碳的化学方程式是______。
II搭建具有启普发生器功能的简易装置,除了长颈漏斗、多孔隔板、橡胶塞、导管、乳胶管、弹簧夹之外,下图可做反应容器的是______(选填编号)。
有同学搭建了如图装置,要使该装置也具有启普发生器的功能,需将块状石灰石放置在______(选填“A”或“B”)处。
III用向上排气法收集二氧化碳,是因为二氧化碳______。
五、计算题
19.草木灰是农家肥料,其主要成分是碳酸钾。某化学兴趣小组进行如下实验,以下是他们的实验过程及数据(假设杂质不与稀盐酸反应,生成的气体全部逸出)。请你回答下列问题:
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为______。
(2)反应生成的气体质量为________g。
(3)稀盐酸中溶质质量分数是______?
20.某兴趣小组的同学进行纯碱样品(杂质仅含NaCl)中质量分数的测定,主要测定流程如下图:
(1)请指出图中过滤操作中的一处错误__________;
(2)若称取样品质量为6.0g,反应后称量烘干沉淀质量为5.5g,请计算纯碱样品中质量分数。(精确到0.01%)__________
21.向160g含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,产生的沉淀质量与加入NaOH 溶液质量的关系如图所示,请写出b点对应溶液的溶质______ (填写化学式),原混合溶液中CuSO4的质量分数是多少?
22.某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。试回答:
(1)生成CO2的质量_____。
(2)22.8g样品中氯化钠的质量为_____。
(3)计算所得溶液中溶质的质量分数_________。(写出解题过程,计算结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.B
4.C
5.C
6.A
7.C
8.C
9.D
10.C
11.C
12. -3; H2O; C
13. CO32- 升高 剧烈燃烧,火星四射,放出热量,生成黑色固体 红色石蕊试纸变蓝
14.(1)CaO
(2) 澄清溶液变浑浊
(3) 复分解
15. 纯碱或苏打 除锈或生产化肥等 Ba(OH)2+H2SO4=BaSO4↓+2H2O 置换反应 不能
16. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
17. 稀盐酸 氯化钠 (或)
18. 乙 b ac A 二氧化碳能溶于水、密度比空气大
19.(1)39:6:24;(2)8.8g;(3)14.6%
20.(1)没有用玻璃棒引流(2)97.17%
21.Na2SO4;10%
向含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,氢氧化钠先与硫酸反应生成硫酸钠和水,待硫酸完全反应后,氢氧化钠再与硫酸铜反应生成氢氧化铜和硫酸钠,b点时,恰好完全反应,故b点对应溶液的溶质是:Na2SO4;
设原混合溶液中CuSO4的质量分数是x,则
x=10%。
答:硫酸铜溶质质量分数为10%。
22.(1)由图象和质量守恒定律可知,生成二氧化碳的质量为:178.8g﹣170.0g=8.8g;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
解得:x=21.2g,y=23.4g,
22.8g样品中氯化钠的质量为:22.8g﹣21.2g=1.6g
(3)完全反应后所得氯化钠溶液的溶质质量分数14.7%
故答为:(1)8.8;
(2)22.8g样品中氯化钠的质量为1.6g;
(3)所得溶液中溶质的质量分数为14.7%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
2.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
3.下列物质的用途是利用其物理性质的是
A.煤用于发电
B.铜丝作导线
C.氮气作保护气
D.小苏打用于发酵
4.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
5.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
6.下列物质的化学式书写、俗名都正确的是( )
选项 名称 化学式 俗名
A 乙醇 CH3CH2OH 酒精
B 氧化钙 CaO 熟石灰
C 碳酸氢钠 Na2CO3 苏打
D 氯化钠 NaCl 食盐
A.A B.B C.C D.D
7.某同学将一定量的Na2CO3与Ba(OH)2溶液混合,要想检验反应后Ba(OH)2是否过量,应选用的试剂是( )
A.酚酞 B.CuCl2溶液 C.Na2CO3溶液 D.NaCl溶液
8.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
9.下列说法正确的是
A.洗洁精和汽油都能清洗油污,其原理相同
B.不饱和溶液转化为饱和溶液,溶质质量分数一定增大
C.某物质与熟石灰研磨,无刺激性气味,该物质一定不是氮肥
D.合金的硬度一般比各成分金属大,熔点一般比各成分金属低
10.某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液为酸性
B.b点恰好完全反应
C.c点溶液的溶质为硫酸
D.b、c两点沉淀质量相等
11.为鉴别失去标签的稀盐酸稀硫酸、NaOH和四种溶液,设计如下实验:
下面对试剂①、试剂②和试剂③的选择,合理的是( )
A.①酚酞 ②BaCl2 ③CuSO4
B.①酚酞 ②AgNO3 ③Na2CO3
C.①石蕊 ②BaCl2 ③Na2CO3
D.①石蕊 ②AgNO3 ③CuSO4
二、简答题
12.合理使用化肥可提高农作物产量。下图是生产尿素的微观示意图。回答问题。
(1)A物质中氮元素的化合价是_____。D物质的化学式是_____。
(2)下列与尿素不属于同类肥料的是_____。
A.NH4HCO3 B.NH4Cl C.K2SO4
13.认真分析下列各图,回答相关问题。
(1)实验 1:向 K2CO3溶液中滴入 Ba(OH)2溶液,恰好完全反应前后溶液中存在的主要微粒如图1,请写出此微粒“ ”代表的离子_____________(填“离子符号”)。
(2)实验 2 中,若观察到 U 形管左端液面_____________(填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应。
(3)请写出实验 3 中铁丝燃烧的现象_____________。
(4)实验 4 中,若观察到_____________,说明该化肥是铵态氮肥。
三、推断题
14.A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物已略去),请按要求回答有关问题:
(1)A物质的化学式是 _______。
(2)B的澄清溶液可用来检验二氧化碳气体,其实验现象是_____。方程式为_____;
(3)写出B物质与Na2CO3反应的化学方程式_____,属于基本反应类型中的_____反应。
15.某化学兴趣小组用Fe、H2SO4、Ba(OH)2、CuSO4和Na2CO3五种物质玩化学拼图游戏(见下图),游戏规则要求图中相邻物质之间能发生化学反应,其中 C 物质的溶液呈蓝色,A 与 E 反应产生的气体是光合作用的原料之一。
(1)A物质的俗称是____________,E物质的用途是____________。
(2)B与E反应的化学方程式为____________________;D与E反应的基本类型是______________。
(3)按游戏规则,CaCO3____________(填“能”或“不能”)替代A物质。
四、实验题
16.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
17.为探究碳酸钠的一些性质,某同学在A、B、C三支试管里分别取少量碳酸钠溶液,进行了如图所示的三个实验,实验完毕后,该同学的废液桶里的废液呈无色,底部有白色沉淀。
(1)根据以上情况推知试管C中哪种反应物有剩余_____?
(2)废液桶中一定含有什么溶质_____(除酚酞外)
(3)写出废液桶内一定发生的反应的化学方程式_____(写一个即可)。
18.碳酸钙是一种常见的物质,在自然界中分布很广。
①检验甲、乙和丙三种均含钙元素的物质中是否含有碳酸钙。取三种物质各xg,分别进行如下实验。
现象 物质 甲 乙 丙
I中是否产生气体 否 是 是
II中是否产生沉淀 否 是 否
结论:含有碳酸钙的物质是______(选填“甲”、“乙”或“丙”)。
将xg丙磨成粉末,重复上述实验,观察到的现象是______(选填编号)。
a I中产生气体的量更多 b I中产生气泡的速率更快 c II中产生沉淀
②用石灰石为原料制取二氧化碳。
I实验室制取二氧化碳的化学方程式是______。
II搭建具有启普发生器功能的简易装置,除了长颈漏斗、多孔隔板、橡胶塞、导管、乳胶管、弹簧夹之外,下图可做反应容器的是______(选填编号)。
有同学搭建了如图装置,要使该装置也具有启普发生器的功能,需将块状石灰石放置在______(选填“A”或“B”)处。
III用向上排气法收集二氧化碳,是因为二氧化碳______。
五、计算题
19.草木灰是农家肥料,其主要成分是碳酸钾。某化学兴趣小组进行如下实验,以下是他们的实验过程及数据(假设杂质不与稀盐酸反应,生成的气体全部逸出)。请你回答下列问题:
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为______。
(2)反应生成的气体质量为________g。
(3)稀盐酸中溶质质量分数是______?
20.某兴趣小组的同学进行纯碱样品(杂质仅含NaCl)中质量分数的测定,主要测定流程如下图:
(1)请指出图中过滤操作中的一处错误__________;
(2)若称取样品质量为6.0g,反应后称量烘干沉淀质量为5.5g,请计算纯碱样品中质量分数。(精确到0.01%)__________
21.向160g含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,产生的沉淀质量与加入NaOH 溶液质量的关系如图所示,请写出b点对应溶液的溶质______ (填写化学式),原混合溶液中CuSO4的质量分数是多少?
22.某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。试回答:
(1)生成CO2的质量_____。
(2)22.8g样品中氯化钠的质量为_____。
(3)计算所得溶液中溶质的质量分数_________。(写出解题过程,计算结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.B
4.C
5.C
6.A
7.C
8.C
9.D
10.C
11.C
12. -3; H2O; C
13. CO32- 升高 剧烈燃烧,火星四射,放出热量,生成黑色固体 红色石蕊试纸变蓝
14.(1)CaO
(2) 澄清溶液变浑浊
(3) 复分解
15. 纯碱或苏打 除锈或生产化肥等 Ba(OH)2+H2SO4=BaSO4↓+2H2O 置换反应 不能
16. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
17. 稀盐酸 氯化钠 (或)
18. 乙 b ac A 二氧化碳能溶于水、密度比空气大
19.(1)39:6:24;(2)8.8g;(3)14.6%
20.(1)没有用玻璃棒引流(2)97.17%
21.Na2SO4;10%
向含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,氢氧化钠先与硫酸反应生成硫酸钠和水,待硫酸完全反应后,氢氧化钠再与硫酸铜反应生成氢氧化铜和硫酸钠,b点时,恰好完全反应,故b点对应溶液的溶质是:Na2SO4;
设原混合溶液中CuSO4的质量分数是x,则
x=10%。
答:硫酸铜溶质质量分数为10%。
22.(1)由图象和质量守恒定律可知,生成二氧化碳的质量为:178.8g﹣170.0g=8.8g;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
解得:x=21.2g,y=23.4g,
22.8g样品中氯化钠的质量为:22.8g﹣21.2g=1.6g
(3)完全反应后所得氯化钠溶液的溶质质量分数14.7%
故答为:(1)8.8;
(2)22.8g样品中氯化钠的质量为1.6g;
(3)所得溶液中溶质的质量分数为14.7%。
答案第1页,共2页
答案第1页,共2页
