第九单元溶液练习题 九年级化学人教版下册(有答案)
文档属性
| 名称 | 第九单元溶液练习题 九年级化学人教版下册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 130.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 21:55:11 | ||
图片预览

文档简介
第九单元溶液练习题 九年级化学人教版下册
一、单选题
1.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
2.下列物质不属于溶液的是( )
A.冰水 B.碘酒 C.食盐水 D.浓盐酸
3.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
4.泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液浓度偏小的是
①称量好的食盐倒入烧杯时,有少许洒出
②量水的体积时,俯视量筒
③溶解食盐的烧杯内壁是潮湿的
④用4g食盐和100g水配制溶液
A.②③ B.①③④ C.①②③ D.①②③④
5.下列事实能说明铝的金属活动性比铁或铜强的是
A.铝在地壳中含量比铁高 B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀 D.铝丝在硫酸铜溶液中能形成“铜树”
6.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
7.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是
①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
8.下列有关溶液的说法正确的是
A.配制溶液时,搅拌可以增大一定溶剂中固体溶质的溶解质量
B.具有均一性、稳定性的液体一定是溶液
C.饱和溶液浓度一定比不饱和溶液的浓度大
D.融雪剂的原理是利用某些物质水溶液的凝固点低于0℃
9.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
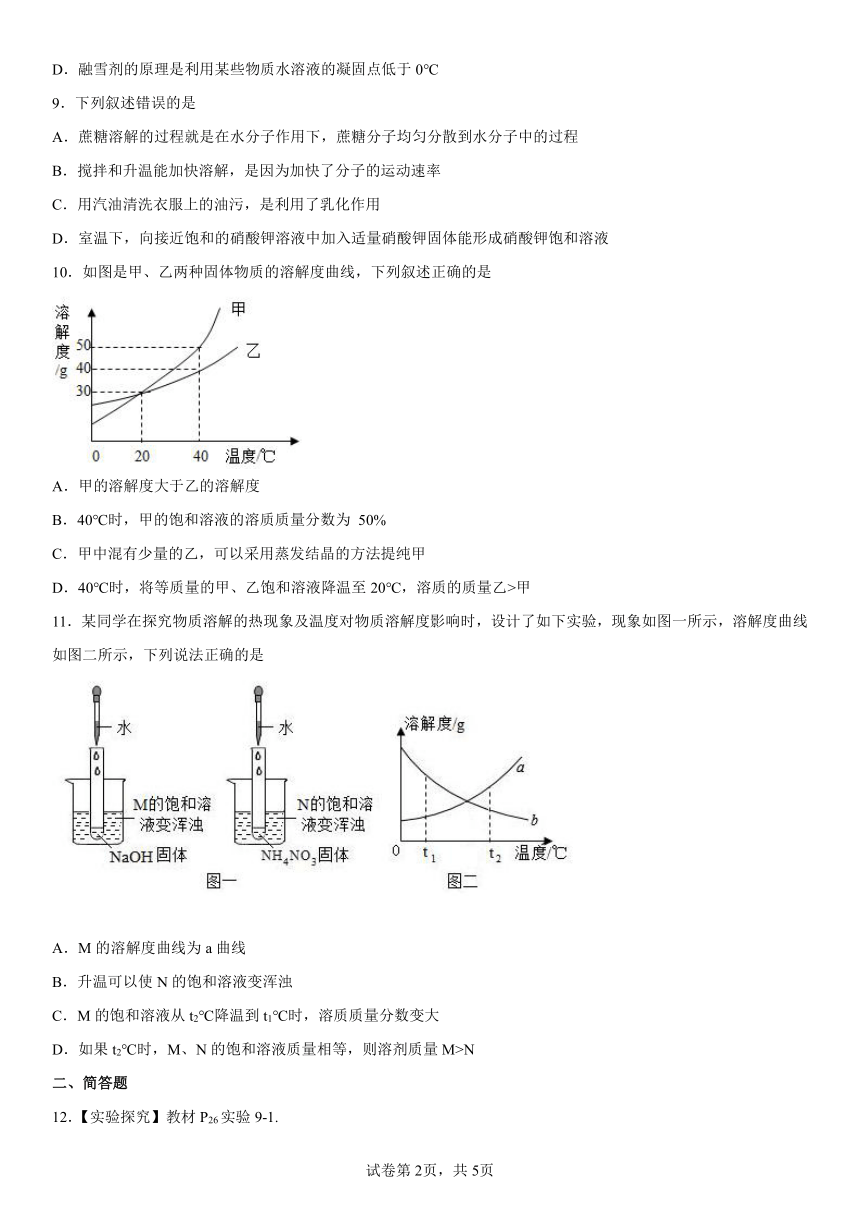
10.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
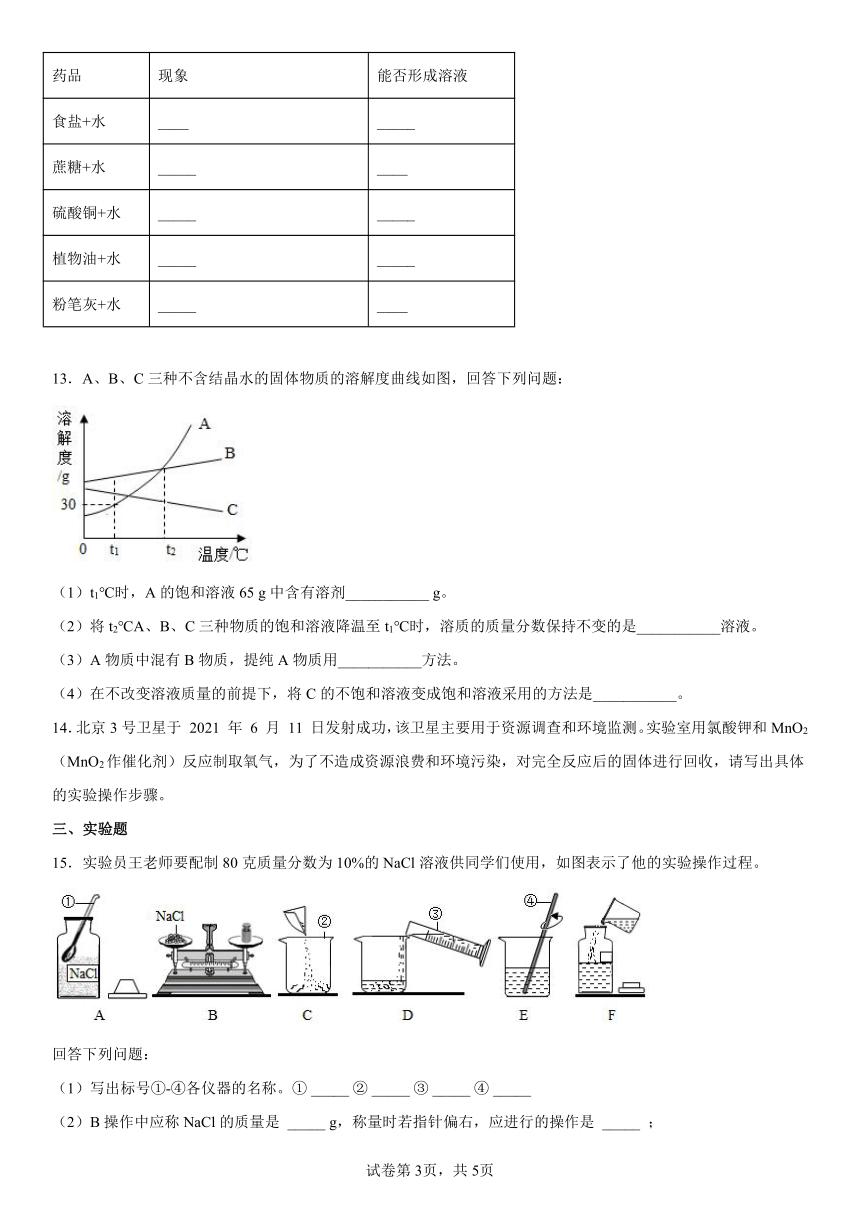
11.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
二、简答题
12.【实验探究】教材P26实验9-1.
药品 现象 能否形成溶液
食盐+水 ____ _____
蔗糖+水 _____ ____
硫酸铜+水 _____ _____
植物油+水 _____ _____
粉笔灰+水 _____ ____
13.A、B、C三种不含结晶水的固体物质的溶解度曲线如图,回答下列问题:
(1)t1℃时,A的饱和溶液65 g中含有溶剂___________ g。
(2)将t2℃A、B、C三种物质的饱和溶液降温至t1℃时,溶质的质量分数保持不变的是___________溶液。
(3)A物质中混有B物质,提纯A物质用___________方法。
(4)在不改变溶液质量的前提下,将C的不饱和溶液变成饱和溶液采用的方法是___________。
14.北京3号卫星于 2021 年 6 月 11 日发射成功,该卫星主要用于资源调查和环境监测。实验室用氯酸钾和MnO2(MnO2作催化剂)反应制取氧气,为了不造成资源浪费和环境污染,对完全反应后的固体进行回收,请写出具体的实验操作步骤。
三、实验题
15.实验员王老师要配制80克质量分数为10%的NaCl溶液供同学们使用,如图表示了他的实验操作过程。
回答下列问题:
(1)写出标号①-④各仪器的名称。① _____ ② _____ ③ _____ ④ _____
(2)B操作中应称NaCl的质量是 _____ g,称量时若指针偏右,应进行的操作是 _____ ;
(3)D操作中仪器③的规格应是 _____ (选填“50ml”或“100ml”),读数时应使视线与 _____ ;
(4)E操作中④的作用是 _____ ;
(5)下列错误操作可能导致溶质的质量分数偏小的是 _____ (填序号);
①B操作中砝码与NaCl放颠倒了 ②D操作中仰视凹液面最低处读数;
③D操作中有少量水溅出 ④F操作中溶液洒落。
(6)配制该溶液的正确步骤应是 _____ (填序号)。
16.从下图选择仪器,配置100g溶质质量分数为5%的NaCl溶液。
(1)需要称量NaCl的质量为_______g。
(2)称量好的NaCl应倒入________中(写仪器名称)。
(3)从配置好的100gNaCl溶液中倒出20g,这20g溶液溶质质量分数为________。
17.现配制50g溶质质量分数为15%的氯化钠溶液。
(1)配制50g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量为______g;
(2)操作步骤如图所示:
①上述操作步骤的正确顺序是______(填字母序号);
②B操作过程中若天平指针向左偏转,则应______,直至指针指向分度盘中间;
(3)下列错误操作可能导致溶质质量分数小于15%的是______(填序号)。
①所称取的氯化钠固体不纯
②向烧杯中倒水溶解时部分水酒出
③装瓶时部分溶液洒出
④量取水时仰视读数
四、计算题
18.今年我国多地发生非洲猪瘟疫情。为防止疫情发生扩散,防疫人员使用了多种消毒剂对疫区进行环境消毒,其中亚氯酸钠(NaClO2)是一种重要的消毒剂。试计算:
(1)亚氯酸钠的相对分子质量为 。
(2)亚氯酸钠中的Na、Cl、O元素质量比为 。
(3)亚氯酸钠中氧元素的质量分数为 (精确到0.1%)。
(4)若要配制质量分数为15%的亚氯酸钠溶液200kg用于环境消毒,则需要亚氯酸钠 kg,同时需要水 kg。
19.某研究性学习小组称取含NaCl的Na2CO3固体25 g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到 8.8 g CO2气体。
(1)计算原固体中Na2CO3的质量分数和消耗稀盐酸的总质量(写出计算过程)。
(2)下表为研究性学习小组向上述配制的混合液中分三次逐滴加入(边加边振荡)稀盐酸后所记录的部分数据。经查阅资料知Na2CO3与HCl反应可以分两步进行:Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑。
①请完成表格中未填的部分。
实验次数 每次产生的CO2的质量/g
第一次先逐滴滴加稀盐酸100 g ________
第二次再逐滴滴加稀盐酸100 g 8.8
第三次再逐滴滴加稀盐酸100 g 0
②根据表中数据在坐标系中画出CO2的质量(纵坐标)与所加入稀盐酸的质量(横坐标)的关系图。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.A
4.B
5.D
6.D
7.A
8.D
9.C
10.D
11.D
12. 完全溶解 能 完全溶解 能 完全溶解 能 水油分层 否 粉笔灰沉入水底,出现沉淀 否
13. 50 C 降温结晶 升高温度
14.加足量水溶解、过滤,将滤渣洗涤、干燥得到二氧化锰,滤液蒸发结晶得到氯化钾。
15. 药匙 烧杯 量筒 玻璃棒 8 增加左盘中的NaCl 100ml 凹液面的最低处保持水平 用于搅拌、加快NaCl溶解速率 ①② ABCDEF
16. 5 烧杯 5%
17.(1)7.5
(2) EBACD 减少氯化钠的量
(3)①④
18.(1)90.5(2)46:71:64(3)35.4%(4)30;170
19.(1)84.8%;200 g;(2)①0;②
答案第1页,共2页
答案第1页,共2页
一、单选题
1.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
2.下列物质不属于溶液的是( )
A.冰水 B.碘酒 C.食盐水 D.浓盐酸
3.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
4.泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液浓度偏小的是
①称量好的食盐倒入烧杯时,有少许洒出
②量水的体积时,俯视量筒
③溶解食盐的烧杯内壁是潮湿的
④用4g食盐和100g水配制溶液
A.②③ B.①③④ C.①②③ D.①②③④
5.下列事实能说明铝的金属活动性比铁或铜强的是
A.铝在地壳中含量比铁高 B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀 D.铝丝在硫酸铜溶液中能形成“铜树”
6.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
7.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是
①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
8.下列有关溶液的说法正确的是
A.配制溶液时,搅拌可以增大一定溶剂中固体溶质的溶解质量
B.具有均一性、稳定性的液体一定是溶液
C.饱和溶液浓度一定比不饱和溶液的浓度大
D.融雪剂的原理是利用某些物质水溶液的凝固点低于0℃
9.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
10.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
11.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
二、简答题
12.【实验探究】教材P26实验9-1.
药品 现象 能否形成溶液
食盐+水 ____ _____
蔗糖+水 _____ ____
硫酸铜+水 _____ _____
植物油+水 _____ _____
粉笔灰+水 _____ ____
13.A、B、C三种不含结晶水的固体物质的溶解度曲线如图,回答下列问题:
(1)t1℃时,A的饱和溶液65 g中含有溶剂___________ g。
(2)将t2℃A、B、C三种物质的饱和溶液降温至t1℃时,溶质的质量分数保持不变的是___________溶液。
(3)A物质中混有B物质,提纯A物质用___________方法。
(4)在不改变溶液质量的前提下,将C的不饱和溶液变成饱和溶液采用的方法是___________。
14.北京3号卫星于 2021 年 6 月 11 日发射成功,该卫星主要用于资源调查和环境监测。实验室用氯酸钾和MnO2(MnO2作催化剂)反应制取氧气,为了不造成资源浪费和环境污染,对完全反应后的固体进行回收,请写出具体的实验操作步骤。
三、实验题
15.实验员王老师要配制80克质量分数为10%的NaCl溶液供同学们使用,如图表示了他的实验操作过程。
回答下列问题:
(1)写出标号①-④各仪器的名称。① _____ ② _____ ③ _____ ④ _____
(2)B操作中应称NaCl的质量是 _____ g,称量时若指针偏右,应进行的操作是 _____ ;
(3)D操作中仪器③的规格应是 _____ (选填“50ml”或“100ml”),读数时应使视线与 _____ ;
(4)E操作中④的作用是 _____ ;
(5)下列错误操作可能导致溶质的质量分数偏小的是 _____ (填序号);
①B操作中砝码与NaCl放颠倒了 ②D操作中仰视凹液面最低处读数;
③D操作中有少量水溅出 ④F操作中溶液洒落。
(6)配制该溶液的正确步骤应是 _____ (填序号)。
16.从下图选择仪器,配置100g溶质质量分数为5%的NaCl溶液。
(1)需要称量NaCl的质量为_______g。
(2)称量好的NaCl应倒入________中(写仪器名称)。
(3)从配置好的100gNaCl溶液中倒出20g,这20g溶液溶质质量分数为________。
17.现配制50g溶质质量分数为15%的氯化钠溶液。
(1)配制50g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量为______g;
(2)操作步骤如图所示:
①上述操作步骤的正确顺序是______(填字母序号);
②B操作过程中若天平指针向左偏转,则应______,直至指针指向分度盘中间;
(3)下列错误操作可能导致溶质质量分数小于15%的是______(填序号)。
①所称取的氯化钠固体不纯
②向烧杯中倒水溶解时部分水酒出
③装瓶时部分溶液洒出
④量取水时仰视读数
四、计算题
18.今年我国多地发生非洲猪瘟疫情。为防止疫情发生扩散,防疫人员使用了多种消毒剂对疫区进行环境消毒,其中亚氯酸钠(NaClO2)是一种重要的消毒剂。试计算:
(1)亚氯酸钠的相对分子质量为 。
(2)亚氯酸钠中的Na、Cl、O元素质量比为 。
(3)亚氯酸钠中氧元素的质量分数为 (精确到0.1%)。
(4)若要配制质量分数为15%的亚氯酸钠溶液200kg用于环境消毒,则需要亚氯酸钠 kg,同时需要水 kg。
19.某研究性学习小组称取含NaCl的Na2CO3固体25 g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到 8.8 g CO2气体。
(1)计算原固体中Na2CO3的质量分数和消耗稀盐酸的总质量(写出计算过程)。
(2)下表为研究性学习小组向上述配制的混合液中分三次逐滴加入(边加边振荡)稀盐酸后所记录的部分数据。经查阅资料知Na2CO3与HCl反应可以分两步进行:Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑。
①请完成表格中未填的部分。
实验次数 每次产生的CO2的质量/g
第一次先逐滴滴加稀盐酸100 g ________
第二次再逐滴滴加稀盐酸100 g 8.8
第三次再逐滴滴加稀盐酸100 g 0
②根据表中数据在坐标系中画出CO2的质量(纵坐标)与所加入稀盐酸的质量(横坐标)的关系图。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.A
4.B
5.D
6.D
7.A
8.D
9.C
10.D
11.D
12. 完全溶解 能 完全溶解 能 完全溶解 能 水油分层 否 粉笔灰沉入水底,出现沉淀 否
13. 50 C 降温结晶 升高温度
14.加足量水溶解、过滤,将滤渣洗涤、干燥得到二氧化锰,滤液蒸发结晶得到氯化钾。
15. 药匙 烧杯 量筒 玻璃棒 8 增加左盘中的NaCl 100ml 凹液面的最低处保持水平 用于搅拌、加快NaCl溶解速率 ①② ABCDEF
16. 5 烧杯 5%
17.(1)7.5
(2) EBACD 减少氯化钠的量
(3)①④
18.(1)90.5(2)46:71:64(3)35.4%(4)30;170
19.(1)84.8%;200 g;(2)①0;②
答案第1页,共2页
答案第1页,共2页
同课章节目录
