第五单元课题1质量守恒定律第2课时课件-2022-2023学年九年级化学人教版上册(共29张PPT)
文档属性
| 名称 | 第五单元课题1质量守恒定律第2课时课件-2022-2023学年九年级化学人教版上册(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-14 23:27:02 | ||
图片预览







文档简介
(共29张PPT)
质量守恒定律(第2课时)
人教版九年级化学上册第五单元《化学方程式》
不要遗漏任何
反应物和生成物
温
故
知
新
质量守恒定律
参加化学反应的各物质的质量总和
等于反应后生成的各物质的质量总和
没有参加反应的物质不包括在内
含 义
适
用
一切化学反应
实 质
反应前后原子的种类、数目、质量不变
应
用
一、质量守恒定律的应用
(1) 考查应用范围
(2) 简答(解释化学反应中有关实验事实)
(3) 确定物质的化学式
(4) 推断物质的组成
(5) 计算物质的质量(化学反应类型)
B
(1)考查应用范围
1.下列说法符合质量守恒定律的是( )
A.雨过天晴后马路上的水很快蒸发
B.澄清石灰水露置在空气中变重
C.打开盛酒精的试剂瓶的瓶盖,酒精质量变小
D.炭块研磨成炭粉,质量不变
2.下列有关质量守恒定律的理解正确的是( )
A.100ml水和100mL酒精混合后,体积是200mL
B.将5gA和5gB混合发生化合反应,一定能生成10gC
C.木炭燃烧后质量减少了,这个化学反应不遵守质量守恒定律
D.铁丝燃烧后生成物的质量增加,是因为有氧气参加了反应
D
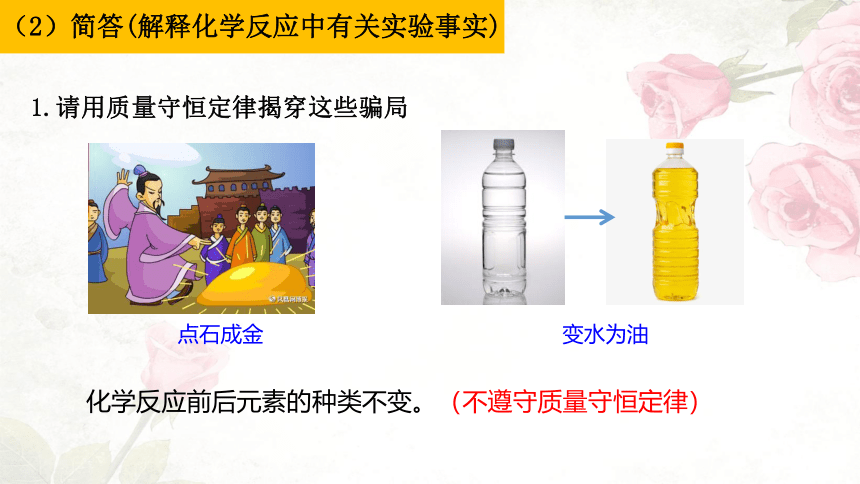
点石成金
化学反应前后元素的种类不变。(不遵守质量守恒定律)
1.请用质量守恒定律揭穿这些骗局
变水为油
(2)简答(解释化学反应中有关实验事实)
2.根据质量守恒定律解释现象 (教材P98,第3题)
参加反应的铜和氧气的质量总和等于反应生成氧化铜的质量。
纸燃烧生成CO2和水蒸气逸散到了空气中。
反应生成的氧气逸出。
(1)铜粉在空气中加热后,生成物的质量比原来铜粉的质量增大
(2)纸在空气中燃烧后化为灰烬,灰烬的质量比原来纸的质量减小
(3)高锰酸钾受热分解之后,剩余固体的质量i原反应物的质量减小
B
依据是:在化学反应两边各种原子的种类和数目必须相等。
(3)确定物质的化学式
1.硝酸银受热时会发生如下反应 2AgNO3 ═ 2Ag + 2X + O2 。根据质量守恒定律,推测X的是( )
A.N20 B.N02 C.N2O5 D.NO
△
C
(4)推断物质的元素组成
1.植物的光合作用可表示为:CO2 + H2O 淀粉 + 02 ,下列关于淀粉组成的说法正确的是( )
A.只含有碳、氢元素 B.含有碳、氢、氧三种元素
C.还有碳、氢元素,可能含有氧元素 D.无法确定
2.某化合物R在纯氧中充分燃烧后,只生成水和二氧化碳,则该化合物的组成中( )
A.只含有碳元素
B.只含有氢元素
C.一定含有碳元素和氢元素,可能含有氧元素
D.一定含有碳、氢、氧三种元素
C
B
(4)断物质的组成
B
1.5
0.6
(5)计算物质的质量
3.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后
测得有关数据如表:
下列说法中,不正确的是( )
A.反应后物质甲的质量为13 g B.乙是反应物
C.参与反应的乙、丁的质量比为5:4 D.物质丙可能是该反应的催化剂
物质 甲 乙 丙 丁
反应前的质量/g 18 1 2 32
反应后的质量/g x 26 2 12
B
(5)计算物质的质量
A.x的数值为3
B.该反应为分解反应
C.丙一定是该反应的催化剂
D.参加反应的乙和丁质量比为 3∶2
4.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图。下列说法中不正确的是( )
C
(5)计算物质的质量
易错提醒:质量比是指参加反应的物质质量比,不包括未参加反应的物质
或反应剩余物的质量。
A.丁一定不是单质
B.乙可能是这个反应的催化剂
C.反应中甲、丁的质量变化之比为1∶9
D.丙的相对分子质量一定是甲的8倍
5.在一定的条件下,甲、乙、丙、丁四种物质在密闭容器内充分反应,测得反应前后各物质的质量分数如图所示。下列说法中不正确的是( )
D
(5)计算物质的质量
木炭在氧气中燃烧反应的文字表达式为:
碳 + 氧气 二氧化碳
点燃
和
反应条件
生成
反应物
生成物
用化学式表示:
1.化学方程式:用_______来表示化学反应的式子。
化学式
C + O2 CO2
一、化学方程式
化学方程式
反应条件
质的 意义 反应物
生成物
氢气和氧气
水
通电
二氧化碳
碳和氧气
点燃
2.化学方程式表示的意义 【以 为例】
(1)读作: 和 在 的条件下生成 。
碳
氧气
点燃
二氧化碳
C + O2 CO2
量的 意义 宏观 相对质量:____ ______ _____ 每 份质量的碳和______ 份质量的氧气恰好完全反应,生成_ ______份质量的二氧化碳
相对质量:____ ___ ___
每 份质量的水通电分解,生成_____份质量的氢气和 ______份质量的氧气
微观 每 个碳原子和 个氧分子恰好完全反应,生成 个二氧化碳分子 每 个水分子通电分解,生成 个氢分子和 个氧分子
1
2
2
32
4
36
36 4 32
1
1
1
44
32
12
12 32 44
(2)宏观:表示各物质之间的质量比
(3)微观:表示各物质之间的粒子个数比(系数比)
1.系数比 = 分子个数比
4 : 32 : 36
2H2 + O2 2H2O
例:各物质的质量比为2:1:2( )
各物质的质量比为4:32:36( )
2.系数比 ≠ 物质的质量比
注意
化学方程式表示的意义(或提供的信息)
表示反应物、生成物和反应条件
表示参加反应的各粒子的相对数量
表示各物质之间的质量比
从物质种类、质量和反应条件等方面考虑,下列反应的化学方程式能提供给你哪些信息?
1.硫在氧气中燃烧的反应:
S+O2 SO2
2.铁与硫酸铜溶液的反应:
Fe+CuSO4=Cu+FeSO4
3.铜丝表面的氧化铜与氢气在加热的条件下反应:
CuO+H2 Cu+H2O
反应物、生成物、反应条件.......
【课堂练习】
?
微观质量比=___________
4 : 32 : 36
4g
32g
36g
72g
64g
8g
微观质量比:
实际质量比:
18g
16g
2g
实际质量比
微观质量比=系数×相对分子质量;
实际质量比不用×系数
?
?
?
2H2 + O2 2H2O
思考:2g氢气和32g氧气充分反应能生成34g水,是否正确?
1、根据质量比求反应物或生成物的质量
二、有关化学方程式的应用
2、根据化学方程式推断物质的化学式
1.葡萄糖在人体内充分氧化,并释放能量,化学方程式为:C6H12O6 + 6O2 6CO2 + 6X,则X的化学式为______。
H2O
原子种类 左边个数 右边个数
C
H
O
6
12
18
6
0
12
【解析】根据质量守恒,化学方程式左右两边原子种类和数目应该相等,得:
2.硝酸可发生4HNO3 4NO2↑+X↑+2H2O的反应,根据所给的化学方程式回答下列问题:
(1)反应的基本类型属于________反应。
(2)X的化学式为________,推断的依据为_____________。
(3)硝酸的保存应注意_______、_______。
分解
O2
质量守恒定律
低温
避光
3、微观反应示意图
(2020·广东期末)1.“三效催化转化器”可将汽车尾气中的有毒气体NO、CO处理为无污染的气体CO2和N2。
(1)请把方框中微观示意图补画齐全。
(2)写出该反应的化学方程式________________________________
氧原子
氮原子
氧原子
+
催化剂
+
NO+CO CO2+N2
2.某反应的微观示意图如图(一种小球代表一种元素的原子),下列说法错误的是( )
A.该反应中共有三种元素
B.图中反应物都是化合物
C.该反应的本质是原子的重新组合
D.该反应前后分子的种类发生改变
B
一、质量守恒定律:
(一)内容:参加__________的各物质的质量____,等于反应后生成的各物质的质量 。
(二)理解
1.反应物的总质量等于 ;
2.反应物_______的质量等于_________增加的质量;
3.质量比等于反应前后 之比。
(三)质量守恒的原因
化学反应前后,原子的 、 、 都没有改变,所以,化学反应前后各物质的质量总和相等。
化学反应
总和
总和
种类
数目
质量
减少
生成物
生成物的总质量
质量变化
课堂小结
二、化学方程式
1.概念:用_________来表示化学反应的式子。
2.意义
(1)宏观:表示________、_______和反应条件;
(2)微观:系数比=分子_____比。
(3)质量:表示各物质的质量比:宏观质量比=___________
微观质量比=______×_____________
化学式
反应物
生成物
个数
系数
相对分子质量
微观质量比
1.镁带在密封容器中(内含氧气)加热,下图能正确表示容器里所盛的物质总质量变化的是( )
A. B. C. D.
C
【随堂练习】
2.如图是某反应的微观示意图,以下正确的是( )
A.该反应有单质生成
B.如图表示的微观变化过程中共有三种分子
C.分子是化学变化中最小粒子
D.参加反应的“ ”分子与“ ”分子的个数比为1:3
B
3.下图四位同学正在讨论某一个化学方程式表示的场景,他们所描述的化学方程式是( )
A . 4P+5O2 2P2O5
B . C+O2 CO2
C . S+O2 SO2
D . H2+O2 H2O
D
质量守恒定律(第2课时)
人教版九年级化学上册第五单元《化学方程式》
不要遗漏任何
反应物和生成物
温
故
知
新
质量守恒定律
参加化学反应的各物质的质量总和
等于反应后生成的各物质的质量总和
没有参加反应的物质不包括在内
含 义
适
用
一切化学反应
实 质
反应前后原子的种类、数目、质量不变
应
用
一、质量守恒定律的应用
(1) 考查应用范围
(2) 简答(解释化学反应中有关实验事实)
(3) 确定物质的化学式
(4) 推断物质的组成
(5) 计算物质的质量(化学反应类型)
B
(1)考查应用范围
1.下列说法符合质量守恒定律的是( )
A.雨过天晴后马路上的水很快蒸发
B.澄清石灰水露置在空气中变重
C.打开盛酒精的试剂瓶的瓶盖,酒精质量变小
D.炭块研磨成炭粉,质量不变
2.下列有关质量守恒定律的理解正确的是( )
A.100ml水和100mL酒精混合后,体积是200mL
B.将5gA和5gB混合发生化合反应,一定能生成10gC
C.木炭燃烧后质量减少了,这个化学反应不遵守质量守恒定律
D.铁丝燃烧后生成物的质量增加,是因为有氧气参加了反应
D
点石成金
化学反应前后元素的种类不变。(不遵守质量守恒定律)
1.请用质量守恒定律揭穿这些骗局
变水为油
(2)简答(解释化学反应中有关实验事实)
2.根据质量守恒定律解释现象 (教材P98,第3题)
参加反应的铜和氧气的质量总和等于反应生成氧化铜的质量。
纸燃烧生成CO2和水蒸气逸散到了空气中。
反应生成的氧气逸出。
(1)铜粉在空气中加热后,生成物的质量比原来铜粉的质量增大
(2)纸在空气中燃烧后化为灰烬,灰烬的质量比原来纸的质量减小
(3)高锰酸钾受热分解之后,剩余固体的质量i原反应物的质量减小
B
依据是:在化学反应两边各种原子的种类和数目必须相等。
(3)确定物质的化学式
1.硝酸银受热时会发生如下反应 2AgNO3 ═ 2Ag + 2X + O2 。根据质量守恒定律,推测X的是( )
A.N20 B.N02 C.N2O5 D.NO
△
C
(4)推断物质的元素组成
1.植物的光合作用可表示为:CO2 + H2O 淀粉 + 02 ,下列关于淀粉组成的说法正确的是( )
A.只含有碳、氢元素 B.含有碳、氢、氧三种元素
C.还有碳、氢元素,可能含有氧元素 D.无法确定
2.某化合物R在纯氧中充分燃烧后,只生成水和二氧化碳,则该化合物的组成中( )
A.只含有碳元素
B.只含有氢元素
C.一定含有碳元素和氢元素,可能含有氧元素
D.一定含有碳、氢、氧三种元素
C
B
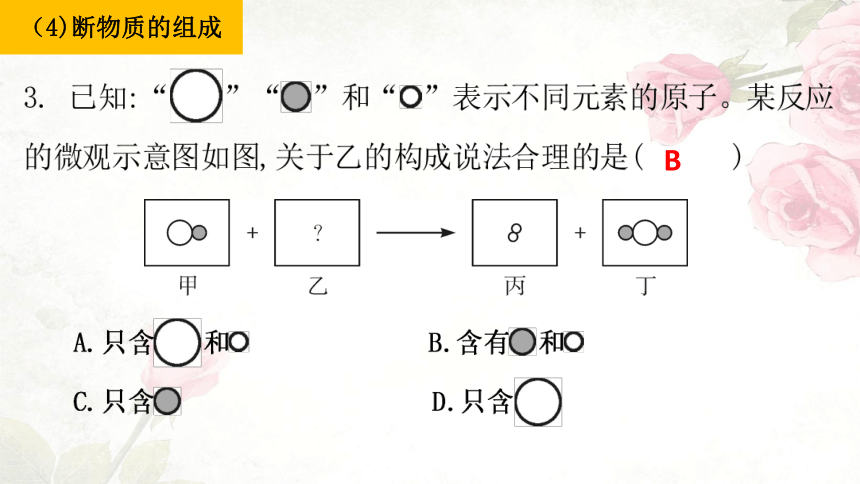
(4)断物质的组成
B
1.5
0.6
(5)计算物质的质量
3.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后
测得有关数据如表:
下列说法中,不正确的是( )
A.反应后物质甲的质量为13 g B.乙是反应物
C.参与反应的乙、丁的质量比为5:4 D.物质丙可能是该反应的催化剂
物质 甲 乙 丙 丁
反应前的质量/g 18 1 2 32
反应后的质量/g x 26 2 12
B
(5)计算物质的质量
A.x的数值为3
B.该反应为分解反应
C.丙一定是该反应的催化剂
D.参加反应的乙和丁质量比为 3∶2
4.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图。下列说法中不正确的是( )
C
(5)计算物质的质量
易错提醒:质量比是指参加反应的物质质量比,不包括未参加反应的物质
或反应剩余物的质量。
A.丁一定不是单质
B.乙可能是这个反应的催化剂
C.反应中甲、丁的质量变化之比为1∶9
D.丙的相对分子质量一定是甲的8倍
5.在一定的条件下,甲、乙、丙、丁四种物质在密闭容器内充分反应,测得反应前后各物质的质量分数如图所示。下列说法中不正确的是( )
D
(5)计算物质的质量
木炭在氧气中燃烧反应的文字表达式为:
碳 + 氧气 二氧化碳
点燃
和
反应条件
生成
反应物
生成物
用化学式表示:
1.化学方程式:用_______来表示化学反应的式子。
化学式
C + O2 CO2
一、化学方程式
化学方程式
反应条件
质的 意义 反应物
生成物
氢气和氧气
水
通电
二氧化碳
碳和氧气
点燃
2.化学方程式表示的意义 【以 为例】
(1)读作: 和 在 的条件下生成 。
碳
氧气
点燃
二氧化碳
C + O2 CO2
量的 意义 宏观 相对质量:____ ______ _____ 每 份质量的碳和______ 份质量的氧气恰好完全反应,生成_ ______份质量的二氧化碳
相对质量:____ ___ ___
每 份质量的水通电分解,生成_____份质量的氢气和 ______份质量的氧气
微观 每 个碳原子和 个氧分子恰好完全反应,生成 个二氧化碳分子 每 个水分子通电分解,生成 个氢分子和 个氧分子
1
2
2
32
4
36
36 4 32
1
1
1
44
32
12
12 32 44
(2)宏观:表示各物质之间的质量比
(3)微观:表示各物质之间的粒子个数比(系数比)
1.系数比 = 分子个数比
4 : 32 : 36
2H2 + O2 2H2O
例:各物质的质量比为2:1:2( )
各物质的质量比为4:32:36( )
2.系数比 ≠ 物质的质量比
注意
化学方程式表示的意义(或提供的信息)
表示反应物、生成物和反应条件
表示参加反应的各粒子的相对数量
表示各物质之间的质量比
从物质种类、质量和反应条件等方面考虑,下列反应的化学方程式能提供给你哪些信息?
1.硫在氧气中燃烧的反应:
S+O2 SO2
2.铁与硫酸铜溶液的反应:
Fe+CuSO4=Cu+FeSO4
3.铜丝表面的氧化铜与氢气在加热的条件下反应:
CuO+H2 Cu+H2O
反应物、生成物、反应条件.......
【课堂练习】
?
微观质量比=___________
4 : 32 : 36
4g
32g
36g
72g
64g
8g
微观质量比:
实际质量比:
18g
16g
2g
实际质量比
微观质量比=系数×相对分子质量;
实际质量比不用×系数
?
?
?
2H2 + O2 2H2O
思考:2g氢气和32g氧气充分反应能生成34g水,是否正确?
1、根据质量比求反应物或生成物的质量
二、有关化学方程式的应用
2、根据化学方程式推断物质的化学式
1.葡萄糖在人体内充分氧化,并释放能量,化学方程式为:C6H12O6 + 6O2 6CO2 + 6X,则X的化学式为______。
H2O
原子种类 左边个数 右边个数
C
H
O
6
12
18
6
0
12
【解析】根据质量守恒,化学方程式左右两边原子种类和数目应该相等,得:
2.硝酸可发生4HNO3 4NO2↑+X↑+2H2O的反应,根据所给的化学方程式回答下列问题:
(1)反应的基本类型属于________反应。
(2)X的化学式为________,推断的依据为_____________。
(3)硝酸的保存应注意_______、_______。
分解
O2
质量守恒定律
低温
避光
3、微观反应示意图
(2020·广东期末)1.“三效催化转化器”可将汽车尾气中的有毒气体NO、CO处理为无污染的气体CO2和N2。
(1)请把方框中微观示意图补画齐全。
(2)写出该反应的化学方程式________________________________
氧原子
氮原子
氧原子
+
催化剂
+
NO+CO CO2+N2
2.某反应的微观示意图如图(一种小球代表一种元素的原子),下列说法错误的是( )
A.该反应中共有三种元素
B.图中反应物都是化合物
C.该反应的本质是原子的重新组合
D.该反应前后分子的种类发生改变
B
一、质量守恒定律:
(一)内容:参加__________的各物质的质量____,等于反应后生成的各物质的质量 。
(二)理解
1.反应物的总质量等于 ;
2.反应物_______的质量等于_________增加的质量;
3.质量比等于反应前后 之比。
(三)质量守恒的原因
化学反应前后,原子的 、 、 都没有改变,所以,化学反应前后各物质的质量总和相等。
化学反应
总和
总和
种类
数目
质量
减少
生成物
生成物的总质量
质量变化
课堂小结
二、化学方程式
1.概念:用_________来表示化学反应的式子。
2.意义
(1)宏观:表示________、_______和反应条件;
(2)微观:系数比=分子_____比。
(3)质量:表示各物质的质量比:宏观质量比=___________
微观质量比=______×_____________
化学式
反应物
生成物
个数
系数
相对分子质量
微观质量比
1.镁带在密封容器中(内含氧气)加热,下图能正确表示容器里所盛的物质总质量变化的是( )
A. B. C. D.
C
【随堂练习】
2.如图是某反应的微观示意图,以下正确的是( )
A.该反应有单质生成
B.如图表示的微观变化过程中共有三种分子
C.分子是化学变化中最小粒子
D.参加反应的“ ”分子与“ ”分子的个数比为1:3
B
3.下图四位同学正在讨论某一个化学方程式表示的场景,他们所描述的化学方程式是( )
A . 4P+5O2 2P2O5
B . C+O2 CO2
C . S+O2 SO2
D . H2+O2 H2O
D
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
