化学人教版(2019)必修第一册3.1.1 铁的化合物(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.1 铁的化合物(共34张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-15 14:44:23 | ||
图片预览











文档简介
(共34张PPT)
第三章 铁 金属单质
第一节 铁及其化合物
学习目标
1.了解铁单质在生活中的用途,能从物质分类及化合价角度去分析铁单质的化学性质。
2.能设计实验去认识铁与水蒸气的反应,发展科学探究水平,能用符号表示铁与水蒸气的反应原理。
3.结合铁的氧化物在生活中的用途,认识铁的氧化物的性质,进一步发展“性质决定用途”的学科观念。
4.能利用氢氧化亚铁的性质,设计其制备方案,提升学生科学探究与创新意识的素养水平。
5.能说明Fe2+、Fe3+的检验及其之间的相互转化,提升学生变化观念与平衡思想的素养水平。
问题预设及反馈
四氧化三铁与盐酸反应的化学方程式?
Fe3O4是碱性氧化物吗?
3.为什么氢氧化亚铁白色絮状沉淀迅速变成灰绿色,最后变成红褐色呢?
4.制备Fe(OH)2时 ,如何防止Fe(OH)2不被氧化成Fe(OH)3?
5.Fe3+和Fe2+如何相互转化?
6.Fe2+、Fe3+的检验方法有哪些?
7.含有Fe3+的盐溶液遇到KSCN溶液时变成红色,红色物质是什么?
一、铁的存在、用途
(1)铁元素的存在
人类最早使用的铁是来自太空的陨铁。铁在自然界可以像陨铁中的铁那样以游离态存在,但主要是以 价化合物的形态存在于矿石中。
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
+2、+3
(2)铁是人体必须的微量元素
铁可以用于制造业
二、铁的物理性质
纯净的铁是光亮的___色金属,密度较大,熔点___,有___性和___性。能导电,其导电性比铜、铝____,能被____吸引。
答案:银白 较高 延展 导热 差 磁铁
注意:铁单质粉末状时为黑色。
三、铁的化学性质
①与非金属单质反应(O2、Cl2、S等)
结论:氧化性:Cl2____S
思考:铜与氯气、硫反应的产物分别为?
氯气可把变价金属氧化到高价。硫可以把变价金属氧化到低价。
>
1、通过比较铁与非金属单质O2、Cl2反应的产物中铁元素的价态,试比较O2、Cl2的氧化性强弱。
铁与氧气在点燃的条件下反应的产物为Fe3O4,铁元素的价态为+2、+3;铁与氯气反应生成FeCl3,铁元素的价态为+3。则氧化性:O22、1mol Cl2与铁充分反应,转移的电子数为______。
练习
2NA
②与稀酸的反应(产H2)
Fe+H2SO4===FeSO4+H2
Fe+2HCl===FeCl2+H2↑
③与CuSO4的反应
与FeCl3溶液反应
Fe+CuSO4===FeSO4+Cu
2Fe3+ + Fe===3Fe2+(或2FeCl3+Fe===3FeCl2)
思考:体现了铁的什么性质?
还原性
④与水蒸气的反应
思考:3 mol铁参与反应,转移___mol电子
8
思考:
1、此实验中湿棉花团的作用是什么?
2、如何检验氢气?
3、实验结束时,先灭酒精灯还是先撤导管?
提供水蒸气
用火柴点肥皂泡
先撤导管,防止倒吸。
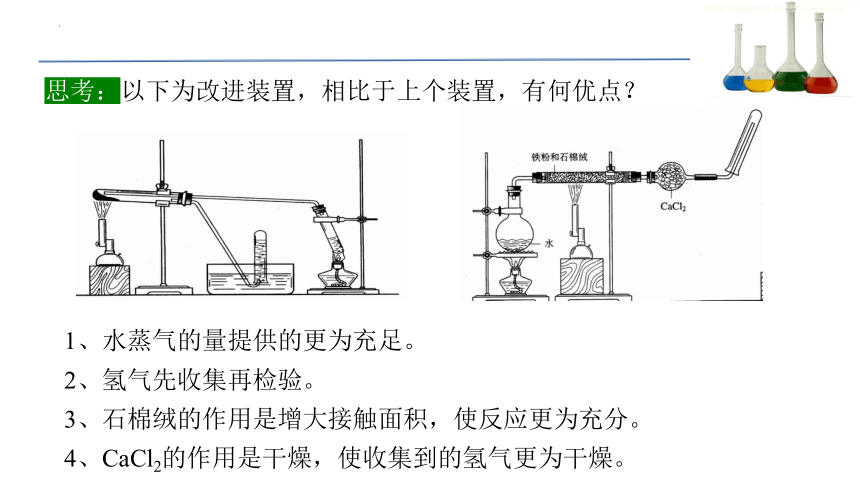
思考:以下为改进装置,相比于上个装置,有何优点?
1、水蒸气的量提供的更为充足。
2、氢气先收集再检验。
3、石棉绒的作用是增大接触面积,使反应更为充分。
4、CaCl2的作用是干燥,使收集到的氢气更为干燥。
1、还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )。
A.反应生成FeO B.湿棉花的主要作用是冷却试管,防止炸裂 C.肥皂液的主要作用是检验生成的H2 D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
答案 C
练习
2、某同学欲在实验室中完成铁与水蒸气反应的实验,装置如图甲、乙。 已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:(1)如何检查乙装置的气密性 (2)乙装置中湿沙子的作用是? (3)B处发生反应的化学方程式为___________。 (4)该同学认为在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是___________。 (5)对比甲、乙两装置的B和K,B的优点是___________。
答案
(1)向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好(其他合理答案也可)
(2)提供水蒸气
(3)
(4)干燥氢气,降低氢气中水蒸气的含量
(5)使用石棉绒,增大水蒸气与铁粉的接触面积,使反应充分进行。
四、铁的氧化物
FeO黑色粉末
Fe2O3红棕色粉末
Fe3O4黑色晶体
不稳定,受热易转化为Fe3O4
化学式 FeO Fe2O3 Fe3O4
俗名
铁的价态
水溶性
稳定性
与酸反应
是否为 碱性氧化物
——
铁红
磁性氧化铁
+2
+3
+2、+3
不溶
不溶
不溶
稳定
稳定
FeO + 2H+ =
Fe2+ + H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
Fe3O4 + 8H+=
Fe2+ + 2Fe3++4 H2O
是
是
否
Ⅰ.作为冶炼金属的原料,如赤铁矿(主要成分Fe2O3)
Ⅱ.氧化铁俗称铁红,常用于制造红色油漆和涂料
用途:
五、铁的氢氧化物——Fe(OH)3 、Fe(OH)2
Fe(OH)3 、Fe(OH)2 的制备:FeCl3、FeCl2分别与NaOH反应
FeCl3溶液 FeCl2溶液
实验现象
离子方程式
生成红褐色沉淀
Fe3+ + 3OH- =Fe(OH)3↓
Fe2++ 2OH- =Fe(OH)2↓
4Fe(OH)2 + O2+2H2O= 4Fe(OH)3
生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
讨论:以下装置可以制备Fe(OH)2,且较长时间可看到白色沉淀,你能明白原理吗?
防止Fe(OH)2氧化的方法:
(1)将配制溶液的蒸馏水煮沸,除去溶液中的氧气。 (2)将盛有NaOH溶液的胶头滴管尖端插入盛有亚铁盐溶液的试管底部,并慢慢挤出NaOH溶液。 (3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
1、如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入试剂是_____。A中反应的离子方程式是__________________。
铁屑
Fe+2H+=Fe2++H2
练习
(2)实验开始时应先将活塞a_____(填“打开”、“关闭”)。
(3)简述生成Fe(OH)2的操作过程___________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为____________________________________________。
打开
待A中反应一段时间后,关闭a,使生成的H2把FeSO4溶液压入B中进行反应。
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
2、下列物质不能由化合反应直接生成的是( )。A.FeCl2 B.Fe(OH)3C.NaHCO3 D.FeO
答案 D
六、铁盐和亚铁盐的检验
检验方法 Fe3+ Fe2+
加碱法(OH-)
加KSCN溶液
直接产生红褐色沉淀
产生的白色沉淀迅速变为灰绿色,最后变为红褐色。
加KSCN溶液,溶液变为红色
加KSCN溶液,无明显现象,再加新制氯水变为红色。
Fe3+ + 3SCN- === Fe(SCN)3
Fe2+
加入K3[Fe(CN)6]溶液
出现蓝色沉淀
拓展:
Fe2+
滴入KMnO4溶液
红色褪去
1、 选择合适的试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+;乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂及加入试剂的顺序能达到实验目的的是( )。
试剂选项 甲组 乙组
A 新制氯水、KSCN溶液 氢氧化钠溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
答案 B
练习
①2Fe3+ + H2S === 2Fe2+ + S + 2H+②2Fe3+ + SO2 + 2H2O === 2Fe2+ + 4H+ + SO42-③3Fe2+ + 4H+ + NO3- === 3Fe3+ + 2H2O + NO④5Fe2+ + MnO4- + 8H+ === 5Fe3+ + Mn2+ + 4H2O⑤2Fe2+ + H2O2 + 2H+ === 2Fe3+ + 2H2O
写出上述带序号的物质相关离子方程式:
2Fe3+ + Fe === 3Fe2+
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
2Fe3+ + Cu === 2Fe2+ + Cu2+
七、铁盐和亚铁盐的转化
1、部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )。A.a可与e反应生成bB.b既可被氧化,也可被还原C.可将e加入浓碱液中制得d的胶体D.可存在b→c→d→e→b的循环转化关系
练习
答案 C
2、工业印刷电路板的制作流程如图所示,其中“蚀刻”所用的是FeCl3溶液。
(1)请你写出FeCl3溶液蚀刻印刷铜板的反应原理:___________(用离子方程式表示)。 (2)由FeCl2可生成Fe或FeCl3,请写出反应的化学方程式: ________ 。 (3)反应后的“蚀刻液”中含有的金属离子有 ;设计回收方案从“蚀刻液”中回收得到Cu和FeCl3:__________________。
答案
(1)2Fe3++Cu===2Fe2++Cu2+(2)FeCl2+Zn===ZnCl2+Fe,2FeCl2+Cl2===2FeCl3(合理答案均可)(3)Fe3+、Fe2+、Cu2+ 为从溶液中提取Cu,应向溶液中加入过量铁粉:Fe+Cu2+===Fe2++Cu、Fe+2Fe3+===3Fe2+;然后用盐酸溶解过量的铁粉:Fe+2HCl===FeCl2+H2↑,过滤后得到Cu;再向滤液中通入适量氯气即可得到FeCl3:2FeCl2+Cl2===2FeCl3
3、下列离子方程式书写正确的是( )。A.将氨水滴入FeCl3溶液中:Fe3++3OH-===Fe(OH)3↓B.氧化铁与盐酸反应:Fe2O3+6H+===2Fe3++3H2OC.向FeCl3溶液中加入铁粉:Fe+Fe3+===2Fe2+D.向氯化亚铁溶液中通入Cl2:Fe2++Cl2===Fe3++2Cl-
答案 B
4、为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )。
A.①④ B.②③ C.③④ D.①②⑤
答案 C
5、为了检验某FeCl2溶液是否变质,可向溶液中加入的最佳试剂是( )。A.NaOH溶液 B.铁片C.KSCN溶液 D.石蕊溶液
答案 C
课堂小结
1.了解铁单质在生活中的用途,能从物质分类及化合价角度去分析铁单质的化学性质。
2.能设计实验去认识铁与水蒸气的反应,发展科学探究水平,能用符号表示铁与水蒸气的反应原理。
3.结合铁的氧化物在生活中的用途,认识铁的氧化物的性质,进一步发展“性质决定用途”的学科观念。
4.能利用氢氧化亚铁的性质,设计其制备方案,提升学生科学探究与创新意识的素养水平。
5.能说明Fe2+、Fe3+的检验及其之间的相互转化,提升学生变化观念与平衡思想的素养水平。
第三章 铁 金属单质
第一节 铁及其化合物
学习目标
1.了解铁单质在生活中的用途,能从物质分类及化合价角度去分析铁单质的化学性质。
2.能设计实验去认识铁与水蒸气的反应,发展科学探究水平,能用符号表示铁与水蒸气的反应原理。
3.结合铁的氧化物在生活中的用途,认识铁的氧化物的性质,进一步发展“性质决定用途”的学科观念。
4.能利用氢氧化亚铁的性质,设计其制备方案,提升学生科学探究与创新意识的素养水平。
5.能说明Fe2+、Fe3+的检验及其之间的相互转化,提升学生变化观念与平衡思想的素养水平。
问题预设及反馈
四氧化三铁与盐酸反应的化学方程式?
Fe3O4是碱性氧化物吗?
3.为什么氢氧化亚铁白色絮状沉淀迅速变成灰绿色,最后变成红褐色呢?
4.制备Fe(OH)2时 ,如何防止Fe(OH)2不被氧化成Fe(OH)3?
5.Fe3+和Fe2+如何相互转化?
6.Fe2+、Fe3+的检验方法有哪些?
7.含有Fe3+的盐溶液遇到KSCN溶液时变成红色,红色物质是什么?
一、铁的存在、用途
(1)铁元素的存在
人类最早使用的铁是来自太空的陨铁。铁在自然界可以像陨铁中的铁那样以游离态存在,但主要是以 价化合物的形态存在于矿石中。
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
+2、+3
(2)铁是人体必须的微量元素
铁可以用于制造业
二、铁的物理性质
纯净的铁是光亮的___色金属,密度较大,熔点___,有___性和___性。能导电,其导电性比铜、铝____,能被____吸引。
答案:银白 较高 延展 导热 差 磁铁
注意:铁单质粉末状时为黑色。
三、铁的化学性质
①与非金属单质反应(O2、Cl2、S等)
结论:氧化性:Cl2____S
思考:铜与氯气、硫反应的产物分别为?
氯气可把变价金属氧化到高价。硫可以把变价金属氧化到低价。
>
1、通过比较铁与非金属单质O2、Cl2反应的产物中铁元素的价态,试比较O2、Cl2的氧化性强弱。
铁与氧气在点燃的条件下反应的产物为Fe3O4,铁元素的价态为+2、+3;铁与氯气反应生成FeCl3,铁元素的价态为+3。则氧化性:O2
练习
2NA
②与稀酸的反应(产H2)
Fe+H2SO4===FeSO4+H2
Fe+2HCl===FeCl2+H2↑
③与CuSO4的反应
与FeCl3溶液反应
Fe+CuSO4===FeSO4+Cu
2Fe3+ + Fe===3Fe2+(或2FeCl3+Fe===3FeCl2)
思考:体现了铁的什么性质?
还原性
④与水蒸气的反应
思考:3 mol铁参与反应,转移___mol电子
8
思考:
1、此实验中湿棉花团的作用是什么?
2、如何检验氢气?
3、实验结束时,先灭酒精灯还是先撤导管?
提供水蒸气
用火柴点肥皂泡
先撤导管,防止倒吸。
思考:以下为改进装置,相比于上个装置,有何优点?
1、水蒸气的量提供的更为充足。
2、氢气先收集再检验。
3、石棉绒的作用是增大接触面积,使反应更为充分。
4、CaCl2的作用是干燥,使收集到的氢气更为干燥。
1、还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )。
A.反应生成FeO B.湿棉花的主要作用是冷却试管,防止炸裂 C.肥皂液的主要作用是检验生成的H2 D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
答案 C
练习
2、某同学欲在实验室中完成铁与水蒸气反应的实验,装置如图甲、乙。 已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:(1)如何检查乙装置的气密性 (2)乙装置中湿沙子的作用是? (3)B处发生反应的化学方程式为___________。 (4)该同学认为在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是___________。 (5)对比甲、乙两装置的B和K,B的优点是___________。
答案
(1)向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好(其他合理答案也可)
(2)提供水蒸气
(3)
(4)干燥氢气,降低氢气中水蒸气的含量
(5)使用石棉绒,增大水蒸气与铁粉的接触面积,使反应充分进行。
四、铁的氧化物
FeO黑色粉末
Fe2O3红棕色粉末
Fe3O4黑色晶体
不稳定,受热易转化为Fe3O4
化学式 FeO Fe2O3 Fe3O4
俗名
铁的价态
水溶性
稳定性
与酸反应
是否为 碱性氧化物
——
铁红
磁性氧化铁
+2
+3
+2、+3
不溶
不溶
不溶
稳定
稳定
FeO + 2H+ =
Fe2+ + H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
Fe3O4 + 8H+=
Fe2+ + 2Fe3++4 H2O
是
是
否
Ⅰ.作为冶炼金属的原料,如赤铁矿(主要成分Fe2O3)
Ⅱ.氧化铁俗称铁红,常用于制造红色油漆和涂料
用途:
五、铁的氢氧化物——Fe(OH)3 、Fe(OH)2
Fe(OH)3 、Fe(OH)2 的制备:FeCl3、FeCl2分别与NaOH反应
FeCl3溶液 FeCl2溶液
实验现象
离子方程式
生成红褐色沉淀
Fe3+ + 3OH- =Fe(OH)3↓
Fe2++ 2OH- =Fe(OH)2↓
4Fe(OH)2 + O2+2H2O= 4Fe(OH)3
生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
讨论:以下装置可以制备Fe(OH)2,且较长时间可看到白色沉淀,你能明白原理吗?
防止Fe(OH)2氧化的方法:
(1)将配制溶液的蒸馏水煮沸,除去溶液中的氧气。 (2)将盛有NaOH溶液的胶头滴管尖端插入盛有亚铁盐溶液的试管底部,并慢慢挤出NaOH溶液。 (3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
1、如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入试剂是_____。A中反应的离子方程式是__________________。
铁屑
Fe+2H+=Fe2++H2
练习
(2)实验开始时应先将活塞a_____(填“打开”、“关闭”)。
(3)简述生成Fe(OH)2的操作过程___________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为____________________________________________。
打开
待A中反应一段时间后,关闭a,使生成的H2把FeSO4溶液压入B中进行反应。
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
2、下列物质不能由化合反应直接生成的是( )。A.FeCl2 B.Fe(OH)3C.NaHCO3 D.FeO
答案 D
六、铁盐和亚铁盐的检验
检验方法 Fe3+ Fe2+
加碱法(OH-)
加KSCN溶液
直接产生红褐色沉淀
产生的白色沉淀迅速变为灰绿色,最后变为红褐色。
加KSCN溶液,溶液变为红色
加KSCN溶液,无明显现象,再加新制氯水变为红色。
Fe3+ + 3SCN- === Fe(SCN)3
Fe2+
加入K3[Fe(CN)6]溶液
出现蓝色沉淀
拓展:
Fe2+
滴入KMnO4溶液
红色褪去
1、 选择合适的试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+;乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂及加入试剂的顺序能达到实验目的的是( )。
试剂选项 甲组 乙组
A 新制氯水、KSCN溶液 氢氧化钠溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
答案 B
练习
①2Fe3+ + H2S === 2Fe2+ + S + 2H+②2Fe3+ + SO2 + 2H2O === 2Fe2+ + 4H+ + SO42-③3Fe2+ + 4H+ + NO3- === 3Fe3+ + 2H2O + NO④5Fe2+ + MnO4- + 8H+ === 5Fe3+ + Mn2+ + 4H2O⑤2Fe2+ + H2O2 + 2H+ === 2Fe3+ + 2H2O
写出上述带序号的物质相关离子方程式:
2Fe3+ + Fe === 3Fe2+
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
2Fe3+ + Cu === 2Fe2+ + Cu2+
七、铁盐和亚铁盐的转化
1、部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )。A.a可与e反应生成bB.b既可被氧化,也可被还原C.可将e加入浓碱液中制得d的胶体D.可存在b→c→d→e→b的循环转化关系
练习
答案 C
2、工业印刷电路板的制作流程如图所示,其中“蚀刻”所用的是FeCl3溶液。
(1)请你写出FeCl3溶液蚀刻印刷铜板的反应原理:___________(用离子方程式表示)。 (2)由FeCl2可生成Fe或FeCl3,请写出反应的化学方程式: ________ 。 (3)反应后的“蚀刻液”中含有的金属离子有 ;设计回收方案从“蚀刻液”中回收得到Cu和FeCl3:__________________。
答案
(1)2Fe3++Cu===2Fe2++Cu2+(2)FeCl2+Zn===ZnCl2+Fe,2FeCl2+Cl2===2FeCl3(合理答案均可)(3)Fe3+、Fe2+、Cu2+ 为从溶液中提取Cu,应向溶液中加入过量铁粉:Fe+Cu2+===Fe2++Cu、Fe+2Fe3+===3Fe2+;然后用盐酸溶解过量的铁粉:Fe+2HCl===FeCl2+H2↑,过滤后得到Cu;再向滤液中通入适量氯气即可得到FeCl3:2FeCl2+Cl2===2FeCl3
3、下列离子方程式书写正确的是( )。A.将氨水滴入FeCl3溶液中:Fe3++3OH-===Fe(OH)3↓B.氧化铁与盐酸反应:Fe2O3+6H+===2Fe3++3H2OC.向FeCl3溶液中加入铁粉:Fe+Fe3+===2Fe2+D.向氯化亚铁溶液中通入Cl2:Fe2++Cl2===Fe3++2Cl-
答案 B
4、为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )。
A.①④ B.②③ C.③④ D.①②⑤
答案 C
5、为了检验某FeCl2溶液是否变质,可向溶液中加入的最佳试剂是( )。A.NaOH溶液 B.铁片C.KSCN溶液 D.石蕊溶液
答案 C
课堂小结
1.了解铁单质在生活中的用途,能从物质分类及化合价角度去分析铁单质的化学性质。
2.能设计实验去认识铁与水蒸气的反应,发展科学探究水平,能用符号表示铁与水蒸气的反应原理。
3.结合铁的氧化物在生活中的用途,认识铁的氧化物的性质,进一步发展“性质决定用途”的学科观念。
4.能利用氢氧化亚铁的性质,设计其制备方案,提升学生科学探究与创新意识的素养水平。
5.能说明Fe2+、Fe3+的检验及其之间的相互转化,提升学生变化观念与平衡思想的素养水平。
