化学人教版2019选择性必修二2.2.1分子的空间结构(共31张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修二2.2.1分子的空间结构(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-15 16:40:50 | ||
图片预览








文档简介
(共31张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 分子结构的测定及空间结构
学习目标
1、知道分子的结构可以通过波谱等技术进行测定。
2、结合实例了解共价分子具有特定的空间结构。
3、在理解价层电子对互斥模型的基础上,对分子的空间构型进行解释和预测
核心素养
1、认识物质的空间结构可以借助某些实验手段,通过这些手段所获得的信息为建立物质结构模型或解释相关理论提供支撑。
2、结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测,培养证据推理与模型认知的核心素养。
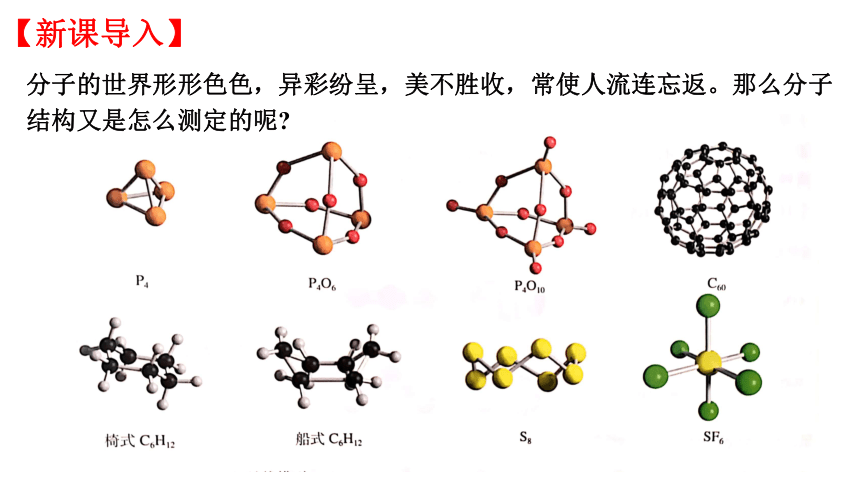
【新课导入】
分子的世界形形色色,异彩纷呈,美不胜收,常使人流连忘返。那么分子结构又是怎么测定的呢
一、
分子结构的测定
2、如今,科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、晶体X射线衍射等。
1.早年的科学家主要靠对物质的化学性质进行系统总结得出规律后推测分子的结构。
下面先介绍红外光谱,下一章还将介绍晶体X射线衍射。
测定分子结构的现代仪器和方法
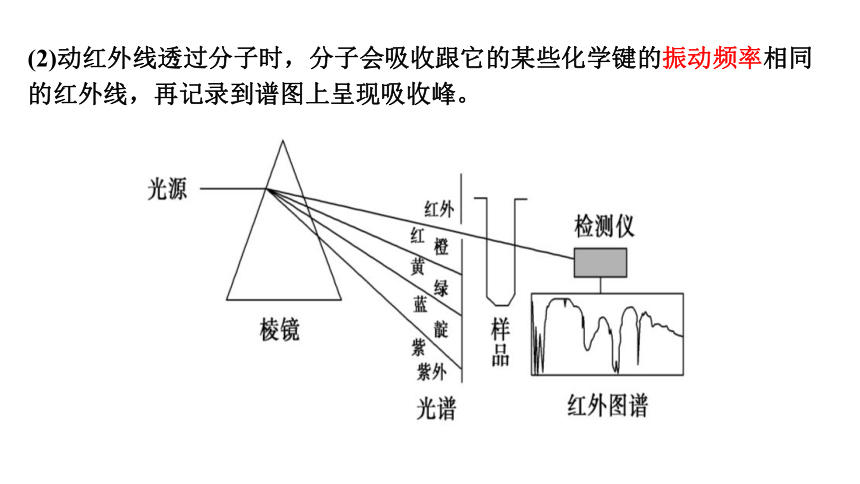
1、红外光谱法
(2)动红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到谱图上呈现吸收峰。
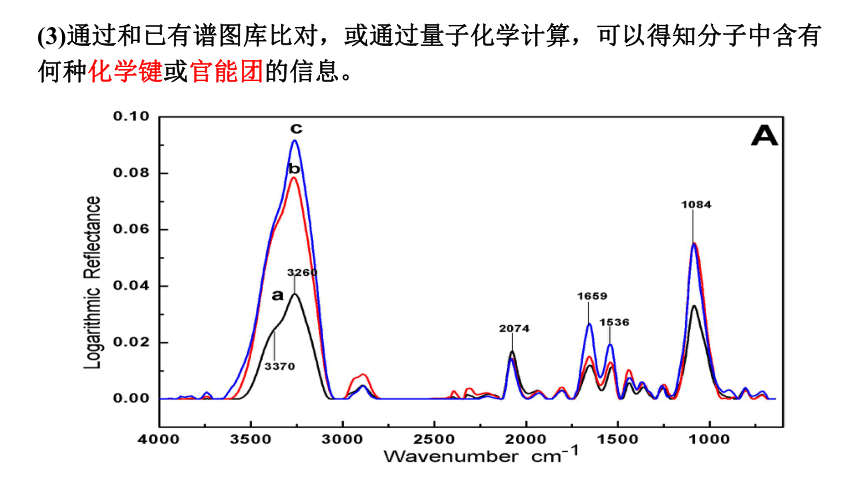
(3)通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有
何种化学键或官能团的信息。
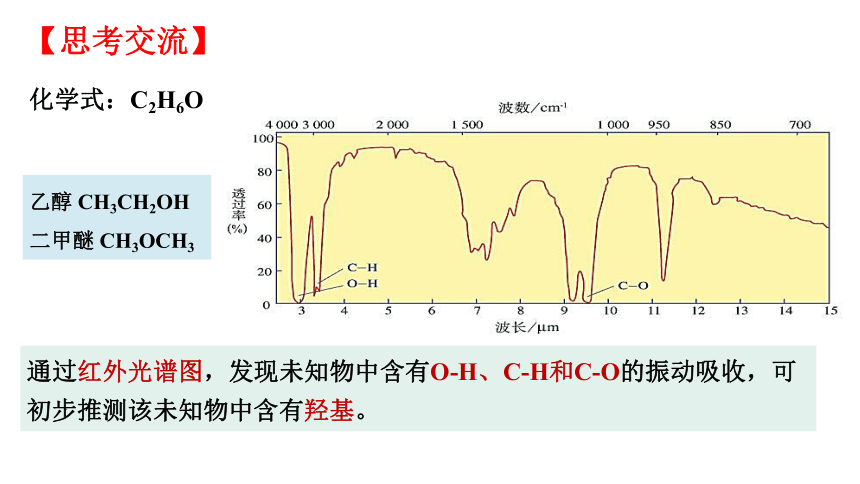
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基。
化学式:C2H6O
乙醇 CH3CH2OH
二甲醚 CH3OCH3
【思考交流】
2、质谱仪
原理:在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。
相对分子质量=最大质荷比
甲苯的相对分子质量为92
1、能够快速、微量、精确测定有机物相对分子质量的物理方法是( )
A、红外光谱法 B、质谱法 C、核磁共振氢谱法 D、色谱法
B
2、质谱法能够对有机分子结构进行分析,其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室,样品分子大量离子化,少量分子碎裂成更小的离子,然后测定其质荷比。其有机物样品的
质荷比如图所示(假设离子均带一个单位正电荷,信
号强度与该离子的多少有关),该有机物可能是( )
A、甲醇(CH3OH) B、甲烷 C、丙烷 D、乙烯
B
3、可以准确判断有机物分子中含有哪些官能团的分析方法是( )
A、核磁共振氢谱 B、质谱
C、红外光谱 D、紫外光谱
4、某有机化合物由碳、氢、氧三种元素组成,其红外光谱图只有C—H、O—H、C—O的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
A、CH3CH2OCH3 B、CH3CH(OH)CH3
C、CH3CH2OH D、CH3COOH
C
B
二、
多样的分子空间结构
H2O
CO2
1、三原子分子立体构型
直线形
180°
V形
105°
2、四原子分子立体构型
HCHO
NH3
平面三角形
120°
三角锥形
107°
3、五原子分子立体构型
CH4
正四面体
4、其它
P4
正四面体
60°
C2H2
直线形
180°
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
形形色色的分子
1、同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
2、同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
【思考交流】
1、内容
对ABn型的分子或离子,中心原子A价层电子对(包括成键σ键电子对和未成键的孤对电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定
对ABn型的分子或离子
A称为中心原子;B称为配位体(可以是原子、分子或原于团);
n是配位体个数;
三、价层电子对互斥理论(VSEPR模型)
2、σ键电子对电子的确定
σ键电子对数
= 与中心原子结合的原子数
3、中心原子上的孤电子对数的确定
对于原子:a为中心原子的最外层电子数
x 为与中心原子结合的原子数
b 为与中心原子结合的原子最多能接受的电子数(H为1,其他原子为“8-该原子的最外层电子数)
对于阳离子:a为中心原子的最外层电子数-离子的电荷数;
对于阴离子: a为中心原子的最外层电子数 + 离子的电荷数
= 1/2 (a-xb)
中心原子上的孤电子对数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
H2O O
SO2 S
NH4+ N
CO32- C
6
1
5-1=4
0
4+2=6
0
2
2
4
1
3
2
孤电子对的计算
6
2
1
2
=1/2(a-xb)
= σ键电子对 + 中心原子上的孤电子对
价层电子对数
4、中心原子上的价层电子对数的确定
代表物 电子式 中心原子结合原子数 σ键电子对 孤电子对数 价层电子对数
H2O
NH3
CO2
CH4
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O C O
::
::
:
:
:
:
2
3
4
2
2
2
4
3
1
4
4
0
4
2
0
2
价层电子对数目:2 3 4
VSEPR模型:
直线
平面三角形
正四面体
5、价电子对的空间构型(VSEPR模型)
价层电子对数目: 5 6
VSEPR模型: 三角双锥形 正八面体形
价层电子对数 成键电子对数 孤对电子对数 分子类型 VSEPR模型 分子构型 实 例
2
3
2 0 AB2
直线形
3 0 AB3
2 1 AB2
平面三角形
V形
SO2
6、VSEPR模型应用——预测分子立体构型
CO2
BF3
中心原子的孤对电子也要占据中心原子的空间,并与成键电子对互相排斥
推测分子的立体模型必须略去VSEPR模型中的孤电子对
价层电子对数 成键电子对数 孤对电子对数 分子类型 VSEPR模型 分子构型 实 例
4
4 0 AB4
3 1 AB3
2 2 AB2
正四面体
三角锥形
V形
H2O
CH4
NH3
【小试牛刀】下列说法正确的是( )
A.CS2分子的立体构型是V形
B.NF3分子的立体构型是四面体形
C.键长、键角不同是导致分子构型不同的主要原因
D.正四面体形分子一定是五原子分子
【再来一刀】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的
立体构型,有时也能用来推测键角大小。下列判断正确的是( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
C
C
课堂小结
分子结构的测定
红外光谱——化学键或官能团
质谱——相对分子质量
多样的分子空间结构
价层电子对数
价层电子对
互斥模型
VSEPR模型
略去孤电子对
分子的立体构型
σ键电子对
中心原子上的
孤对电子数目
价电子对互斥模型
巩固练习:
2.2.1分子结构的测定及空间结构
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 分子结构的测定及空间结构
学习目标
1、知道分子的结构可以通过波谱等技术进行测定。
2、结合实例了解共价分子具有特定的空间结构。
3、在理解价层电子对互斥模型的基础上,对分子的空间构型进行解释和预测
核心素养
1、认识物质的空间结构可以借助某些实验手段,通过这些手段所获得的信息为建立物质结构模型或解释相关理论提供支撑。
2、结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测,培养证据推理与模型认知的核心素养。
【新课导入】
分子的世界形形色色,异彩纷呈,美不胜收,常使人流连忘返。那么分子结构又是怎么测定的呢
一、
分子结构的测定
2、如今,科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、晶体X射线衍射等。
1.早年的科学家主要靠对物质的化学性质进行系统总结得出规律后推测分子的结构。
下面先介绍红外光谱,下一章还将介绍晶体X射线衍射。
测定分子结构的现代仪器和方法
1、红外光谱法
(2)动红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到谱图上呈现吸收峰。
(3)通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有
何种化学键或官能团的信息。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基。
化学式:C2H6O
乙醇 CH3CH2OH
二甲醚 CH3OCH3
【思考交流】
2、质谱仪
原理:在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。
相对分子质量=最大质荷比
甲苯的相对分子质量为92
1、能够快速、微量、精确测定有机物相对分子质量的物理方法是( )
A、红外光谱法 B、质谱法 C、核磁共振氢谱法 D、色谱法
B
2、质谱法能够对有机分子结构进行分析,其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室,样品分子大量离子化,少量分子碎裂成更小的离子,然后测定其质荷比。其有机物样品的
质荷比如图所示(假设离子均带一个单位正电荷,信
号强度与该离子的多少有关),该有机物可能是( )
A、甲醇(CH3OH) B、甲烷 C、丙烷 D、乙烯
B
3、可以准确判断有机物分子中含有哪些官能团的分析方法是( )
A、核磁共振氢谱 B、质谱
C、红外光谱 D、紫外光谱
4、某有机化合物由碳、氢、氧三种元素组成,其红外光谱图只有C—H、O—H、C—O的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
A、CH3CH2OCH3 B、CH3CH(OH)CH3
C、CH3CH2OH D、CH3COOH
C
B
二、
多样的分子空间结构
H2O
CO2
1、三原子分子立体构型
直线形
180°
V形
105°
2、四原子分子立体构型
HCHO
NH3
平面三角形
120°
三角锥形
107°
3、五原子分子立体构型
CH4
正四面体
4、其它
P4
正四面体
60°
C2H2
直线形
180°
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
形形色色的分子
1、同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
2、同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
【思考交流】
1、内容
对ABn型的分子或离子,中心原子A价层电子对(包括成键σ键电子对和未成键的孤对电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定
对ABn型的分子或离子
A称为中心原子;B称为配位体(可以是原子、分子或原于团);
n是配位体个数;
三、价层电子对互斥理论(VSEPR模型)
2、σ键电子对电子的确定
σ键电子对数
= 与中心原子结合的原子数
3、中心原子上的孤电子对数的确定
对于原子:a为中心原子的最外层电子数
x 为与中心原子结合的原子数
b 为与中心原子结合的原子最多能接受的电子数(H为1,其他原子为“8-该原子的最外层电子数)
对于阳离子:a为中心原子的最外层电子数-离子的电荷数;
对于阴离子: a为中心原子的最外层电子数 + 离子的电荷数
= 1/2 (a-xb)
中心原子上的孤电子对数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
H2O O
SO2 S
NH4+ N
CO32- C
6
1
5-1=4
0
4+2=6
0
2
2
4
1
3
2
孤电子对的计算
6
2
1
2
=1/2(a-xb)
= σ键电子对 + 中心原子上的孤电子对
价层电子对数
4、中心原子上的价层电子对数的确定
代表物 电子式 中心原子结合原子数 σ键电子对 孤电子对数 价层电子对数
H2O
NH3
CO2
CH4
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O C O
::
::
:
:
:
:
2
3
4
2
2
2
4
3
1
4
4
0
4
2
0
2
价层电子对数目:2 3 4
VSEPR模型:
直线
平面三角形
正四面体
5、价电子对的空间构型(VSEPR模型)
价层电子对数目: 5 6
VSEPR模型: 三角双锥形 正八面体形
价层电子对数 成键电子对数 孤对电子对数 分子类型 VSEPR模型 分子构型 实 例
2
3
2 0 AB2
直线形
3 0 AB3
2 1 AB2
平面三角形
V形
SO2
6、VSEPR模型应用——预测分子立体构型
CO2
BF3
中心原子的孤对电子也要占据中心原子的空间,并与成键电子对互相排斥
推测分子的立体模型必须略去VSEPR模型中的孤电子对
价层电子对数 成键电子对数 孤对电子对数 分子类型 VSEPR模型 分子构型 实 例
4
4 0 AB4
3 1 AB3
2 2 AB2
正四面体
三角锥形
V形
H2O
CH4
NH3
【小试牛刀】下列说法正确的是( )
A.CS2分子的立体构型是V形
B.NF3分子的立体构型是四面体形
C.键长、键角不同是导致分子构型不同的主要原因
D.正四面体形分子一定是五原子分子
【再来一刀】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的
立体构型,有时也能用来推测键角大小。下列判断正确的是( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
C
C
课堂小结
分子结构的测定
红外光谱——化学键或官能团
质谱——相对分子质量
多样的分子空间结构
价层电子对数
价层电子对
互斥模型
VSEPR模型
略去孤电子对
分子的立体构型
σ键电子对
中心原子上的
孤对电子数目
价电子对互斥模型
巩固练习:
2.2.1分子结构的测定及空间结构
