人教版九年级化学下册 8.2.1 金属的化学性质(课件共15页)
文档属性
| 名称 | 人教版九年级化学下册 8.2.1 金属的化学性质(课件共15页) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 11:26:28 | ||
图片预览




文档简介
(共15张PPT)
第八单元 金属和金属材料
课题2 金属的化学性质
第一课时 金属的化学性质
人教版九年级下册
新课引入
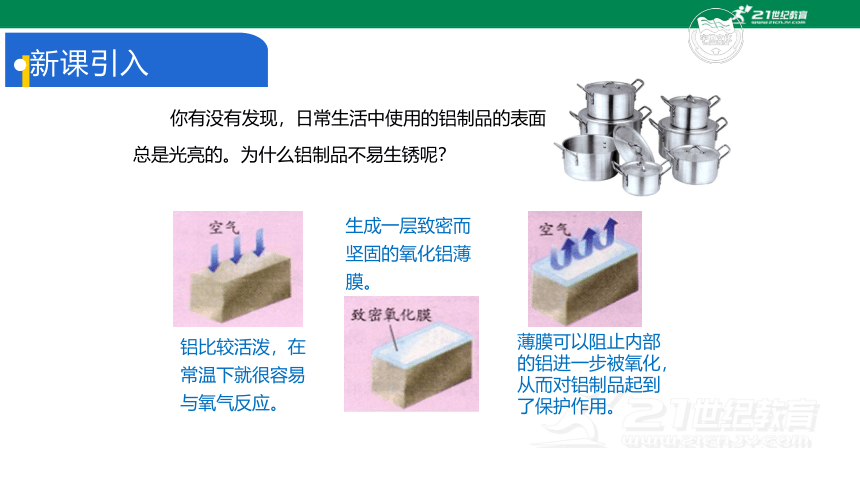
你有没有发现,日常生活中使用的铝制品的表面
总是光亮的。为什么铝制品不易生锈呢?
薄膜可以阻止内部的铝进一步被氧化,从而对铝制品起到了保护作用。
铝比较活泼,在常温下就很容易与氧气反应。
生成一层致密而坚固的氧化铝薄膜。
新课讲解
一、金属与氧气的反应
金属 现象 化学方程式
铝(片)
镁(条)
铁(丝)
铜(片)
发出耀眼的白光,放出大量的热,生成一种白色固体
剧烈燃烧,火星四射,放出大量的热,生成黑色固体
铜表面由紫红色变成黑色
多数金属都能与氧气反应生成氧化物,但反应的难易和剧烈程度不同。
2Mg+O2==== 2MgO
点燃
3Fe+2O2==== Fe3O4
点燃
2Cu+O2==== 2CuO
△
4Al+3O2=== 2Al2O3
铁丝在氧气中燃烧
新课讲解
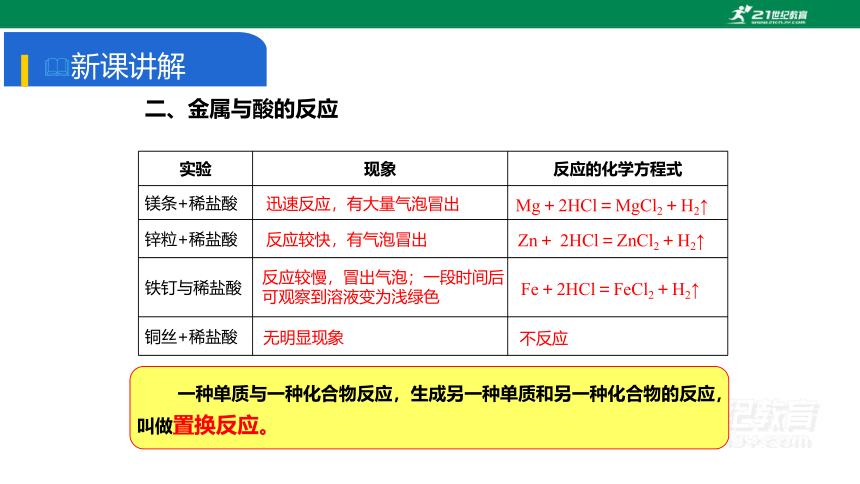
二、金属与酸的反应
实验 现象 反应的化学方程式
镁条+稀盐酸
锌粒+稀盐酸
铁钉与稀盐酸
铜丝+稀盐酸
不反应
Fe+2HCl=FeCl2+H2↑
Zn+ 2HCl=ZnCl2+H2↑
Mg+2HCl=MgCl2+H2↑
无明显现象
迅速反应,有大量气泡冒出
反应较快,有气泡冒出
反应较慢,冒出气泡;一段时间后可观察到溶液变为浅绿色
结论:活泼金属与稀酸(稀盐酸、稀硫酸)反应生成金属化合物和氢气;
注意:铁与稀酸反应生成的化合物中铁元素为+2价。
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,叫做置换反应。
新课讲解
二、金属与酸的反应
新课讲解
知识拓展:金属与酸反应产生氢气质量的分析
1、酸足量时:
例如:a g金属M(其相对原子质量为 m,在化合物中显示的化合价为 n)与足量稀盐酸反应,生成氢气的质量为x ,求算过程如下。
M + 2nHCl == 2MCln + H2↑
m n
a g x
—— = ——
m
n
a g
x
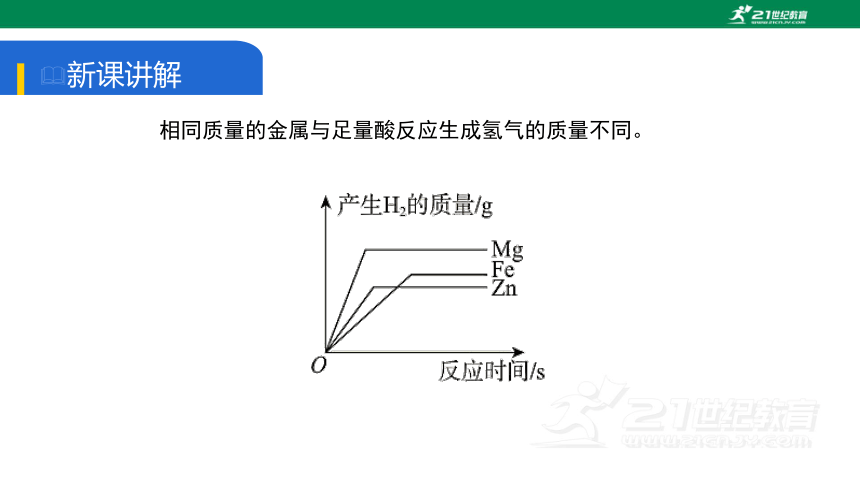
金属的质量和化合价均相同时,金属的相对原子质量越大,生成氢气的质量越小。
如:相同质量的Mg、Zn、Fe分别与足量的稀硫酸反应,生成氢气的质量关系为:Mg>Fe>Zn。
a·n
m
x= —— g
—
n
2
氢气质量=
金属的化合价×金属的质量
金属的相对原子质量
新课讲解
相同质量的金属与足量酸反应生成氢气的质量不同。
新课讲解
2、酸不足时:
金属与等质量同浓度的同种酸反应时,生成氢气的质量相等。
如:足量的Mg、Zn、Fe分别与等质量等质量分数的稀硫酸反应,生成氢气的质量关系为:Mg=Fe=Zn。
归纳小结
1、大多数金属能与氧气反应生成对应的金属氧化物;
2、较活泼金属能与盐酸或稀硫酸反应生成金属化合物和氢气;
3、酸足量时,相同质量的金属与足量酸反应生成氢气的质量不同;酸不足时,金属与等质量同浓度的同种酸反应时,生成氢气的质量相等。
强化训练
1、下列物质在一定条件下能与氧气反应,且生成物为黑色固体的一组是( )
①Mg ②Al ③Fe ④Au ⑤Cu
A.①和③ B.只有③ C.③④⑤ D.③和⑤
D
【解析】
在描述物质燃烧的现象时,需要注意实验结论和实验现象的区别。题目中所给的五种金属中只有金不与氧气发生反应,而能与氧气反应的四种金属中,铁与氧气反应可以得到黑色固体四氧化三铁和铜与氧气反应生成黑色的氧化铜,而镁与氧气反应生成白色固体氧化镁,铝和氧气反应生成白色的氧化铝。
强化训练
2、下列物质中,可用金属跟盐酸直接反应而制得的是( )
A.FeCl3 B.CuCl2 C.AlCl3 D.AgCl
C
【解析】
根据所列金属化合物中金属元素所对应的金属单质与盐酸反应的规律,判断该金属单质是否可以与盐酸反应生成该盐。
A、铁能与盐酸反应生成氯化亚铁,不是氯化铁,错误;
B、铜不与盐酸反应,错误;
C、铝与盐酸反应生成氯化铝,正确;
D、银不与盐酸反应,错误。
强化训练
B
【解析】A.反应物是一种,生成物是两种,符合分解反应的特点,属于分解反应;B.反应物是一种单质和化合物,生成物是另一种单质和另一种单质和化合物,属于置换反应;C.反应物是两种,生成物是一种,属于化合反应;D.反应物是两种化合物,生成物是两种不同的化合物,因此不属于置换反应。
3、以下是四个化学反应的微观示意图,图中不同的圆圈代表不同的原子,其中能表示置换反应的是( )
A. B.
C. D.
布置作业
实验室常用锌粒和稀硫酸来制取氢气,结合本课学习分析:为什么选择锌粒,而不选择镁条或铁片?
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
第八单元 金属和金属材料
课题2 金属的化学性质
第一课时 金属的化学性质
人教版九年级下册
新课引入
你有没有发现,日常生活中使用的铝制品的表面
总是光亮的。为什么铝制品不易生锈呢?
薄膜可以阻止内部的铝进一步被氧化,从而对铝制品起到了保护作用。
铝比较活泼,在常温下就很容易与氧气反应。
生成一层致密而坚固的氧化铝薄膜。
新课讲解
一、金属与氧气的反应
金属 现象 化学方程式
铝(片)
镁(条)
铁(丝)
铜(片)
发出耀眼的白光,放出大量的热,生成一种白色固体
剧烈燃烧,火星四射,放出大量的热,生成黑色固体
铜表面由紫红色变成黑色
多数金属都能与氧气反应生成氧化物,但反应的难易和剧烈程度不同。
2Mg+O2==== 2MgO
点燃
3Fe+2O2==== Fe3O4
点燃
2Cu+O2==== 2CuO
△
4Al+3O2=== 2Al2O3
铁丝在氧气中燃烧
新课讲解
二、金属与酸的反应
实验 现象 反应的化学方程式
镁条+稀盐酸
锌粒+稀盐酸
铁钉与稀盐酸
铜丝+稀盐酸
不反应
Fe+2HCl=FeCl2+H2↑
Zn+ 2HCl=ZnCl2+H2↑
Mg+2HCl=MgCl2+H2↑
无明显现象
迅速反应,有大量气泡冒出
反应较快,有气泡冒出
反应较慢,冒出气泡;一段时间后可观察到溶液变为浅绿色
结论:活泼金属与稀酸(稀盐酸、稀硫酸)反应生成金属化合物和氢气;
注意:铁与稀酸反应生成的化合物中铁元素为+2价。
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,叫做置换反应。
新课讲解
二、金属与酸的反应
新课讲解
知识拓展:金属与酸反应产生氢气质量的分析
1、酸足量时:
例如:a g金属M(其相对原子质量为 m,在化合物中显示的化合价为 n)与足量稀盐酸反应,生成氢气的质量为x ,求算过程如下。
M + 2nHCl == 2MCln + H2↑
m n
a g x
—— = ——
m
n
a g
x
金属的质量和化合价均相同时,金属的相对原子质量越大,生成氢气的质量越小。
如:相同质量的Mg、Zn、Fe分别与足量的稀硫酸反应,生成氢气的质量关系为:Mg>Fe>Zn。
a·n
m
x= —— g
—
n
2
氢气质量=
金属的化合价×金属的质量
金属的相对原子质量
新课讲解
相同质量的金属与足量酸反应生成氢气的质量不同。
新课讲解
2、酸不足时:
金属与等质量同浓度的同种酸反应时,生成氢气的质量相等。
如:足量的Mg、Zn、Fe分别与等质量等质量分数的稀硫酸反应,生成氢气的质量关系为:Mg=Fe=Zn。
归纳小结
1、大多数金属能与氧气反应生成对应的金属氧化物;
2、较活泼金属能与盐酸或稀硫酸反应生成金属化合物和氢气;
3、酸足量时,相同质量的金属与足量酸反应生成氢气的质量不同;酸不足时,金属与等质量同浓度的同种酸反应时,生成氢气的质量相等。
强化训练
1、下列物质在一定条件下能与氧气反应,且生成物为黑色固体的一组是( )
①Mg ②Al ③Fe ④Au ⑤Cu
A.①和③ B.只有③ C.③④⑤ D.③和⑤
D
【解析】
在描述物质燃烧的现象时,需要注意实验结论和实验现象的区别。题目中所给的五种金属中只有金不与氧气发生反应,而能与氧气反应的四种金属中,铁与氧气反应可以得到黑色固体四氧化三铁和铜与氧气反应生成黑色的氧化铜,而镁与氧气反应生成白色固体氧化镁,铝和氧气反应生成白色的氧化铝。
强化训练
2、下列物质中,可用金属跟盐酸直接反应而制得的是( )
A.FeCl3 B.CuCl2 C.AlCl3 D.AgCl
C
【解析】
根据所列金属化合物中金属元素所对应的金属单质与盐酸反应的规律,判断该金属单质是否可以与盐酸反应生成该盐。
A、铁能与盐酸反应生成氯化亚铁,不是氯化铁,错误;
B、铜不与盐酸反应,错误;
C、铝与盐酸反应生成氯化铝,正确;
D、银不与盐酸反应,错误。
强化训练
B
【解析】A.反应物是一种,生成物是两种,符合分解反应的特点,属于分解反应;B.反应物是一种单质和化合物,生成物是另一种单质和另一种单质和化合物,属于置换反应;C.反应物是两种,生成物是一种,属于化合反应;D.反应物是两种化合物,生成物是两种不同的化合物,因此不属于置换反应。
3、以下是四个化学反应的微观示意图,图中不同的圆圈代表不同的原子,其中能表示置换反应的是( )
A. B.
C. D.
布置作业
实验室常用锌粒和稀硫酸来制取氢气,结合本课学习分析:为什么选择锌粒,而不选择镁条或铁片?
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
