化学人教版(2019)必修第一册第一章 第1节 物质的分类及转化(共45张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册第一章 第1节 物质的分类及转化(共45张ppt) | 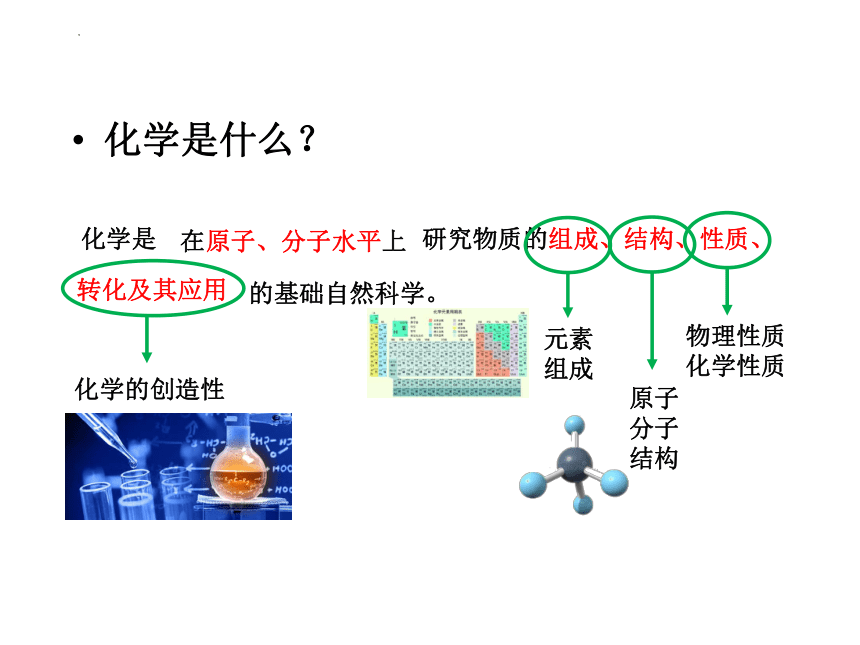 | |
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 07:06:08 | ||
图片预览








文档简介
(共45张PPT)
化学是什么?
化学是 研究物质的组成、结构、性质、
的基础自然科学。
在原子、分子水平上
元素
组成
原子
分子
结构
物理性质
化学性质
化学的创造性
转化及其应用
陶瓷
青花瓷
冶金
火药
造纸
印染
古代金属冶炼
古代火炮
西汉灞桥纸
现代纸的雏形
中国古代印染技术—三缬
我国古代化学
道尔顿
1803年提出原子学说,为近代化学发展奠定坚实基础。
拉瓦锡
1774年提出燃烧氧化学说,近代化学取得革命性进展。
波义耳
1661年提出元素的概念,标志着近代化学的诞生。
1811年提出分子学说,使人们对物质结构的认识发展到新的阶段。
1869年发现元素周期律,使化学的研究变得有规律可循。
阿伏伽德罗
门捷列夫
近代化学
今天的化学
在社会不断进步和科学技术迅猛发展的背景下,化学的传统研究领域出现了分化与综合,与其他学科形成交叉和相互渗透,成为自然科学领域中一门“中心的”“实用的”“创造性的”基础科学。
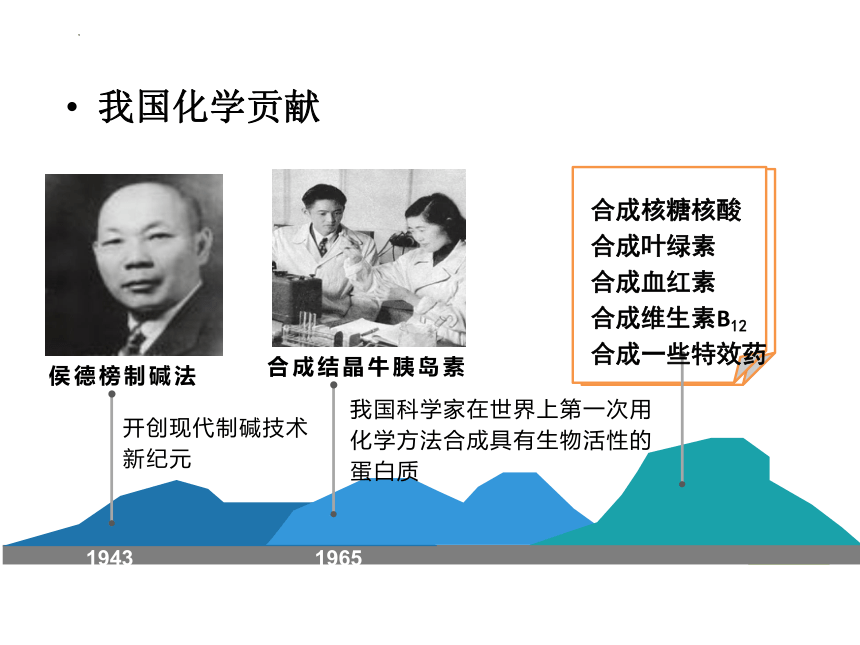
我国化学贡献
1943
1965
侯德榜制碱法
开创现代制碱技术新纪元
我国科学家在世界上第一次用化学方法合成具有生物活性的蛋白质
合成结晶牛胰岛素
合成核糖核酸
合成叶绿素
合成血红素
合成维生素B12
合成一些特效药
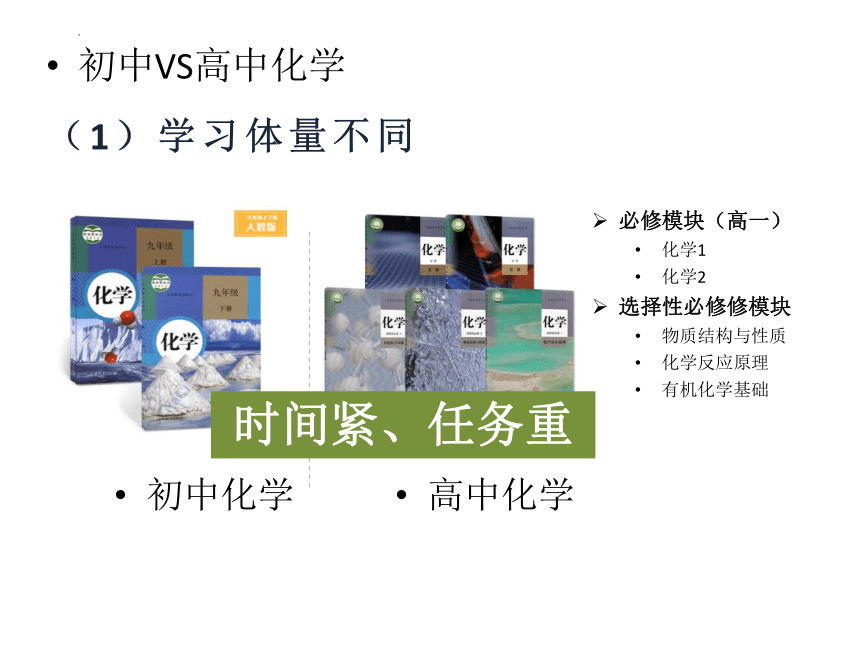
初中VS高中化学
(1)学习体量不同
初中化学
高中化学
必修模块(高一)
化学1
化学2
选择性必修修模块
物质结构与性质
化学反应原理
有机化学基础
时间紧、任务重
初中化学
高中化学
(2)学习要求不同
以识记、理解、简单计算为主
注重宏观与微观、定性与定量、描述与推理方面的结合。
实验与理论并重。
培养分析问题、解决问题的能力。
形成化学核心素养(宏观辨识、微观探析、变化观念、平衡思想、证据推理、模型认识)。
第一章 物质及其变化
第一节 物质的分类及转化
人教版 必修一
一、 物质的分类
任何物质都是由元素组成的,根据元素组成对物质
进行分类是化学研究的基础。
单质
化合物
由同一种元素形成的几种性质不同的单质,
叫做这种元素的同素异形体。
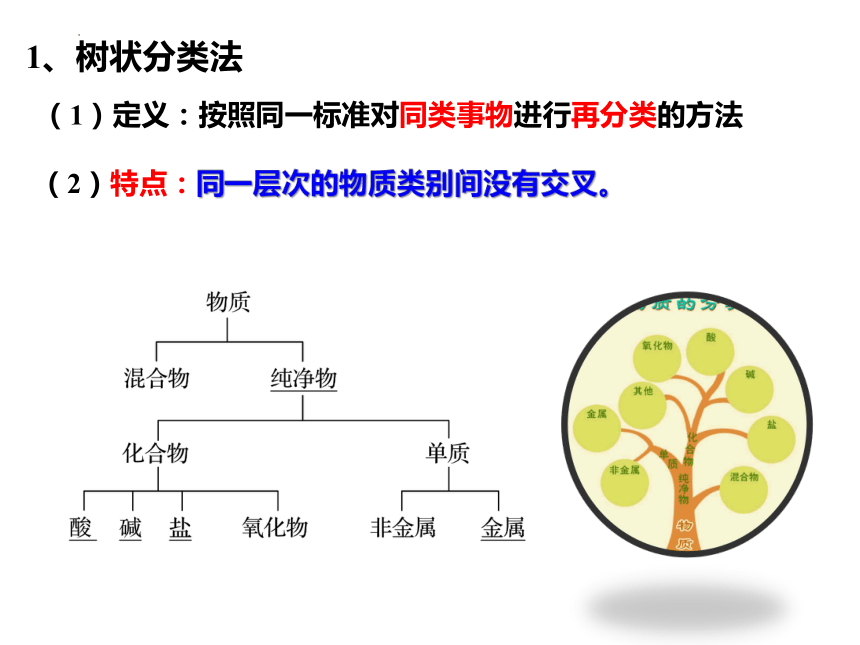
1、树状分类法
(1)定义:按照同一标准对同类事物进行再分类的方法
(2)特点:同一层次的物质类别间没有交叉。
2、交叉分类法
(1)定义:根据不同的分类标准(组成、性质、结构、用途等),对同一事物进行多种分类的一种分类方法。
(2)特点:物质类别间有交叉的部分。
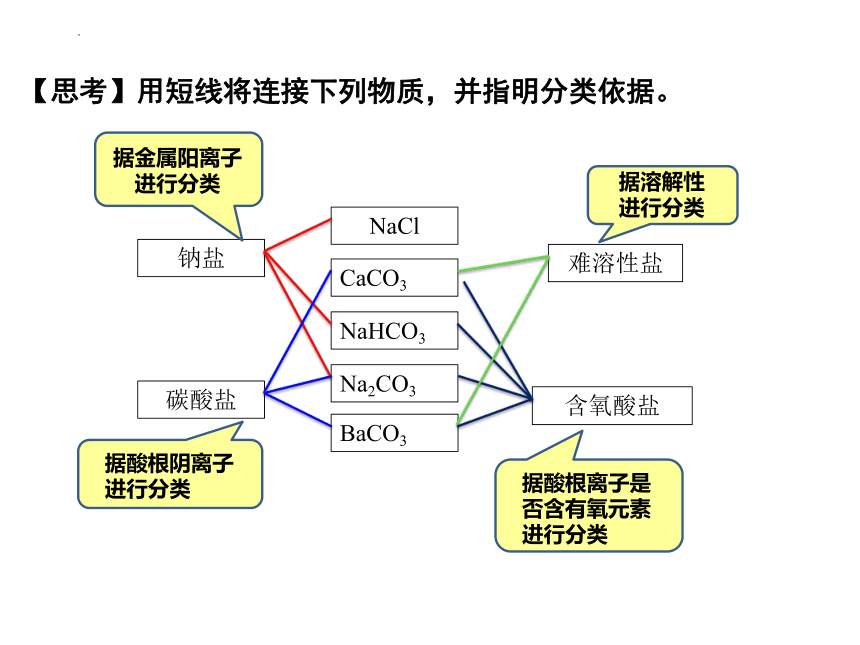
NaCl
CaCO3
NaHCO3
Na2CO3
BaCO3
钠盐
碳酸盐
含氧酸盐
据金属阳离子进行分类
据酸根阴离子
进行分类
据酸根离子是否含有氧元素
进行分类
【思考】用短线将连接下列物质,并指明分类依据。
难溶性盐
据溶解性
进行分类
物 质
是否由同一种物质组成
纯净物
混合物
是否由同种元素组成
单 质
化合物
金属
非金属单质
根据组成和性质
(2)酸
(3)碱
(4)盐
(1)氧化物
有机化合物
※无机化合物
是否含碳.氢元素
K Ca Na Mg Al Zn Fe.......
Cl2 S Si N2
CH4 乙醇 乙酸(必修第二册)
按元素性质
2.物质的分类
D
C
A
B
B
D
D
B
(1)氧化物的分类:
①Na2O ②CO2 ③CaO ④Al2O3 ⑤CO ⑥Mn2O7 ⑦Na2O2 ⑧SO2
酸性氧化物
过氧化物
按组成元素
氧化物
金属氧化物:
非金属氧化物:
*按化学性质
不成盐氧化物:
※成盐氧化物
碱性氧化物
两性氧化物
①③④⑥⑦
②⑤⑧
⑦
⑤
①③
②⑥⑧
④
生石灰
过氧化钠
与碱反应只生成盐和水的氧化物(有对应酸的氧化物)
碱性氧化物一定是金属氧化物,
金属氧化物不一定是碱性氧化物(Al2O3 、Mn2O7、Na2O2);
酸性氧化物不一定是非金属氧化物(Mn2O7 ),
非金属氧化物不一定是酸性氧化物(CO)。
与酸反应只生成盐和水的氧化物(有对应碱的氧化物)
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物
(2)酸的分类:
①HCl ②H2SO4 ③HNO3 ④H3PO4 ⑤CH3COOH(醋酸) ⑥H2CO3 ⑦H2S
多元酸
按强弱
酸
强酸
弱酸
※按电离出H+的个数
一元酸
二元酸
按酸根是否含氧
含氧酸
无氧酸
①②③
④⑤⑥⑦
①③⑤
②⑥⑦
④
②③④⑤⑥
①⑦
六大强酸:HCl、H2SO4、HNO3、HI、HBr、HClO4(高氯酸)
与氢的个数无直接关系
(3)碱的分类:
①NaOH ②KOH ③Ca(OH)2 ④Al(OH)3 ⑤NH3·H2O ⑥Fe(OH)3 ⑦Cu(OH)2 ⑧Ba(OH)2
多元碱
按强弱
碱
强碱
弱碱
※按电离出OH-的个数
一元碱
二元碱
按碱的溶解性
可溶性碱
难溶性碱
①②③⑧
①②⑤
④⑤⑥⑦
③⑦⑧
④⑥
①②⑤⑧
④⑥⑦
烧碱、火碱、苛性钠
红褐色
蓝色
四大强碱:NaOH、KOH 、Ca(OH)2 、Ba(OH)2
白色
熟石灰
(4)盐的分类:
①NaCl ②KNO3 ③Na2CO3 ④NaHCO3 ⑤NH4HCO3 ⑥Cu2(OH)2CO3 ⑦CaCO3 ⑧BaSO4⑨KAl(SO4)2·12H2O
碱式盐
按水溶性
盐
可溶性盐
难溶盐
※按离子组成
正盐
酸式盐
按酸根是否含氧
含氧酸盐
复盐
无氧酸盐
①②③④⑤⑨
⑥⑦⑧
①②③⑦⑧
④⑤
⑥
⑨
②③④⑤⑥
⑦⑧⑨
①
小苏打
苏打、纯碱
明矾
铜绿
金属阳离子(或NH4+)与酸根阴离子结合形成的化合物
只能电离出金属阳离子(或NH4+)与酸根阴离子的盐
除了电离出金属阳离子(或NH4+)与酸根阴离子外,还能电离出H+的盐
除了电离出金属阳离子(或NH4+)与酸根阴离子外,还能电离出OH-的盐
由两种或两种以上金属阳离子(或铵根离子)和一种酸根阴离子组成的盐
钾钠铵盐硝酸盐,完全溶解不困难;
碱中只溶钾、钠、钙、钡、铵(氢氧化钙微溶);
氯中只有银不溶;
硫酸不溶钙、钡、银、铅(硫酸钙、硫酸银微溶);
碳酸只溶钾、钠、铵(碳酸镁微溶)。
1.分类法是一种行之有效,简单易行的科学方法,人们在认识事物时可以采取多种分类方法,下列关于“Na2CO3”的分类不正确的是( )
A.化合物 B.氧化物 C.碳酸盐 D.钠盐
2.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )
A.NH3 B.CH4 C.NaHCO3 D.HClO3
3.下列各物质中,均为纯净物的一组是 ( )
A.碘酒、干冰 B.石油、液氨
C.Na2CO3·10H2O、Na2CO3 D.石灰石、氨水
【反馈练习】
B
D
C
4.科学家在研究化学物质时。常常对物质进行分类。以便对同类物质组成和性能进行深入的研究。下列各组物质中有一种物质与其它物质不属于同一类。请将其找出来。并说明理由。
物质组 不属于同一类 的物质 理由
Mg、O2、N2、NO
NaOH、Na2CO3、CH4、KCl
H2CO3、H2SO4、NH3·H2O、H2SiO3
CaO、SO2、CO2、SiO2
5.下列物质的分类正确的是( )
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O NO
C KOH HNO3 CaCO3 CaO Mn2O7
D NaOH HCl CaF2 Na2O2 SO2
NO
CH4
NH3·H2O
CaO
金属氧化物,其余为非金属氧化物
碱,其余为酸
有机物(或氢化物),其余为无机物
氧化物(或化合物),其余为单质
C
二、分散系及其分类
把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
被分散成粒子的物质
起容纳分散质作用的物质
CuSO4
溶液
泥水
CuSO4
泥沙
水
水
1、分散系
(1)概念
(2)分散系的分类
①按照分散质或分散剂的聚集状态(气、液、固)来分:
有9种类型。
分散质
分散剂
气 态
液 态
固 态
固 态
液 态
气 态
分散质 分散剂 实 例
气 气
液
固
气 液
液
固
气 固
液
固
空气
云、雾
烟、灰尘
汽水
酒精的水溶液
糖水、油漆、泥水
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
常见的一些分散系
②按照分散质粒子的大小分为:溶液、胶体、浊液
溶液
胶体
浊液
2、胶体
(1)定义:分散质微粒的直径大小在1 nm ~100 nm(10-9~10-7m )之间的分散系叫做胶体。
胶体中分散质粒子常称为胶粒。
常见的胶体:
烟、云、雾、血液、牛奶、豆浆、米粥、汤、蛋清、胶水、墨水、液状涂料、肥皂水、淀粉溶液、果冻、有色玻璃、变色玻璃、土壤胶体。
按照分散剂的状态不同,
可以将胶体分为
气溶胶
液溶胶
固溶胶
(2)胶体的分类
分散系 溶液 胶体(液溶胶) 浊液
分散质微粒直径
分散质粒子
能否透过滤纸
< 1 nm
1 ~100 nm
>100 nm
单个分子或
离子
许多分子集合体或高分子
大量分子集
合体
能
能
不能
能
不能
不能
稳定
介稳性
不稳定
三种分散系的比较:
均一、透明
较均一、较透明
不均一、
不透明
能否透过半透膜
外观
稳定性
①实验中如何证明胶体中分散质粒子的直径比溶液的大?
思
考
②实验中如何证明浊液中分散质粒子的直径比胶体的大?
胶体的净化与精制
——渗析法
渗析:用半透膜把胶体中混有的离子或分子从胶体里分离的操作。
原理:胶粒不能透过半透膜,而溶质能透过半透膜。
(半透膜:只能容许某些分子或离子通过的薄膜)
一定时间之后,
烧杯中能够检测出的是:
检测不出的是:
盛有淀粉胶体和食盐溶液
的半透膜浸在蒸馏水中
氯化钠
淀粉
现象:过滤Fe(OH)3胶体的滤纸上 残留物;过滤泥水的滤纸上 有残留物。
无
有
将Fe(OH)3胶体和泥水分别过滤:
操作:向沸水中逐滴加入5~6滴 ,
继续煮沸至液体呈 ,停止加热。
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
(1)胶体的制备 (以Fe(OH)3胶体的制备为例)
FeCl3饱和溶液
红褐色
反应的化学方程式为:
3、胶体的制备及性质
(2)胶体的性质
①丁达尔效应:当光束通过胶体时,(从侧面观察)可以看到一条光亮的“通路”。
应用:区分胶体与溶液的一种常用物理方法。
原因:由于胶体粒子对光线散射而形成的光亮的通路。
科学探究
实验操作 实验现象 结论
当用光束照射时,盛Fe(OH)3胶体的烧杯中有__________
,盛CuSO4溶液的烧杯中________________。
胶体能够发生
一条光亮的通路
没有光亮的通路
丁达尔效应
当光束通过胶体时,可以看到一条光亮
的“通路”,这是胶体粒子对光线散射
而形成的,这种现象叫做丁达尔效应.
布朗运动:小颗粒做不停地、无秩序地运动,这种现象叫做布朗运动。
②介稳性
胶体的稳定性介于溶液和浊液之间,在一定条件下可以
稳定存在,属于介稳体系.
主因:胶体粒子可以通过吸附而带有同种电荷,相互排斥.
次因:胶体粒子做布朗运动.
③电泳
电泳:在外加电场的作用下,胶体粒子在分散剂里向电极做定向移动的现象叫电泳(向着与其电性相反的电极移动)。
问题1 .通电后,U形管里阴极附近的红褐色逐渐变深,阳极附近的红褐色逐渐变浅,这表明阴极附近什么微粒增多了?
阴极附近Fe(OH)3胶粒增多了。
问题2.Fe(OH)3胶粒向阴极作定向移动,说明它具有什么样的电性?
说明Fe(OH)3胶粒是带正电荷的。
问题3.为什么胶体微粒带有电荷?
表面积大,吸附力强,吸附阴离子的带上负电荷,吸附阳离子的带上正电荷。
胶粒带正电:金属氢氧化物、金属氧化物的胶粒因吸附阳离子而带正电,如Fe(OH)3 , Al(OH)3 ,Fe2O3 ;
不带电:淀粉溶液一类的高分子胶体粒子是不带电的
胶体粒子可以带电荷,但整个胶体呈电中性
(不能说“胶体”带电,带电的是“胶粒”)
胶粒带负电:非金属氧化物、金属硫化物的胶粒因吸附阴离子而带负电,如 As2S3 , Sb2S3 , As2O3 , H2SiO3 (另外土壤胶粒也带负电)
③电泳
电泳:在外加电场的作用下,胶体粒子在分散剂里向电极做定向移动的现象叫电泳(向着与其电性相反的电极移动)。
应用:静电除尘,电泳电镀等。
原理:中和胶粒所带电荷,减弱胶粒间的电性排斥,使之聚集成大颗粒沉淀下来。
应用实例:豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;江河入海处有三角洲;氯化铁止血等
方法:a.加入少量电解质
④胶体的聚沉
使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出的过程叫做聚沉。
原理:带不同电荷胶粒的胶体微粒相互吸引发生电性中和,从而在胶粒碰撞时发生凝聚,形成沉淀。
应用实例:明矾净水,墨水堵笔等
b.加入带相反电荷胶粒的胶体
c.加热
原理:加速胶粒碰撞,使胶粒在碰撞时容易结合成大颗粒,形成沉淀。
应用实例:淀粉溶液加热后凝聚成了浆糊凝胶,煮鸡蛋
定义:利用半透膜把胶体中混有的离子或分子从胶体溶液里分离出来的操作,叫做渗析。
原理:胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。
应用:分离和提纯胶体、血液透析
⑤渗析
练习
1、下列关于胶体的叙述中,不正确的是( )
A.向胶体中加入蔗糖溶液,产生聚沉现象
B.一束可见光透过胶体时,产生丁达尔效应
C.用渗析的方法“净化”胶体时,使用的半透膜只能让分子通过
D.胶体能够吸附阴离子和阳离子,故在电场的作用下,会产生电泳现象
A
2、不能用胶体的知识解释的现象是( )
A.豆浆中加入石膏做豆腐
B.一支钢笔使用两种不同牌号的墨水,易
出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色
D.在海水与河水交界处,易形成三角洲
C
3、将某溶液逐滴加入Fe(OH)3溶胶中,开始产生沉淀,继续滴加沉淀又溶解,该溶液是( )
A.硫化锑溶胶
B.2mol/L NaOH溶液
C.2mol/L H2SO4溶液
D.2mol/L MgSO4溶液
C
4、在冶金厂和水泥厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种处理方法应用的原理是
( )
A. 丁达尔效应 B. 电泳 C. 凝聚 D. 渗析
B
四、物质的转化
2、物质的转化
应用
(1)同类事物在某些方面的相似性可以帮助我们举一反三。
(2)对不同类事物的了解使我们有可能做到由此及彼。
(3)可以帮助我们找出各类物质之间的联系。
实例: Ca CaO Ca(OH)2 CaCO3
C CO2 H2CO3 CaCO3
请写出序号所示反应的化学方程式。
①_______________ ②___________________
③__________________________
④_____________ ⑤________________
⑥______________________________
①
②
③
④
⑤
⑥
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3↓+H2O
C+O2 CO2
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
点燃
==
化学是什么?
化学是 研究物质的组成、结构、性质、
的基础自然科学。
在原子、分子水平上
元素
组成
原子
分子
结构
物理性质
化学性质
化学的创造性
转化及其应用
陶瓷
青花瓷
冶金
火药
造纸
印染
古代金属冶炼
古代火炮
西汉灞桥纸
现代纸的雏形
中国古代印染技术—三缬
我国古代化学
道尔顿
1803年提出原子学说,为近代化学发展奠定坚实基础。
拉瓦锡
1774年提出燃烧氧化学说,近代化学取得革命性进展。
波义耳
1661年提出元素的概念,标志着近代化学的诞生。
1811年提出分子学说,使人们对物质结构的认识发展到新的阶段。
1869年发现元素周期律,使化学的研究变得有规律可循。
阿伏伽德罗
门捷列夫
近代化学
今天的化学
在社会不断进步和科学技术迅猛发展的背景下,化学的传统研究领域出现了分化与综合,与其他学科形成交叉和相互渗透,成为自然科学领域中一门“中心的”“实用的”“创造性的”基础科学。
我国化学贡献
1943
1965
侯德榜制碱法
开创现代制碱技术新纪元
我国科学家在世界上第一次用化学方法合成具有生物活性的蛋白质
合成结晶牛胰岛素
合成核糖核酸
合成叶绿素
合成血红素
合成维生素B12
合成一些特效药
初中VS高中化学
(1)学习体量不同
初中化学
高中化学
必修模块(高一)
化学1
化学2
选择性必修修模块
物质结构与性质
化学反应原理
有机化学基础
时间紧、任务重
初中化学
高中化学
(2)学习要求不同
以识记、理解、简单计算为主
注重宏观与微观、定性与定量、描述与推理方面的结合。
实验与理论并重。
培养分析问题、解决问题的能力。
形成化学核心素养(宏观辨识、微观探析、变化观念、平衡思想、证据推理、模型认识)。
第一章 物质及其变化
第一节 物质的分类及转化
人教版 必修一
一、 物质的分类
任何物质都是由元素组成的,根据元素组成对物质
进行分类是化学研究的基础。
单质
化合物
由同一种元素形成的几种性质不同的单质,
叫做这种元素的同素异形体。
1、树状分类法
(1)定义:按照同一标准对同类事物进行再分类的方法
(2)特点:同一层次的物质类别间没有交叉。
2、交叉分类法
(1)定义:根据不同的分类标准(组成、性质、结构、用途等),对同一事物进行多种分类的一种分类方法。
(2)特点:物质类别间有交叉的部分。
NaCl
CaCO3
NaHCO3
Na2CO3
BaCO3
钠盐
碳酸盐
含氧酸盐
据金属阳离子进行分类
据酸根阴离子
进行分类
据酸根离子是否含有氧元素
进行分类
【思考】用短线将连接下列物质,并指明分类依据。
难溶性盐
据溶解性
进行分类
物 质
是否由同一种物质组成
纯净物
混合物
是否由同种元素组成
单 质
化合物
金属
非金属单质
根据组成和性质
(2)酸
(3)碱
(4)盐
(1)氧化物
有机化合物
※无机化合物
是否含碳.氢元素
K Ca Na Mg Al Zn Fe.......
Cl2 S Si N2
CH4 乙醇 乙酸(必修第二册)
按元素性质
2.物质的分类
D
C
A
B
B
D
D
B
(1)氧化物的分类:
①Na2O ②CO2 ③CaO ④Al2O3 ⑤CO ⑥Mn2O7 ⑦Na2O2 ⑧SO2
酸性氧化物
过氧化物
按组成元素
氧化物
金属氧化物:
非金属氧化物:
*按化学性质
不成盐氧化物:
※成盐氧化物
碱性氧化物
两性氧化物
①③④⑥⑦
②⑤⑧
⑦
⑤
①③
②⑥⑧
④
生石灰
过氧化钠
与碱反应只生成盐和水的氧化物(有对应酸的氧化物)
碱性氧化物一定是金属氧化物,
金属氧化物不一定是碱性氧化物(Al2O3 、Mn2O7、Na2O2);
酸性氧化物不一定是非金属氧化物(Mn2O7 ),
非金属氧化物不一定是酸性氧化物(CO)。
与酸反应只生成盐和水的氧化物(有对应碱的氧化物)
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物
(2)酸的分类:
①HCl ②H2SO4 ③HNO3 ④H3PO4 ⑤CH3COOH(醋酸) ⑥H2CO3 ⑦H2S
多元酸
按强弱
酸
强酸
弱酸
※按电离出H+的个数
一元酸
二元酸
按酸根是否含氧
含氧酸
无氧酸
①②③
④⑤⑥⑦
①③⑤
②⑥⑦
④
②③④⑤⑥
①⑦
六大强酸:HCl、H2SO4、HNO3、HI、HBr、HClO4(高氯酸)
与氢的个数无直接关系
(3)碱的分类:
①NaOH ②KOH ③Ca(OH)2 ④Al(OH)3 ⑤NH3·H2O ⑥Fe(OH)3 ⑦Cu(OH)2 ⑧Ba(OH)2
多元碱
按强弱
碱
强碱
弱碱
※按电离出OH-的个数
一元碱
二元碱
按碱的溶解性
可溶性碱
难溶性碱
①②③⑧
①②⑤
④⑤⑥⑦
③⑦⑧
④⑥
①②⑤⑧
④⑥⑦
烧碱、火碱、苛性钠
红褐色
蓝色
四大强碱:NaOH、KOH 、Ca(OH)2 、Ba(OH)2
白色
熟石灰
(4)盐的分类:
①NaCl ②KNO3 ③Na2CO3 ④NaHCO3 ⑤NH4HCO3 ⑥Cu2(OH)2CO3 ⑦CaCO3 ⑧BaSO4⑨KAl(SO4)2·12H2O
碱式盐
按水溶性
盐
可溶性盐
难溶盐
※按离子组成
正盐
酸式盐
按酸根是否含氧
含氧酸盐
复盐
无氧酸盐
①②③④⑤⑨
⑥⑦⑧
①②③⑦⑧
④⑤
⑥
⑨
②③④⑤⑥
⑦⑧⑨
①
小苏打
苏打、纯碱
明矾
铜绿
金属阳离子(或NH4+)与酸根阴离子结合形成的化合物
只能电离出金属阳离子(或NH4+)与酸根阴离子的盐
除了电离出金属阳离子(或NH4+)与酸根阴离子外,还能电离出H+的盐
除了电离出金属阳离子(或NH4+)与酸根阴离子外,还能电离出OH-的盐
由两种或两种以上金属阳离子(或铵根离子)和一种酸根阴离子组成的盐
钾钠铵盐硝酸盐,完全溶解不困难;
碱中只溶钾、钠、钙、钡、铵(氢氧化钙微溶);
氯中只有银不溶;
硫酸不溶钙、钡、银、铅(硫酸钙、硫酸银微溶);
碳酸只溶钾、钠、铵(碳酸镁微溶)。
1.分类法是一种行之有效,简单易行的科学方法,人们在认识事物时可以采取多种分类方法,下列关于“Na2CO3”的分类不正确的是( )
A.化合物 B.氧化物 C.碳酸盐 D.钠盐
2.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )
A.NH3 B.CH4 C.NaHCO3 D.HClO3
3.下列各物质中,均为纯净物的一组是 ( )
A.碘酒、干冰 B.石油、液氨
C.Na2CO3·10H2O、Na2CO3 D.石灰石、氨水
【反馈练习】
B
D
C
4.科学家在研究化学物质时。常常对物质进行分类。以便对同类物质组成和性能进行深入的研究。下列各组物质中有一种物质与其它物质不属于同一类。请将其找出来。并说明理由。
物质组 不属于同一类 的物质 理由
Mg、O2、N2、NO
NaOH、Na2CO3、CH4、KCl
H2CO3、H2SO4、NH3·H2O、H2SiO3
CaO、SO2、CO2、SiO2
5.下列物质的分类正确的是( )
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O NO
C KOH HNO3 CaCO3 CaO Mn2O7
D NaOH HCl CaF2 Na2O2 SO2
NO
CH4
NH3·H2O
CaO
金属氧化物,其余为非金属氧化物
碱,其余为酸
有机物(或氢化物),其余为无机物
氧化物(或化合物),其余为单质
C
二、分散系及其分类
把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
被分散成粒子的物质
起容纳分散质作用的物质
CuSO4
溶液
泥水
CuSO4
泥沙
水
水
1、分散系
(1)概念
(2)分散系的分类
①按照分散质或分散剂的聚集状态(气、液、固)来分:
有9种类型。
分散质
分散剂
气 态
液 态
固 态
固 态
液 态
气 态
分散质 分散剂 实 例
气 气
液
固
气 液
液
固
气 固
液
固
空气
云、雾
烟、灰尘
汽水
酒精的水溶液
糖水、油漆、泥水
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
常见的一些分散系
②按照分散质粒子的大小分为:溶液、胶体、浊液
溶液
胶体
浊液
2、胶体
(1)定义:分散质微粒的直径大小在1 nm ~100 nm(10-9~10-7m )之间的分散系叫做胶体。
胶体中分散质粒子常称为胶粒。
常见的胶体:
烟、云、雾、血液、牛奶、豆浆、米粥、汤、蛋清、胶水、墨水、液状涂料、肥皂水、淀粉溶液、果冻、有色玻璃、变色玻璃、土壤胶体。
按照分散剂的状态不同,
可以将胶体分为
气溶胶
液溶胶
固溶胶
(2)胶体的分类
分散系 溶液 胶体(液溶胶) 浊液
分散质微粒直径
分散质粒子
能否透过滤纸
< 1 nm
1 ~100 nm
>100 nm
单个分子或
离子
许多分子集合体或高分子
大量分子集
合体
能
能
不能
能
不能
不能
稳定
介稳性
不稳定
三种分散系的比较:
均一、透明
较均一、较透明
不均一、
不透明
能否透过半透膜
外观
稳定性
①实验中如何证明胶体中分散质粒子的直径比溶液的大?
思
考
②实验中如何证明浊液中分散质粒子的直径比胶体的大?
胶体的净化与精制
——渗析法
渗析:用半透膜把胶体中混有的离子或分子从胶体里分离的操作。
原理:胶粒不能透过半透膜,而溶质能透过半透膜。
(半透膜:只能容许某些分子或离子通过的薄膜)
一定时间之后,
烧杯中能够检测出的是:
检测不出的是:
盛有淀粉胶体和食盐溶液
的半透膜浸在蒸馏水中
氯化钠
淀粉
现象:过滤Fe(OH)3胶体的滤纸上 残留物;过滤泥水的滤纸上 有残留物。
无
有
将Fe(OH)3胶体和泥水分别过滤:
操作:向沸水中逐滴加入5~6滴 ,
继续煮沸至液体呈 ,停止加热。
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
(1)胶体的制备 (以Fe(OH)3胶体的制备为例)
FeCl3饱和溶液
红褐色
反应的化学方程式为:
3、胶体的制备及性质
(2)胶体的性质
①丁达尔效应:当光束通过胶体时,(从侧面观察)可以看到一条光亮的“通路”。
应用:区分胶体与溶液的一种常用物理方法。
原因:由于胶体粒子对光线散射而形成的光亮的通路。
科学探究
实验操作 实验现象 结论
当用光束照射时,盛Fe(OH)3胶体的烧杯中有__________
,盛CuSO4溶液的烧杯中________________。
胶体能够发生
一条光亮的通路
没有光亮的通路
丁达尔效应
当光束通过胶体时,可以看到一条光亮
的“通路”,这是胶体粒子对光线散射
而形成的,这种现象叫做丁达尔效应.
布朗运动:小颗粒做不停地、无秩序地运动,这种现象叫做布朗运动。
②介稳性
胶体的稳定性介于溶液和浊液之间,在一定条件下可以
稳定存在,属于介稳体系.
主因:胶体粒子可以通过吸附而带有同种电荷,相互排斥.
次因:胶体粒子做布朗运动.
③电泳
电泳:在外加电场的作用下,胶体粒子在分散剂里向电极做定向移动的现象叫电泳(向着与其电性相反的电极移动)。
问题1 .通电后,U形管里阴极附近的红褐色逐渐变深,阳极附近的红褐色逐渐变浅,这表明阴极附近什么微粒增多了?
阴极附近Fe(OH)3胶粒增多了。
问题2.Fe(OH)3胶粒向阴极作定向移动,说明它具有什么样的电性?
说明Fe(OH)3胶粒是带正电荷的。
问题3.为什么胶体微粒带有电荷?
表面积大,吸附力强,吸附阴离子的带上负电荷,吸附阳离子的带上正电荷。
胶粒带正电:金属氢氧化物、金属氧化物的胶粒因吸附阳离子而带正电,如Fe(OH)3 , Al(OH)3 ,Fe2O3 ;
不带电:淀粉溶液一类的高分子胶体粒子是不带电的
胶体粒子可以带电荷,但整个胶体呈电中性
(不能说“胶体”带电,带电的是“胶粒”)
胶粒带负电:非金属氧化物、金属硫化物的胶粒因吸附阴离子而带负电,如 As2S3 , Sb2S3 , As2O3 , H2SiO3 (另外土壤胶粒也带负电)
③电泳
电泳:在外加电场的作用下,胶体粒子在分散剂里向电极做定向移动的现象叫电泳(向着与其电性相反的电极移动)。
应用:静电除尘,电泳电镀等。
原理:中和胶粒所带电荷,减弱胶粒间的电性排斥,使之聚集成大颗粒沉淀下来。
应用实例:豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;江河入海处有三角洲;氯化铁止血等
方法:a.加入少量电解质
④胶体的聚沉
使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出的过程叫做聚沉。
原理:带不同电荷胶粒的胶体微粒相互吸引发生电性中和,从而在胶粒碰撞时发生凝聚,形成沉淀。
应用实例:明矾净水,墨水堵笔等
b.加入带相反电荷胶粒的胶体
c.加热
原理:加速胶粒碰撞,使胶粒在碰撞时容易结合成大颗粒,形成沉淀。
应用实例:淀粉溶液加热后凝聚成了浆糊凝胶,煮鸡蛋
定义:利用半透膜把胶体中混有的离子或分子从胶体溶液里分离出来的操作,叫做渗析。
原理:胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。
应用:分离和提纯胶体、血液透析
⑤渗析
练习
1、下列关于胶体的叙述中,不正确的是( )
A.向胶体中加入蔗糖溶液,产生聚沉现象
B.一束可见光透过胶体时,产生丁达尔效应
C.用渗析的方法“净化”胶体时,使用的半透膜只能让分子通过
D.胶体能够吸附阴离子和阳离子,故在电场的作用下,会产生电泳现象
A
2、不能用胶体的知识解释的现象是( )
A.豆浆中加入石膏做豆腐
B.一支钢笔使用两种不同牌号的墨水,易
出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色
D.在海水与河水交界处,易形成三角洲
C
3、将某溶液逐滴加入Fe(OH)3溶胶中,开始产生沉淀,继续滴加沉淀又溶解,该溶液是( )
A.硫化锑溶胶
B.2mol/L NaOH溶液
C.2mol/L H2SO4溶液
D.2mol/L MgSO4溶液
C
4、在冶金厂和水泥厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种处理方法应用的原理是
( )
A. 丁达尔效应 B. 电泳 C. 凝聚 D. 渗析
B
四、物质的转化
2、物质的转化
应用
(1)同类事物在某些方面的相似性可以帮助我们举一反三。
(2)对不同类事物的了解使我们有可能做到由此及彼。
(3)可以帮助我们找出各类物质之间的联系。
实例: Ca CaO Ca(OH)2 CaCO3
C CO2 H2CO3 CaCO3
请写出序号所示反应的化学方程式。
①_______________ ②___________________
③__________________________
④_____________ ⑤________________
⑥______________________________
①
②
③
④
⑤
⑥
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3↓+H2O
C+O2 CO2
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
点燃
==
