化学人教版(2019)必修第一册4.2元素周期律(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2元素周期律(共29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 439.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 07:07:48 | ||
图片预览




文档简介
(共29张PPT)
第四章 物质结构 元素周期律
第二节 元素周期律
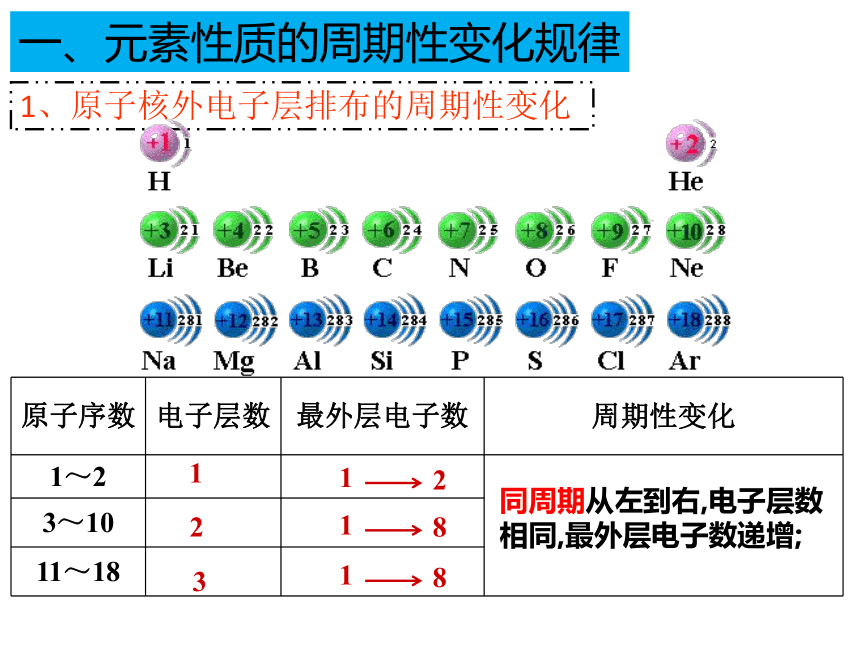
1、原子核外电子层排布的周期性变化
原子序数 电子层数 最外层电子数 周期性变化
1~2
3~10
11~18
1
2
3
1
2
1
8
1
8
一、元素性质的周期性变化规律
同周期从左到右,电子层数相同,最外层电子数递增;
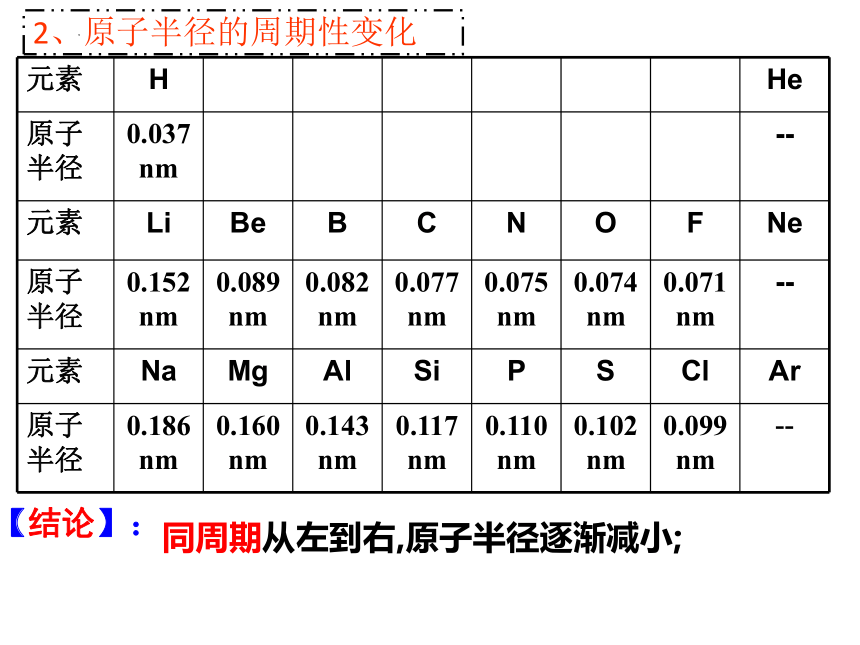
元素 H He
原子半径 0.037 nm --
元素 Li Be B C N O F Ne
原子半径 0.152 nm 0.089 nm 0.082nm 0.077 nm 0.075 nm 0.074 nm 0.071 nm --
元素 Na Mg Al Si P S Cl Ar
原子半径 0.186 nm 0.160 nm 0.143 nm 0.117 nm 0.110 nm 0.102 nm 0.099 nm --
同周期从左到右,原子半径逐渐减小;
【结论】:
2、原子半径的周期性变化
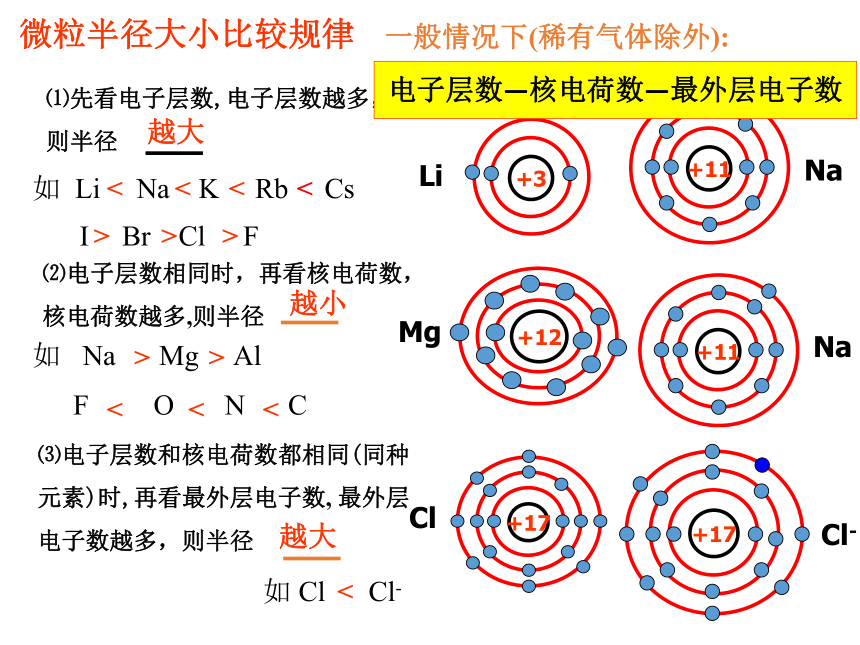
越大
越小
越大
⑵电子层数相同时,再看核电荷数,
核电荷数越多,则半径
⑶电子层数和核电荷数都相同(同种元素)时,再看最外层电子数, 最外层电子数越多,则半径
微粒半径大小比较规律
⑴先看电子层数,电子层数越多,
则半径
一般情况下(稀有气体除外):
如 Li Na K Rb Cs
I Br Cl F
<
<
<
<
>
>
>
>
如 Na Mg Al
>
F O N C
<
<
<
如 Cl Cl-
<
+3
Li
+11
Na
+11
Na
+12
Mg
+17
Cl
Cl-
+17
电子层数—核电荷数—最外层电子数
下列各组微粒半径大小比较中,不正确的是( )
r(K+) > r(K) B. r(Mg2+) > r(Na+) > r(F-)
C.r(Na+) > r(Mg2+) > r(Al3+) D.r(Cl -) > r(F-) > r(F)
AB
原子序数 最高或最低化合价的变化
1~2
3~10
11~18
+1
0
+1
+5
-4
-1
0
+1
+7
-4
-1
0
主族元素最高正价=主族序数=最外层电子数
最低负价 + 最高正价 = 8
3、化合价的周期性变化
常见元素化合价的一般规律:
② 最高正价=最外层电子数=(主)族序数(除O、F)
最高正价+︱最低负价︱= 8
③金属元素无负价;
既有正价又有负价的元素一定是非金属元素;
①氟元素无正价,氧元素通常不显正价 。
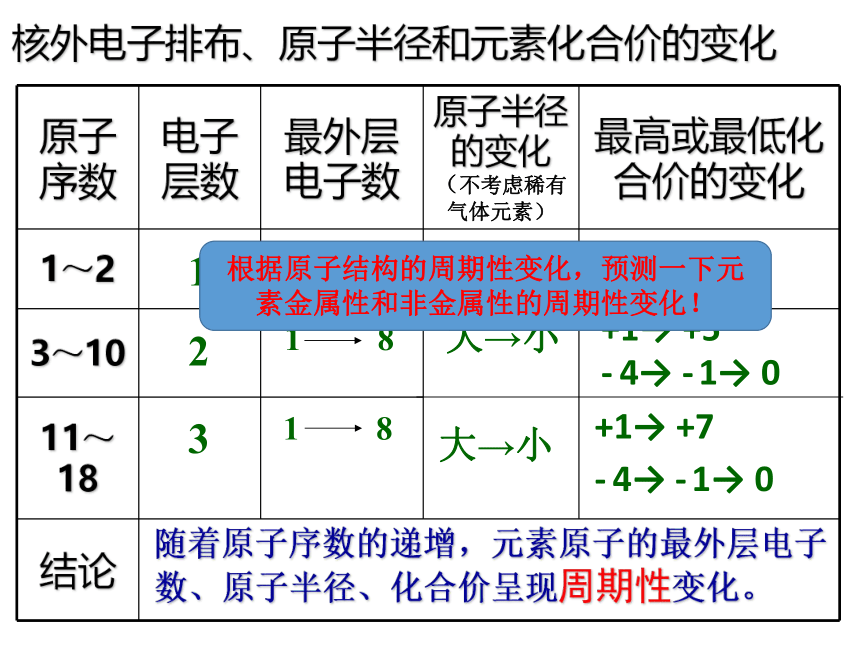
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1~2 ———
3~10
11~18
结论
1
2
3
1
2
1
8
1
8
大→小
+1 →0
+1→ +5
- 4→ - 1→ 0
随着原子序数的递增,元素原子的最外层电子数、原子半径、化合价呈现周期性变化。
核外电子排布、原子半径和元素化合价的变化
大→小
+1→ +7
- 4→ - 1→ 0
根据原子结构的周期性变化,预测一下元素金属性和非金属性的周期性变化!
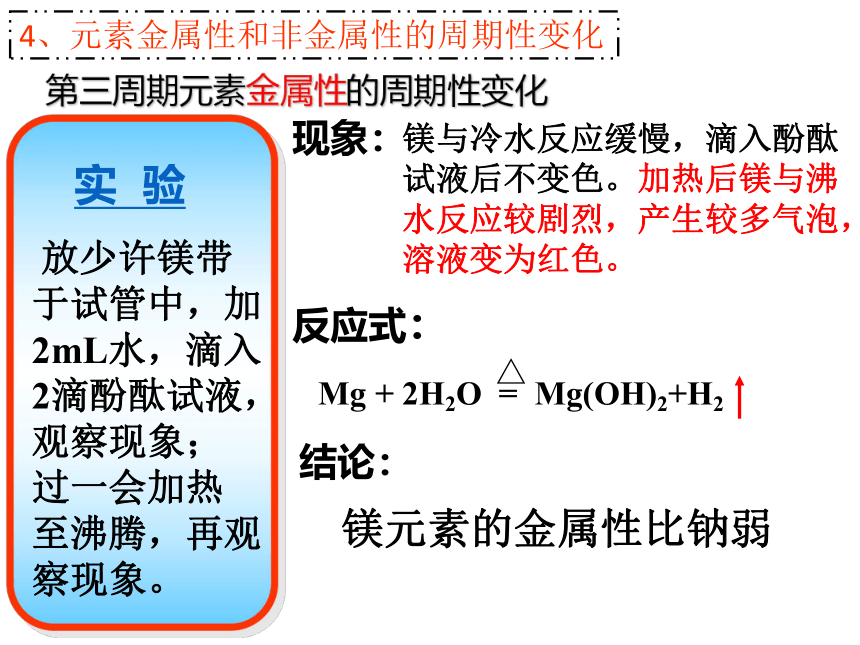
放少许镁带
于试管中,加
2mL水,滴入
2滴酚酞试液,
观察现象;
过一会加热
至沸腾,再观
察现象。
实 验
现象:
镁与冷水反应缓慢,滴入酚酞试液后不变色。加热后镁与沸水反应较剧烈,产生较多气泡,溶液变为红色。
反应式:
结论:
镁元素的金属性比钠弱
4、元素金属性和非金属性的周期性变化
Mg + 2H2O = Mg(OH)2+H2
△
第三周期元素金属性的周期性变化
向AlCl3溶液,
然后滴加氨水,
直到不再产生
白色絮状Al(OH)3
沉淀。将沉淀分装
在两支试管中,
一支加盐酸,
另一支滴加氢氧
化钠。观察现象。
实 验
现象:
Al(OH)3沉淀在酸或强碱溶液中都能溶解。
反应:
结论:
Al(OH)3是两性氢氧化物
Al(OH)3+3H+ = Al3++3H2O
Al(OH)3+ OH-=AlO2-+2H2O
向MgCl2溶液,
然后滴加氨水,
产生白色Mg(OH)2
沉淀。将沉淀分装
在两支试管中,
一支加盐酸,
另一支滴加氢氧
化钠。观察现象。
实 验
现象:
Mg(OH)2沉淀在酸中溶解,在碱中不溶解。
反应:
结论:
Mg(OH)2是弱碱(中强碱)
Mg(OH)2+2H+ = Mg2++2H2O
金属性:钠>镁>铝
综上:
14Si 15P 16S 17Cl
最高价氧化物的水化物及其酸性强弱
结论
H2SiO3 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸
酸性逐渐增强
非金属性逐渐增强
第三周期元素非金属性的周期性变化
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
电子层数相同核电荷数增多
原子半径减小
原子失电子能力逐渐减弱,得电子能力逐渐增强
同周期元素 从左到右
原子核对最外层电子的吸引力增强
金属性逐渐减弱,非金属性逐渐增强
1、随着原子序数的递增,元素原子的最外层电子呈现周期性变化。
2、随着原子序数的递增,元素原子半径呈现周期性变化。
3、随着原子序数的递增,元素的化合价呈现周期性变化。
4、随着原子序数的递增,元素的金属性和非金属性呈现周期性变化。
元素的性质随着原子序数的递增而呈现周期性变化。
元素周期律
BC
1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na能从MgCl2的溶液中把Mg置换出来;
练习
2.下列事实能说明非金属性Cl >S的是:
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,
S的最高正价为+6
AB
3.下列有关元素周期律的叙述正确的( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化
C
4.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
5.下列递变规律不正确的是 ( )
A.Na、Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高
AB
C
三、元素周期表和元素周期律的应用
1、元素的位、构、性三者之间的关系及其应用
结构
位置
性质
推测
推测
决定
推测
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
F
Cs
稀有气体元素
金属
非金属
金属元素和非金属元素分区:
2.元素周期表和元素周期律的应用
(1)在自然科学方面:
预测新元素的结构和性质都提供了线索
(2)在生产上的某些应用:
①农药中常用元素在周期表右上方,如Cl、P、S、N、As等。
②半导体元素在金属与非金属分界线附近,如Ge、Si、Ga、Se等。
③催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如:Fe、Ni、Rh、Pt、Pd等。
练习:
1、下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单
质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化
物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强
不正确
C
2、同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z
错误
A
3、原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________;
(2)与水反应最剧烈的非金属单质是___________;
(3)在室温下有颜色的气体单质是_____________;
(4)在空气中容易自燃的单质名称是________;
(5)除稀有气体外,原子半径最大的元素是______;
(6)原子半径最小的元素是_____________;
(7)气态氢化物水溶液呈碱性的元素是_________;
(8)气态氢化物最稳定的化学式是_____________;
(9)最高价氧化物对应水化物的酸性最强的元素是_____________。
4、在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为_________________________________。
Na
F2
F2 Cl2
白磷
Na
H
N
HF
Cl
H4、X、Y都是短周期元素,原子半径Y> X,它们能形成XY2型的化合物。由此可以得到的结论判断是( )
A、X、Y可能在同一周期
B、X 在Y的前一周期
C、X一定是金属元素
D、X只有在第二周期
5、某元素的最高正价与负价的代数和为4,则该元素的最外层电子数为:
A、4 B、5 C、6 D、7
6、某元素最高价氧化物对应水化物的化学式为HXO4,这种元素的气态氢化物的化学式是
A、HX B、H2X
C、XH3 D、XH4
C
A
3.下列各组元素中,按最高正价递增顺序排列的是 ( )
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na.K、Rb
4. A.B均为原子序数1—20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是 ( )
A.n+4 B.n+6 C.n+8 D.n+10
5.下列叙述中,肯定a金属比b金属活泼性强的是( )
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
B
A
D
13、根据硼在周期表中的位置,推测硼的最高价含氧酸化学式不可能是( )
A.H2BO4 B.H3BO3
C.HBO2 D.H2B4O7
14、已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应的水化物酸性依次增强,则下列判断正确的是( )
原子半径按X、Y、Z依次增大
阴离子的还原性按X、Y、Z顺序增强
单质的氧化性按X、Y、Z顺序增强
氢化物的稳定性按X、Y、Z顺序增强
A
B的化合价是+3
C D
15、下列半径最大的微粒是 ( )
A. F B. Mg2+ C. Cl- D. Ca2+
16、A和B是前三周期的元素,它们的离子A2+和B3+具有相同的核外电子层结构,下列说法正确的是 ( )
A. 原子半径:A>B
B. 原子序数:A>B
C. 离子半径:A2+>B3+
D. 质量数:A>B
C
A C
第四章 物质结构 元素周期律
第二节 元素周期律
1、原子核外电子层排布的周期性变化
原子序数 电子层数 最外层电子数 周期性变化
1~2
3~10
11~18
1
2
3
1
2
1
8
1
8
一、元素性质的周期性变化规律
同周期从左到右,电子层数相同,最外层电子数递增;
元素 H He
原子半径 0.037 nm --
元素 Li Be B C N O F Ne
原子半径 0.152 nm 0.089 nm 0.082nm 0.077 nm 0.075 nm 0.074 nm 0.071 nm --
元素 Na Mg Al Si P S Cl Ar
原子半径 0.186 nm 0.160 nm 0.143 nm 0.117 nm 0.110 nm 0.102 nm 0.099 nm --
同周期从左到右,原子半径逐渐减小;
【结论】:
2、原子半径的周期性变化
越大
越小
越大
⑵电子层数相同时,再看核电荷数,
核电荷数越多,则半径
⑶电子层数和核电荷数都相同(同种元素)时,再看最外层电子数, 最外层电子数越多,则半径
微粒半径大小比较规律
⑴先看电子层数,电子层数越多,
则半径
一般情况下(稀有气体除外):
如 Li Na K Rb Cs
I Br Cl F
<
<
<
<
>
>
>
>
如 Na Mg Al
>
F O N C
<
<
<
如 Cl Cl-
<
+3
Li
+11
Na
+11
Na
+12
Mg
+17
Cl
Cl-
+17
电子层数—核电荷数—最外层电子数
下列各组微粒半径大小比较中,不正确的是( )
r(K+) > r(K) B. r(Mg2+) > r(Na+) > r(F-)
C.r(Na+) > r(Mg2+) > r(Al3+) D.r(Cl -) > r(F-) > r(F)
AB
原子序数 最高或最低化合价的变化
1~2
3~10
11~18
+1
0
+1
+5
-4
-1
0
+1
+7
-4
-1
0
主族元素最高正价=主族序数=最外层电子数
最低负价 + 最高正价 = 8
3、化合价的周期性变化
常见元素化合价的一般规律:
② 最高正价=最外层电子数=(主)族序数(除O、F)
最高正价+︱最低负价︱= 8
③金属元素无负价;
既有正价又有负价的元素一定是非金属元素;
①氟元素无正价,氧元素通常不显正价 。
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1~2 ———
3~10
11~18
结论
1
2
3
1
2
1
8
1
8
大→小
+1 →0
+1→ +5
- 4→ - 1→ 0
随着原子序数的递增,元素原子的最外层电子数、原子半径、化合价呈现周期性变化。
核外电子排布、原子半径和元素化合价的变化
大→小
+1→ +7
- 4→ - 1→ 0
根据原子结构的周期性变化,预测一下元素金属性和非金属性的周期性变化!
放少许镁带
于试管中,加
2mL水,滴入
2滴酚酞试液,
观察现象;
过一会加热
至沸腾,再观
察现象。
实 验
现象:
镁与冷水反应缓慢,滴入酚酞试液后不变色。加热后镁与沸水反应较剧烈,产生较多气泡,溶液变为红色。
反应式:
结论:
镁元素的金属性比钠弱
4、元素金属性和非金属性的周期性变化
Mg + 2H2O = Mg(OH)2+H2
△
第三周期元素金属性的周期性变化
向AlCl3溶液,
然后滴加氨水,
直到不再产生
白色絮状Al(OH)3
沉淀。将沉淀分装
在两支试管中,
一支加盐酸,
另一支滴加氢氧
化钠。观察现象。
实 验
现象:
Al(OH)3沉淀在酸或强碱溶液中都能溶解。
反应:
结论:
Al(OH)3是两性氢氧化物
Al(OH)3+3H+ = Al3++3H2O
Al(OH)3+ OH-=AlO2-+2H2O
向MgCl2溶液,
然后滴加氨水,
产生白色Mg(OH)2
沉淀。将沉淀分装
在两支试管中,
一支加盐酸,
另一支滴加氢氧
化钠。观察现象。
实 验
现象:
Mg(OH)2沉淀在酸中溶解,在碱中不溶解。
反应:
结论:
Mg(OH)2是弱碱(中强碱)
Mg(OH)2+2H+ = Mg2++2H2O
金属性:钠>镁>铝
综上:
14Si 15P 16S 17Cl
最高价氧化物的水化物及其酸性强弱
结论
H2SiO3 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸
酸性逐渐增强
非金属性逐渐增强
第三周期元素非金属性的周期性变化
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
电子层数相同核电荷数增多
原子半径减小
原子失电子能力逐渐减弱,得电子能力逐渐增强
同周期元素 从左到右
原子核对最外层电子的吸引力增强
金属性逐渐减弱,非金属性逐渐增强
1、随着原子序数的递增,元素原子的最外层电子呈现周期性变化。
2、随着原子序数的递增,元素原子半径呈现周期性变化。
3、随着原子序数的递增,元素的化合价呈现周期性变化。
4、随着原子序数的递增,元素的金属性和非金属性呈现周期性变化。
元素的性质随着原子序数的递增而呈现周期性变化。
元素周期律
BC
1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na能从MgCl2的溶液中把Mg置换出来;
练习
2.下列事实能说明非金属性Cl >S的是:
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,
S的最高正价为+6
AB
3.下列有关元素周期律的叙述正确的( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化
C
4.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
5.下列递变规律不正确的是 ( )
A.Na、Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高
AB
C
三、元素周期表和元素周期律的应用
1、元素的位、构、性三者之间的关系及其应用
结构
位置
性质
推测
推测
决定
推测
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
F
Cs
稀有气体元素
金属
非金属
金属元素和非金属元素分区:
2.元素周期表和元素周期律的应用
(1)在自然科学方面:
预测新元素的结构和性质都提供了线索
(2)在生产上的某些应用:
①农药中常用元素在周期表右上方,如Cl、P、S、N、As等。
②半导体元素在金属与非金属分界线附近,如Ge、Si、Ga、Se等。
③催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如:Fe、Ni、Rh、Pt、Pd等。
练习:
1、下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单
质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化
物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强
不正确
C
2、同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z
错误
A
3、原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________;
(2)与水反应最剧烈的非金属单质是___________;
(3)在室温下有颜色的气体单质是_____________;
(4)在空气中容易自燃的单质名称是________;
(5)除稀有气体外,原子半径最大的元素是______;
(6)原子半径最小的元素是_____________;
(7)气态氢化物水溶液呈碱性的元素是_________;
(8)气态氢化物最稳定的化学式是_____________;
(9)最高价氧化物对应水化物的酸性最强的元素是_____________。
4、在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为_________________________________。
Na
F2
F2 Cl2
白磷
Na
H
N
HF
Cl
H
A、X、Y可能在同一周期
B、X 在Y的前一周期
C、X一定是金属元素
D、X只有在第二周期
5、某元素的最高正价与负价的代数和为4,则该元素的最外层电子数为:
A、4 B、5 C、6 D、7
6、某元素最高价氧化物对应水化物的化学式为HXO4,这种元素的气态氢化物的化学式是
A、HX B、H2X
C、XH3 D、XH4
C
A
3.下列各组元素中,按最高正价递增顺序排列的是 ( )
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na.K、Rb
4. A.B均为原子序数1—20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是 ( )
A.n+4 B.n+6 C.n+8 D.n+10
5.下列叙述中,肯定a金属比b金属活泼性强的是( )
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
B
A
D
13、根据硼在周期表中的位置,推测硼的最高价含氧酸化学式不可能是( )
A.H2BO4 B.H3BO3
C.HBO2 D.H2B4O7
14、已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应的水化物酸性依次增强,则下列判断正确的是( )
原子半径按X、Y、Z依次增大
阴离子的还原性按X、Y、Z顺序增强
单质的氧化性按X、Y、Z顺序增强
氢化物的稳定性按X、Y、Z顺序增强
A
B的化合价是+3
C D
15、下列半径最大的微粒是 ( )
A. F B. Mg2+ C. Cl- D. Ca2+
16、A和B是前三周期的元素,它们的离子A2+和B3+具有相同的核外电子层结构,下列说法正确的是 ( )
A. 原子半径:A>B
B. 原子序数:A>B
C. 离子半径:A2+>B3+
D. 质量数:A>B
C
A C
