化学人教版(2019)必修第一册3.1 铁及其化合物(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1 铁及其化合物(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 07:10:51 | ||
图片预览




文档简介
(共22张PPT)
第三章 金属及其化合物
第一节 铁及其化合物
1. Fe在自然界中的分布
一. 铁的单质
2. 工业炼铁
3. 铁的物理性质
4. 铁的化学性质(与非金属单质、酸、盐溶液等反应)
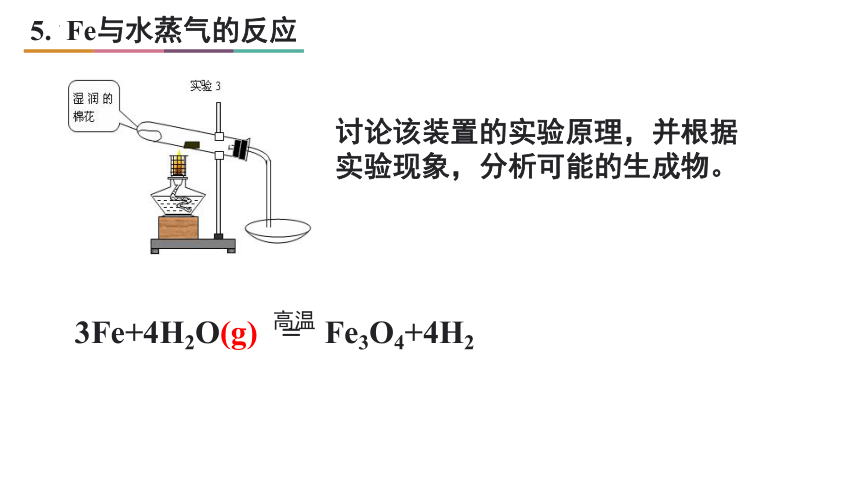
5. Fe与水蒸气的反应
高温
3Fe+4H2O(g) = Fe3O4+4H2
讨论该装置的实验原理,并根据实验现象,分析可能的生成物。
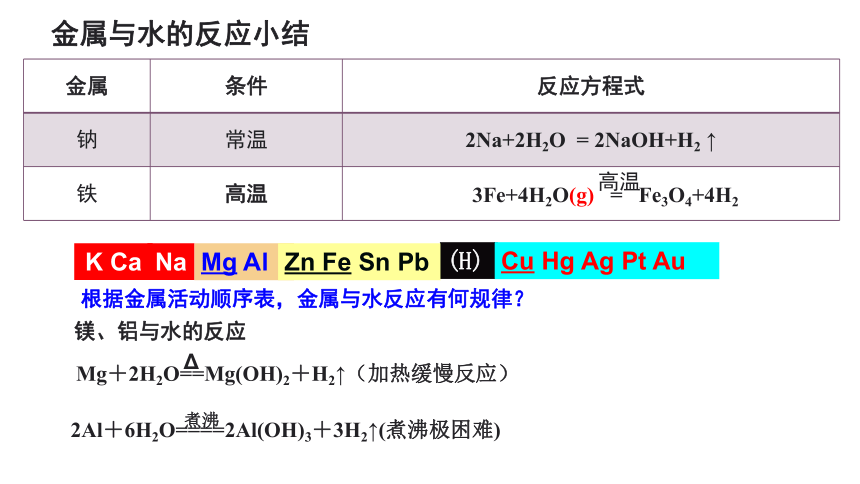
金属与水的反应小结
金属 条件 反应方程式
钠 常温 2Na+2H2O = 2NaOH+H2 ↑
铁 高温
高温
3Fe+4H2O(g) = Fe3O4+4H2
Na
Mg Al
(H)
Cu Hg Ag Pt Au
K Ca
Zn Fe Sn Pb
Mg+2H2O==Mg(OH)2+H2↑(加热缓慢反应)
Δ
2Al+6H2O====2Al(OH)3+3H2↑(煮沸极困难)
煮沸
镁、铝与水的反应
根据金属活动顺序表,金属与水反应有何规律?
二、铁的重要化合物
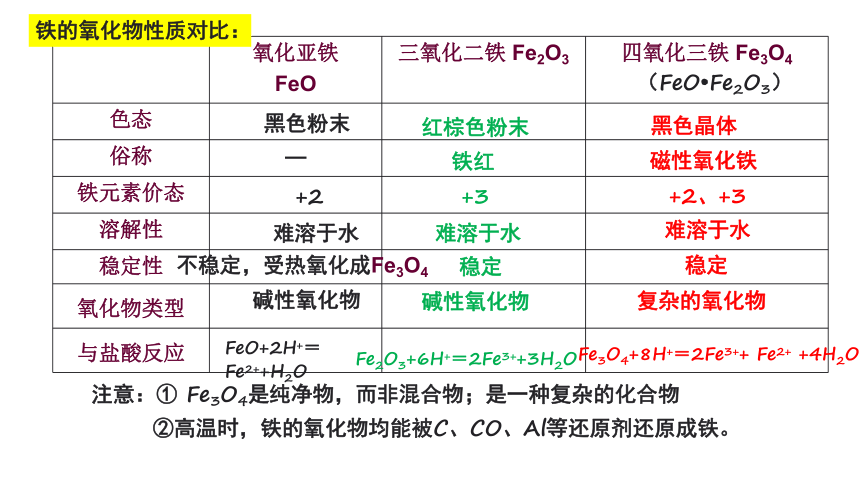
1.铁的氧化物
四氧化三铁
(黑色晶体)
氧化亚铁
(黑色粉末)
氧化铁
(红棕色粉末)
氧化亚铁 FeO 三氧化二铁 Fe2O3 四氧化三铁 Fe3O4
色态
俗称 —
铁元素价态
溶解性
稳定性
氧化物类型
与盐酸反应
黑色粉末
+2
难溶于水
FeO+2H+=Fe2++H2O
红棕色粉末
铁红
+3
难溶于水
不稳定,受热氧化成Fe3O4
稳定
Fe2O3+6H+=2Fe3++3H2O
黑色晶体
磁性氧化铁
+2、+3
难溶于水
稳定
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
注意:① Fe3O4是纯净物,而非混合物;是一种复杂的化合物
②高温时,铁的氧化物均能被C、CO、Al等还原剂还原成铁。
(FeO Fe2O3)
铁的氧化物性质对比:
碱性氧化物
碱性氧化物
复杂的氧化物
氧化铁的用途
高温
氧化铁常用于制造
红色油漆和涂料
作为冶炼金属的原料
氧化铁作外墙涂料
FeCl3 FeSO4
加入NaOH溶液产生的现象
离子方程式
产生红褐色的沉淀
先产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
Fe3++3OH-=Fe(OH)3 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3
Fe(OH)2
【实验3-1】在FeCl3、FeSO4分别加入NaOH溶液
Fe2++2OH-=Fe(OH)2 ↓
可溶性铁盐+可溶性碱
可溶性亚铁盐+可溶性碱
2.铁的氢氧化物
(1)铁的氢氧化物的制备
科学探究
如何制备Fe(OH)2
1、配制NaOH和FeSO4,应用煮沸后的蒸馏水
2、加入FeSO4溶液后,可加少量煤油或苯等
3、胶头滴管插入液面以下
隔绝空气(氧气)
(2)铁的氢氧化物的性质
②与酸反应
①受热分解
(1)Fe3+离子的检验
【实验3-2】向FeCl3和FeCl2溶液中分别加入KSCN溶液
交流和讨论: 有哪些方法可以鉴别Fe3+溶液和Fe2+溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
3.铁盐和亚铁盐
如何鉴别Fe2+与Fe3+
鉴别方法 Fe2+ Fe3+
直接观色
加KSCN溶液
加NaOH溶液
浅绿色
黄色
白色絮状沉淀迅速变灰绿色,最后呈红褐色
立即产生红褐色沉淀
无明显现象
溶液变成血红色
(2)Fe2+与Fe3+的相互转化
在FeCl3溶液中加入足量Fe粉,振荡。
再滴入几滴KSCN溶液,观察现象;
在上层清液中,滴加氯水(Cl2),再观察现象。
2Fe3+ + Fe = 3Fe2+
无明显现象
溶液变成红色
2Fe2+ + Cl2 = 2Fe3+ +2Cl
实验3-3
溶液从黄色变成浅绿色
Fe3+ +3SCN =Fe(SCN)3
Fe
Fe2+
(Ⅱ)
Fe3+
(Ⅲ)
+弱氧化剂S、H+、Cu2+、Fe3+等
+强氧化剂Cl2、HNO3等
+强氧化剂Cl2、HNO3、KMnO4等
+还原剂Al、CO、H2、C等
+还原剂Al、CO、H2、C等
+弱还原剂 Cu等
(3)除杂质
① Fe2+(Fe3+)
② Fe3+(Fe2+)
③ Fe2+(Cu2+)
1、氢氧化铁:红褐色沉淀,与酸反应,受热分解
小结:
2、氢氧化亚铁:白色沉淀,易被氧化,迅速变为灰绿色,最终为红褐色
3、Fe3+:黄色,可以被还原为Fe2+
2Fe(OH)3 Fe2O3 + 3H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe + 2Fe3+ = 3Fe2+
检验:滴加KSCN溶液,显红色
Fe3+ + 3SCN- = Fe(SCN)3
4、Fe2+:浅绿色,可以被氧化为Fe3+
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
学以致用
从生活走进化学
密封包装
薄膜防止Fe2+被氧化
?
Vc会有什么作用?
实验:在氯化铁滴加硫氰化钾溶液,再加入维生素C
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+,还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
从化学走向社会
Cu + 2Fe3+ = 2Fe2+ + Cu2+
第三章 金属及其化合物
第一节 铁及其化合物
1. Fe在自然界中的分布
一. 铁的单质
2. 工业炼铁
3. 铁的物理性质
4. 铁的化学性质(与非金属单质、酸、盐溶液等反应)
5. Fe与水蒸气的反应
高温
3Fe+4H2O(g) = Fe3O4+4H2
讨论该装置的实验原理,并根据实验现象,分析可能的生成物。
金属与水的反应小结
金属 条件 反应方程式
钠 常温 2Na+2H2O = 2NaOH+H2 ↑
铁 高温
高温
3Fe+4H2O(g) = Fe3O4+4H2
Na
Mg Al
(H)
Cu Hg Ag Pt Au
K Ca
Zn Fe Sn Pb
Mg+2H2O==Mg(OH)2+H2↑(加热缓慢反应)
Δ
2Al+6H2O====2Al(OH)3+3H2↑(煮沸极困难)
煮沸
镁、铝与水的反应
根据金属活动顺序表,金属与水反应有何规律?
二、铁的重要化合物
1.铁的氧化物
四氧化三铁
(黑色晶体)
氧化亚铁
(黑色粉末)
氧化铁
(红棕色粉末)
氧化亚铁 FeO 三氧化二铁 Fe2O3 四氧化三铁 Fe3O4
色态
俗称 —
铁元素价态
溶解性
稳定性
氧化物类型
与盐酸反应
黑色粉末
+2
难溶于水
FeO+2H+=Fe2++H2O
红棕色粉末
铁红
+3
难溶于水
不稳定,受热氧化成Fe3O4
稳定
Fe2O3+6H+=2Fe3++3H2O
黑色晶体
磁性氧化铁
+2、+3
难溶于水
稳定
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
注意:① Fe3O4是纯净物,而非混合物;是一种复杂的化合物
②高温时,铁的氧化物均能被C、CO、Al等还原剂还原成铁。
(FeO Fe2O3)
铁的氧化物性质对比:
碱性氧化物
碱性氧化物
复杂的氧化物
氧化铁的用途
高温
氧化铁常用于制造
红色油漆和涂料
作为冶炼金属的原料
氧化铁作外墙涂料
FeCl3 FeSO4
加入NaOH溶液产生的现象
离子方程式
产生红褐色的沉淀
先产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
Fe3++3OH-=Fe(OH)3 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3
Fe(OH)2
【实验3-1】在FeCl3、FeSO4分别加入NaOH溶液
Fe2++2OH-=Fe(OH)2 ↓
可溶性铁盐+可溶性碱
可溶性亚铁盐+可溶性碱
2.铁的氢氧化物
(1)铁的氢氧化物的制备
科学探究
如何制备Fe(OH)2
1、配制NaOH和FeSO4,应用煮沸后的蒸馏水
2、加入FeSO4溶液后,可加少量煤油或苯等
3、胶头滴管插入液面以下
隔绝空气(氧气)
(2)铁的氢氧化物的性质
②与酸反应
①受热分解
(1)Fe3+离子的检验
【实验3-2】向FeCl3和FeCl2溶液中分别加入KSCN溶液
交流和讨论: 有哪些方法可以鉴别Fe3+溶液和Fe2+溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
3.铁盐和亚铁盐
如何鉴别Fe2+与Fe3+
鉴别方法 Fe2+ Fe3+
直接观色
加KSCN溶液
加NaOH溶液
浅绿色
黄色
白色絮状沉淀迅速变灰绿色,最后呈红褐色
立即产生红褐色沉淀
无明显现象
溶液变成血红色
(2)Fe2+与Fe3+的相互转化
在FeCl3溶液中加入足量Fe粉,振荡。
再滴入几滴KSCN溶液,观察现象;
在上层清液中,滴加氯水(Cl2),再观察现象。
2Fe3+ + Fe = 3Fe2+
无明显现象
溶液变成红色
2Fe2+ + Cl2 = 2Fe3+ +2Cl
实验3-3
溶液从黄色变成浅绿色
Fe3+ +3SCN =Fe(SCN)3
Fe
Fe2+
(Ⅱ)
Fe3+
(Ⅲ)
+弱氧化剂S、H+、Cu2+、Fe3+等
+强氧化剂Cl2、HNO3等
+强氧化剂Cl2、HNO3、KMnO4等
+还原剂Al、CO、H2、C等
+还原剂Al、CO、H2、C等
+弱还原剂 Cu等
(3)除杂质
① Fe2+(Fe3+)
② Fe3+(Fe2+)
③ Fe2+(Cu2+)
1、氢氧化铁:红褐色沉淀,与酸反应,受热分解
小结:
2、氢氧化亚铁:白色沉淀,易被氧化,迅速变为灰绿色,最终为红褐色
3、Fe3+:黄色,可以被还原为Fe2+
2Fe(OH)3 Fe2O3 + 3H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe + 2Fe3+ = 3Fe2+
检验:滴加KSCN溶液,显红色
Fe3+ + 3SCN- = Fe(SCN)3
4、Fe2+:浅绿色,可以被氧化为Fe3+
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
学以致用
从生活走进化学
密封包装
薄膜防止Fe2+被氧化
?
Vc会有什么作用?
实验:在氯化铁滴加硫氰化钾溶液,再加入维生素C
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+,还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
从化学走向社会
Cu + 2Fe3+ = 2Fe2+ + Cu2+
