高中化学人教版(2019)必修第一册1.3氧化还原反应(共34张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.3氧化还原反应(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 11:41:50 | ||
图片预览










文档简介
(共34张PPT)
第三节 氧化还原反应
第一章 物质及其变化
钾钠银氢+1价、氟氯溴碘-1价,钙镁钡锌+2价、通常氧是-2价;
一二铜汞、二三铁、二四碳,三铝四硅、正负三正五磷;
氮正负三正二四五,硫有负二正四六;一五七价元素氯,
二四六七锰,单质化合价为0。
+1铵根,-1氢氧、硝酸根,-2碳酸、硫酸根。
CuO + H2 = Cu + H2O
得氧、被氧化、发生氧化反应
失氧、被还原、发生还原反应
一、认识氧化还原反应
氧化反应:物质得到氧原子的反应
还原反应:物质失去氧原子的反应
1、从得失氧的角度
氧化还原反应:一种物质失去氧,同时另一种物质得到氧的反应,叫做氧化还原反应。
2、从化合价升降的角度
氧化反应:化合价升高的反应;
还原反应:化合价降低的反应。
氧化还原反应:有元素化合价升降的化学反应,叫做氧化还原反应。
氧化还原反应特征:反应前后元素的化合价改变。
化合价升高,
被还原,还原反应
被氧化,氧化反应
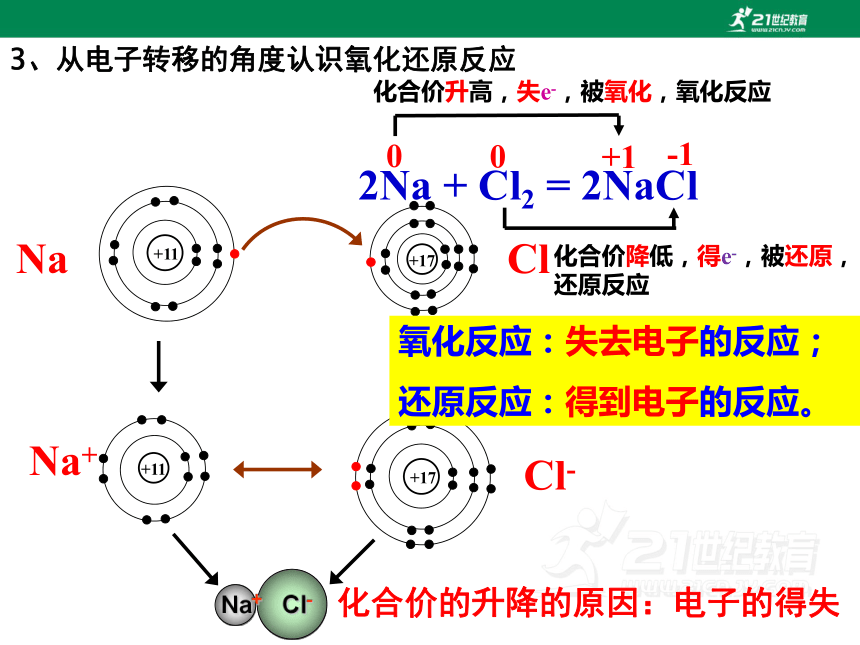
2Na+Cl2====2NaCl
化合价降低,
点燃
那是什么原因导致了反应过程中化合价的改变?
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降的原因:电子的得失
化合价升高,失e-,被氧化,氧化反应
化合价降低,得e-,被还原,
还原反应
0
0
+1
-1
3、从电子转移的角度认识氧化还原反应
氧化反应:失去电子的反应;
还原反应:得到电子的反应。
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
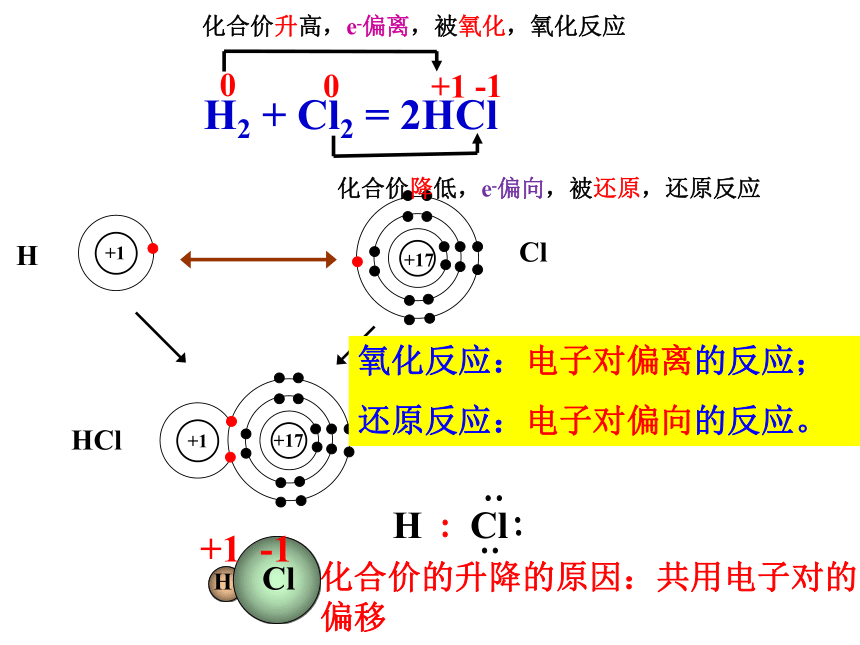
化合价的升降的原因:共用电子对的偏移
H2 + Cl2 = 2HCl
化合价升高,e-偏离,被氧化,氧化反应
化合价降低,e-偏向,被还原,还原反应
0
0
+1
-1
氧化反应:电子对偏离的反应;
还原反应:电子对偏向的反应。
氧化反应:失去电子或电子对偏离的反应;
还原反应:得到电子或电子对偏向的反应。
氧化还原反应实质:有电子转移(得失或偏移)化学反应,叫做氧化还原反应。
Fe + CuSO4 = FeSO4 + Cu
氧化剂:
具有氧化性,反应时被还原生成还原产物
还原剂:
具有还原性,反应时被氧化生成氧化产物
得到电子(或电子对偏向)的物
质,所含元素的化合价降低。
失去电子(或电子对偏离)的物质,所含元素
的化合价升高。
化合价降低,得e-,还原(被还原、还原反应、还原产物),氧化剂(氧化性)
化合价升高,失e-,氧化(被氧化、氧化反应、氧化产物),还原剂(还原性)
练习:指出氧化还原反应的,氧化剂、还原剂、被氧化、
被还原、还原反应、氧化反应、氧化产物、还原产物
Al+ 6HCl = 2AlCl3 + 3H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
2Mg + O2 ===2MgO
点燃
化合价降低,得e-,还原(被还原,还原反应,还原产物),氧化剂
化合价升高,失e-,氧化(被氧化,氧化反应,氧化产物),还原剂
H2O+C = H2+CO
高温
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Na + 2H2O = H2↑ + 2NaOH
C+ 2H2SO4(浓)= CO2↑+ 2SO2↑+ 2H2O
C+ 4HNO3(浓)= CO2↑+ 4NO2↑+ 2H2O
H2S + H2SO4(浓) = S↓ + SO2↑ + 2H2O
SO2 + 2H2S = 3S + 2H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
Cu + 4HNO3(浓)= Cu (NO3)2 + 2NO2 ↑+ 2H2O
NH4NO3 === N2O ↑+ 2H2O
△
3Fe + 4H2O =Fe3O4 + 4H2
高温
Cl2+H2O = HCl + HClO
2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O
练习:下列反应是否属于氧化还原反应
A、 2Mg + O2 ===2MgO
B、NH4NO3 === N2O ↑+ 2H2O
C、2NaHCO3 === Na2CO3 + CO2↑+ H2O
D、 CO2 + Na2O == Na2CO3
E、 Fe + CuSO4 == FeSO4 + Cu
F、 H2SO4 + Ba(OH)2== BaSO4 + 2H2O
H、Zn + 2HCl = ZnCl2 + H2 ↑
△
△
点燃
是
是
是
是
化合
化合
分解
分解
置换
置换
复分解
不是
不是
不是
二、氧化还原反应与四大基本反应的关系
氧化还原反应
分解反应
复分解反应
置换反应
化合反应
[结论] : 置换反应全部是氧化还原反应;
复分解反应全部不是氧化还原反应;
有单质参加的化合反应是氧化还原反应;
有单质生成的分解反应是氧化还原反应。
1. 在下列反应中,属于氧化还原反应的是( )
A、Na2CO3+CaCl2 = CaCO3↓+2NaCl
B、CuSO 4 + Fe = Cu+FeSO4
C、CaO+H2O = Ca(OH)2
D、2NaHCO3 = Na2CO3 + CO2↑+H2O
B
课堂练习
2. 下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( ),属于氧化还原反应的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn + 2HCl = ZnCl2 + H2↑
C、MnO2 +4HCl(浓) 加热 MnCl2 + 2H2O +Cl2
D、CuO + 2HCl = CuCl2 + H2O
B
C
B C
课堂练习
1、“双线桥”法
CuO + H2 === Cu + H2O
△
+2
0
0
+1
得2e-
失2e-
注意:A、箭头连接反应前后同种元素的不同价态,
且从反应物指向生成物。
B、得失电子总数守恒。
三、电子转移的表示方法
步骤:标变价、连双线、注得失数
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Na + 2H2O = H2↑ + 2NaOH
3Fe + 4H2O ==== Fe3O4 + 4H2
高温
2CuO+C = 2Cu+CO2↑
H2O+C = H2+CO
高温
高温
[思考]用 “双线桥”法表示电子转移
(2)“单线桥”法
CuO + H2 === Cu + H2O
△
2e-
2KClO3 === 2KCl + 3O2 ↑
△
12e-
注意:
A、箭头由反应物中失电子/化合价升高的元素指向
反应物中得电子/化合价降低的元素 。
B、只须标明电子转移总数。
步骤:标变价、连单线、注数目
H2S + H2SO4(浓) = S↓ + SO2↑ + 2H2O
SO2 + 2H2S = 3S + 2H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Na + 2H2O = H2↑ + 2NaOH
3Fe + 4H2O ==== Fe3O4 + 4H2
高温
[思考]用 “单线桥”法表示电子转移
1. 常见的氧化剂和还原剂:
③有较高价态元素的化合物:HNO3、H2SO4(浓)。
②含高价金属离子的化合物:FeCl3、CuSO4等。
①活泼的非金属单质:Cl2、O2等。
(1)氧化剂
(2)还原剂:
①金属单质:Na、Mg、Al、Fe、Cu等。
②某些非金属:H2、C等。
③含低价元素的化合物:FeCl2、 CO、SO2等。
三、氧化剂和还原剂
(1)根据金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
从左到右,还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Fe3+ Hg2+ Ag+
从左到右,氧化性逐渐增强
3、氧化性(得电子能力)和还原性(失电子能力)强弱判断
(2)常见物质的氧化性
氧化性:MnO4 -﹥ Cl2 ﹥ Br2 ﹥Fe3+ ﹥ I2 ﹥ S
对应阴离子的还原性:Mn2+< Cl- < Br-< Fe2+< I- < S2-
同一氧化剂遇到不同还原剂时,按照还原性先后顺序参与反应。
同一还原剂遇到不同氧化剂时,按照氧化性先后顺序参与反应。
(3)根据同一氧化还原反应判断
氧化剂 + 还原剂 还原产物 + 氧化产物
例如,2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O
氧化性:KMnO4 > Cl2
还原性:HCl > MnCl2
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
化学反应中,一定是强还原性物质与强氧化性物质反应,生成弱还原性物质与弱氧化性物质。
(4)根据反应条件及反应的剧烈程度判断
(5)根据产物价态高低判断
不同氧化剂与相同还原剂反应,反应条件越苛刻,其氧化剂的氧化性越弱。
不同还原剂与相同氧化剂反应,反应条件越苛刻,其还原剂的还原性越弱。
不同氧化剂与相同还原剂反应,得到的价态越高,其氧化剂的氧化性越强。
①某元素处于最高价态时,只能得到电子,只具有氧化性
②某元素处于最低价态时,只能失去电子,只具有还原性
③某元素处于中间价态时,既能得到电子,又能失去电子,既具有氧化性又具有还原性
(5)据元素价态判断
四、氧化还原反应的计算
1、求氧化剂、还原剂、氧化产物、还原产物的物质的量之比、质量之比。
2、转移电子与气体、氧化剂....比例。
3、确定反应前后某一元素价态的变化。(化合价升降总和相等)
例1:Cu + 4HNO3(浓)= Cu (NO3)2 + 2NO2 ↑+ 2H2O
1、用双线桥和单线桥的形式表示电子转移的方向和数目
2、氧化剂和还原剂的物质的量之比为 .
4、若反应中有2mol电子转移,则标况下有 LNO2生成。
3、64g铜参与反应,有 gHNO3完全反应,
其中被还原的HNO3的物质的量为 .
练习1:把19.2 g 的Cu放入500 mL 2 mol·L-1稀硝酸中,发生如下反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,充分反应,Cu完全溶解。
转移电子数目为____________(用含NA的式子表示)。
反应后溶液中c(H+)为____________。(体积变化忽略不计)
若有5.6L(标况)NO生成,则转移的电子的物质的量是 mol,被还原的硝酸为 mol。
练3、根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题:(1)氧化剂是 ,还原剂 。(2)氧化剂与氧化产物的质量比 。(3)当有68gNH3参加反应时,被氧化的物质是 g。
例2:KMnO4是常用的氧化剂,酸化的KMnO4溶液可将Na2SO3氧化成Na2SO4。该反应中氧化剂和还原剂的个数比为2∶5。则生成物中锰元素的化合价为( )
A.0 B.+2 C.+4 D.+6
练2. 24 mL浓度为0.05 mol·L—1的Na2SO3溶液(已知硫元素最高价为+6价),恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7(铬元素最高价为+6价)溶液完全反应,则元素铬在被还原的产物中的化合价是 A.+6 B.+3 C.+2 D.0
六、氧化还原反应的配平
标变价
列升降
求总数(求最小公倍数使化合价升降总数相等)
配系数(确定氧化剂、还原剂、氧化产物、还原产物系数,再通过电荷守恒、原子守恒确定其他系数)
查守恒(检查得失电子、电荷、原子是否守恒)
Na + H2O = H2↑ + NaOH
NH3+ O2 — NO + H2O
C+ H2SO4—— CO2+ SO2+ H2O
H2S + H2SO4 — S + SO2 + H2O
Cu + HNO3(浓)— Cu (NO3)2 + NO2 ↑+ H2O
KMnO4 + HCl — KCl+ MnCl2+ Cl2 + H2O
C + HNO3(浓) ==== CO2 + NO2 + H2O
H2S+ KMnO4+ ==== S+ K2SO4+ MnSO4+ H2O
Mn2++ S2O82—+ H2O==== SO42—+ MnO4—+ ____
第三节 氧化还原反应
第一章 物质及其变化
钾钠银氢+1价、氟氯溴碘-1价,钙镁钡锌+2价、通常氧是-2价;
一二铜汞、二三铁、二四碳,三铝四硅、正负三正五磷;
氮正负三正二四五,硫有负二正四六;一五七价元素氯,
二四六七锰,单质化合价为0。
+1铵根,-1氢氧、硝酸根,-2碳酸、硫酸根。
CuO + H2 = Cu + H2O
得氧、被氧化、发生氧化反应
失氧、被还原、发生还原反应
一、认识氧化还原反应
氧化反应:物质得到氧原子的反应
还原反应:物质失去氧原子的反应
1、从得失氧的角度
氧化还原反应:一种物质失去氧,同时另一种物质得到氧的反应,叫做氧化还原反应。
2、从化合价升降的角度
氧化反应:化合价升高的反应;
还原反应:化合价降低的反应。
氧化还原反应:有元素化合价升降的化学反应,叫做氧化还原反应。
氧化还原反应特征:反应前后元素的化合价改变。
化合价升高,
被还原,还原反应
被氧化,氧化反应
2Na+Cl2====2NaCl
化合价降低,
点燃
那是什么原因导致了反应过程中化合价的改变?
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降的原因:电子的得失
化合价升高,失e-,被氧化,氧化反应
化合价降低,得e-,被还原,
还原反应
0
0
+1
-1
3、从电子转移的角度认识氧化还原反应
氧化反应:失去电子的反应;
还原反应:得到电子的反应。
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价的升降的原因:共用电子对的偏移
H2 + Cl2 = 2HCl
化合价升高,e-偏离,被氧化,氧化反应
化合价降低,e-偏向,被还原,还原反应
0
0
+1
-1
氧化反应:电子对偏离的反应;
还原反应:电子对偏向的反应。
氧化反应:失去电子或电子对偏离的反应;
还原反应:得到电子或电子对偏向的反应。
氧化还原反应实质:有电子转移(得失或偏移)化学反应,叫做氧化还原反应。
Fe + CuSO4 = FeSO4 + Cu
氧化剂:
具有氧化性,反应时被还原生成还原产物
还原剂:
具有还原性,反应时被氧化生成氧化产物
得到电子(或电子对偏向)的物
质,所含元素的化合价降低。
失去电子(或电子对偏离)的物质,所含元素
的化合价升高。
化合价降低,得e-,还原(被还原、还原反应、还原产物),氧化剂(氧化性)
化合价升高,失e-,氧化(被氧化、氧化反应、氧化产物),还原剂(还原性)
练习:指出氧化还原反应的,氧化剂、还原剂、被氧化、
被还原、还原反应、氧化反应、氧化产物、还原产物
Al+ 6HCl = 2AlCl3 + 3H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
2Mg + O2 ===2MgO
点燃
化合价降低,得e-,还原(被还原,还原反应,还原产物),氧化剂
化合价升高,失e-,氧化(被氧化,氧化反应,氧化产物),还原剂
H2O+C = H2+CO
高温
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Na + 2H2O = H2↑ + 2NaOH
C+ 2H2SO4(浓)= CO2↑+ 2SO2↑+ 2H2O
C+ 4HNO3(浓)= CO2↑+ 4NO2↑+ 2H2O
H2S + H2SO4(浓) = S↓ + SO2↑ + 2H2O
SO2 + 2H2S = 3S + 2H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
Cu + 4HNO3(浓)= Cu (NO3)2 + 2NO2 ↑+ 2H2O
NH4NO3 === N2O ↑+ 2H2O
△
3Fe + 4H2O =Fe3O4 + 4H2
高温
Cl2+H2O = HCl + HClO
2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O
练习:下列反应是否属于氧化还原反应
A、 2Mg + O2 ===2MgO
B、NH4NO3 === N2O ↑+ 2H2O
C、2NaHCO3 === Na2CO3 + CO2↑+ H2O
D、 CO2 + Na2O == Na2CO3
E、 Fe + CuSO4 == FeSO4 + Cu
F、 H2SO4 + Ba(OH)2== BaSO4 + 2H2O
H、Zn + 2HCl = ZnCl2 + H2 ↑
△
△
点燃
是
是
是
是
化合
化合
分解
分解
置换
置换
复分解
不是
不是
不是
二、氧化还原反应与四大基本反应的关系
氧化还原反应
分解反应
复分解反应
置换反应
化合反应
[结论] : 置换反应全部是氧化还原反应;
复分解反应全部不是氧化还原反应;
有单质参加的化合反应是氧化还原反应;
有单质生成的分解反应是氧化还原反应。
1. 在下列反应中,属于氧化还原反应的是( )
A、Na2CO3+CaCl2 = CaCO3↓+2NaCl
B、CuSO 4 + Fe = Cu+FeSO4
C、CaO+H2O = Ca(OH)2
D、2NaHCO3 = Na2CO3 + CO2↑+H2O
B
课堂练习
2. 下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( ),属于氧化还原反应的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn + 2HCl = ZnCl2 + H2↑
C、MnO2 +4HCl(浓) 加热 MnCl2 + 2H2O +Cl2
D、CuO + 2HCl = CuCl2 + H2O
B
C
B C
课堂练习
1、“双线桥”法
CuO + H2 === Cu + H2O
△
+2
0
0
+1
得2e-
失2e-
注意:A、箭头连接反应前后同种元素的不同价态,
且从反应物指向生成物。
B、得失电子总数守恒。
三、电子转移的表示方法
步骤:标变价、连双线、注得失数
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Na + 2H2O = H2↑ + 2NaOH
3Fe + 4H2O ==== Fe3O4 + 4H2
高温
2CuO+C = 2Cu+CO2↑
H2O+C = H2+CO
高温
高温
[思考]用 “双线桥”法表示电子转移
(2)“单线桥”法
CuO + H2 === Cu + H2O
△
2e-
2KClO3 === 2KCl + 3O2 ↑
△
12e-
注意:
A、箭头由反应物中失电子/化合价升高的元素指向
反应物中得电子/化合价降低的元素 。
B、只须标明电子转移总数。
步骤:标变价、连单线、注数目
H2S + H2SO4(浓) = S↓ + SO2↑ + 2H2O
SO2 + 2H2S = 3S + 2H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Na + 2H2O = H2↑ + 2NaOH
3Fe + 4H2O ==== Fe3O4 + 4H2
高温
[思考]用 “单线桥”法表示电子转移
1. 常见的氧化剂和还原剂:
③有较高价态元素的化合物:HNO3、H2SO4(浓)。
②含高价金属离子的化合物:FeCl3、CuSO4等。
①活泼的非金属单质:Cl2、O2等。
(1)氧化剂
(2)还原剂:
①金属单质:Na、Mg、Al、Fe、Cu等。
②某些非金属:H2、C等。
③含低价元素的化合物:FeCl2、 CO、SO2等。
三、氧化剂和还原剂
(1)根据金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
从左到右,还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Fe3+ Hg2+ Ag+
从左到右,氧化性逐渐增强
3、氧化性(得电子能力)和还原性(失电子能力)强弱判断
(2)常见物质的氧化性
氧化性:MnO4 -﹥ Cl2 ﹥ Br2 ﹥Fe3+ ﹥ I2 ﹥ S
对应阴离子的还原性:Mn2+< Cl- < Br-< Fe2+< I- < S2-
同一氧化剂遇到不同还原剂时,按照还原性先后顺序参与反应。
同一还原剂遇到不同氧化剂时,按照氧化性先后顺序参与反应。
(3)根据同一氧化还原反应判断
氧化剂 + 还原剂 还原产物 + 氧化产物
例如,2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O
氧化性:KMnO4 > Cl2
还原性:HCl > MnCl2
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
化学反应中,一定是强还原性物质与强氧化性物质反应,生成弱还原性物质与弱氧化性物质。
(4)根据反应条件及反应的剧烈程度判断
(5)根据产物价态高低判断
不同氧化剂与相同还原剂反应,反应条件越苛刻,其氧化剂的氧化性越弱。
不同还原剂与相同氧化剂反应,反应条件越苛刻,其还原剂的还原性越弱。
不同氧化剂与相同还原剂反应,得到的价态越高,其氧化剂的氧化性越强。
①某元素处于最高价态时,只能得到电子,只具有氧化性
②某元素处于最低价态时,只能失去电子,只具有还原性
③某元素处于中间价态时,既能得到电子,又能失去电子,既具有氧化性又具有还原性
(5)据元素价态判断
四、氧化还原反应的计算
1、求氧化剂、还原剂、氧化产物、还原产物的物质的量之比、质量之比。
2、转移电子与气体、氧化剂....比例。
3、确定反应前后某一元素价态的变化。(化合价升降总和相等)
例1:Cu + 4HNO3(浓)= Cu (NO3)2 + 2NO2 ↑+ 2H2O
1、用双线桥和单线桥的形式表示电子转移的方向和数目
2、氧化剂和还原剂的物质的量之比为 .
4、若反应中有2mol电子转移,则标况下有 LNO2生成。
3、64g铜参与反应,有 gHNO3完全反应,
其中被还原的HNO3的物质的量为 .
练习1:把19.2 g 的Cu放入500 mL 2 mol·L-1稀硝酸中,发生如下反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,充分反应,Cu完全溶解。
转移电子数目为____________(用含NA的式子表示)。
反应后溶液中c(H+)为____________。(体积变化忽略不计)
若有5.6L(标况)NO生成,则转移的电子的物质的量是 mol,被还原的硝酸为 mol。
练3、根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题:(1)氧化剂是 ,还原剂 。(2)氧化剂与氧化产物的质量比 。(3)当有68gNH3参加反应时,被氧化的物质是 g。
例2:KMnO4是常用的氧化剂,酸化的KMnO4溶液可将Na2SO3氧化成Na2SO4。该反应中氧化剂和还原剂的个数比为2∶5。则生成物中锰元素的化合价为( )
A.0 B.+2 C.+4 D.+6
练2. 24 mL浓度为0.05 mol·L—1的Na2SO3溶液(已知硫元素最高价为+6价),恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7(铬元素最高价为+6价)溶液完全反应,则元素铬在被还原的产物中的化合价是 A.+6 B.+3 C.+2 D.0
六、氧化还原反应的配平
标变价
列升降
求总数(求最小公倍数使化合价升降总数相等)
配系数(确定氧化剂、还原剂、氧化产物、还原产物系数,再通过电荷守恒、原子守恒确定其他系数)
查守恒(检查得失电子、电荷、原子是否守恒)
Na + H2O = H2↑ + NaOH
NH3+ O2 — NO + H2O
C+ H2SO4—— CO2+ SO2+ H2O
H2S + H2SO4 — S + SO2 + H2O
Cu + HNO3(浓)— Cu (NO3)2 + NO2 ↑+ H2O
KMnO4 + HCl — KCl+ MnCl2+ Cl2 + H2O
C + HNO3(浓) ==== CO2 + NO2 + H2O
H2S+ KMnO4+ ==== S+ K2SO4+ MnSO4+ H2O
Mn2++ S2O82—+ H2O==== SO42—+ MnO4—+ ____
