3.4.2沉淀溶解平衡的应用课件2022-2023学年高二上学期化学人教版(2019)选择性必修1(19张)
文档属性
| 名称 | 3.4.2沉淀溶解平衡的应用课件2022-2023学年高二上学期化学人教版(2019)选择性必修1(19张) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 08:27:58 | ||
图片预览






文档简介
(共19张PPT)
第四节 沉淀溶解平衡
人教版高中化学选择性必修1
第2课时 溶度积
知识目标
知识溶度积和离子积的含义,掌握溶度积规则,基于溶度积理解沉淀溶解过程
能力目标
会基于溶度积计算沉淀溶解平衡状态下某离子的浓度
会基于计算选择沉淀剂、判断是否生成沉淀、沉淀顺序、何时开始沉淀、何时沉淀完全等
1沉淀溶解平衡的建立
2平衡常数——溶度积
3条件对平衡的影响
4典型题型分析
前进之路
(二)关于电解质的溶解能力及其定量表示——溶度积
1概念 沉淀溶解平衡常数,称为溶度积常数,简称溶度积,
符号为Ksp。
例: AgCl(s) Ag+(aq) + Cl-(aq)
平衡时 c(Ag+)·c(Cl-)=Ksp (溶度积)受温度影响
任意时 c(Ag+)·c(Cl-)=Qc (离子积)受浓度影响
活动1:对比观察课本第122页附录Ⅲ表中具体数据,思考
(1)溶度积Ksp受哪些因素的影响?
答:溶度积Ksp受电解质和温度影响,当电解质确定时,溶度积Ksp只受温度影响,温度不变,溶度积Ksp不变
如:25时, Ksp(AgCl)=
25时, Ksp(HgS)=1
25时, Ksp(Ag2S)=
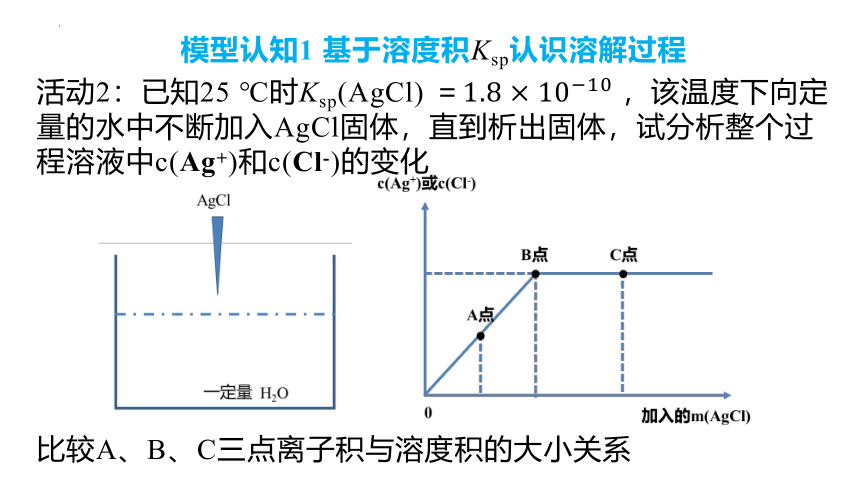
模型认知1 基于溶度积Ksp认识溶解过程
活动2:已知25 ℃时Ksp(AgCl) =,该温度下向定量的水中不断加入AgCl固体,直到析出固体,试分析整个过程溶液中c(Ag+)和c(Cl-)的变化
比较A、B、C三点离子积与溶度积的大小关系
针对训练 根据课本第122页附录Ⅲ表中具体数据,计算
分别将AgCl、AgBr、AgI溶于水形成饱和溶液,分别计算溶液中c(Ag+)
分别将CuS、 Ag2S溶于水形成饱和溶液,分别计算溶液中c(S2-)
(2)温度相同时,溶度积Ksp越大,其溶解度一定越大吗?
答:溶度积Ksp的大小反映了物质在水中的溶解能力,当电解质的类型相同时,溶度积Ksp越大,其溶解度一定越大;当电解质的类型不同时,溶度积Ksp越大,其溶解度不一定越大,需要通过计算进行确定
模型认知2 基于溶度积Ksp认识沉淀过程
活动3:25时,Ksp(AgCl) = ,向0.1mol/L的AgNO3溶液中逐步加入NaCl固体,试分析整个过程中溶液c(Ag+) 的变化图示(沉淀模型)
A点:Qc=Ksp,无沉淀的饱和溶液
B点:Qc=Ksp,有沉淀的饱和溶液
C点:QcD点:Qc>Ksp,析出沉淀趋于平衡
两个关于沉淀的标准
(1)开始沉淀的标准(何时开始沉淀?)
当离子积Qc刚好等于溶度积Ksp时,开始沉淀。
(2)沉淀完全的标准(何时沉淀完全?)
当残留在溶液中的离子浓度mol/L时,认为离子已沉淀完全。
2.溶度积规则 难溶电解质的沉淀溶解模型
Qcv(沉淀),无固体
Qc=Ksp 溶液饱和,v(溶解)=v(沉淀)
Qc>Ksp 溶液过饱和,v(溶解)针对训练 25时,Ksp(AgCl) = c(Ag+)·c(Cl-)=,向0.1mol/L的AgNO3溶液中逐步加入NaCl固体,分析与计算
计算Ag+开始沉淀时溶液中c(Cl-)
计算Ag+沉淀完全时溶液中c(Cl-)
当溶液中c(Ag+)降为 时计算溶液中c(Cl-)
练习:已知25时Ksp(AgCl)= 1.8×10-10,
(1)将AgCl溶于0.001mol·L-1 AgNO3溶液中形成饱和溶液,计算所得饱和溶液中c(Ag+)
(2)将AgCl溶于0.2mol·L-1 NaCl溶液中形成饱和溶液,计算所得饱和溶液中c(Cl-)
学以致用 1.已知25时Ksp(AgCl)= 1.8×10-10,
将1 L 0.002mol·L-1 AgNO3溶液与1 L 0.02mol·L-1 NaCl溶液混合,计算并用数据判断
(1)是否会析出AgCl沉淀?
(2)Ag+是否沉淀完全?
学以致用 2. 已知25时Ksp[Fe(OH)3]= 2.8×10-39,此温度下若在实验室中配制2.8mol·L-1 100mL FeCl3溶液,为使配制过程不出现浑浊现象,则至少需要加入 mL 2 mol·L-1 的盐酸(忽略加入盐酸的体积)
学以致用 3.已知Ksp(AgCl)= 1.8×10-10,Ksp(Ag2CrO4)= 1.1×10-12,向浓度均为0.01mol·L-1 的Cl-和Cr的混合液中滴加AgNO3溶液试计算并判断Cl-和Cr谁优先沉淀?
方法指导 如何判断离子沉淀的先后顺序
开始沉淀所需离子浓度越小,离子越先沉淀
板书 (二)溶度积Ksp
1概念
沉淀溶解平衡常数,称为溶度积常数,简称溶度积,符号为Ksp。
例: AgCl(s) Ag+(aq) + Cl-(aq)
平衡时 c(Ag+)·c(Cl-)=Ksp (溶度积)受温度影响
任意时 c(Ag+)·c(Cl-)=Qc (离子积)受浓度影响
2.溶度积规则 难溶电解质的沉淀溶解模型
Qcv(沉淀),无固体
Qc=Ksp 溶液饱和,v(溶解)=v(沉淀)
Qc>Ksp 溶液过饱和,v(溶解)3沉淀过程经典“五问答”
如何选择沉淀剂?力图使生成的沉淀越难溶越好
如何判断是否有沉淀?离子积Qc大于溶度积Ksp的体系产生沉淀
谁先沉淀?开始沉淀时所需离子浓度越小越先发生沉淀
何时开始沉淀?当离子积Qc刚好等于溶度积Ksp时,开始沉淀。
何时沉淀完全?当残留在溶液中的离子浓度mol/L时,认为离子已沉淀完全。
第四节 沉淀溶解平衡
人教版高中化学选择性必修1
第2课时 溶度积
知识目标
知识溶度积和离子积的含义,掌握溶度积规则,基于溶度积理解沉淀溶解过程
能力目标
会基于溶度积计算沉淀溶解平衡状态下某离子的浓度
会基于计算选择沉淀剂、判断是否生成沉淀、沉淀顺序、何时开始沉淀、何时沉淀完全等
1沉淀溶解平衡的建立
2平衡常数——溶度积
3条件对平衡的影响
4典型题型分析
前进之路
(二)关于电解质的溶解能力及其定量表示——溶度积
1概念 沉淀溶解平衡常数,称为溶度积常数,简称溶度积,
符号为Ksp。
例: AgCl(s) Ag+(aq) + Cl-(aq)
平衡时 c(Ag+)·c(Cl-)=Ksp (溶度积)受温度影响
任意时 c(Ag+)·c(Cl-)=Qc (离子积)受浓度影响
活动1:对比观察课本第122页附录Ⅲ表中具体数据,思考
(1)溶度积Ksp受哪些因素的影响?
答:溶度积Ksp受电解质和温度影响,当电解质确定时,溶度积Ksp只受温度影响,温度不变,溶度积Ksp不变
如:25时, Ksp(AgCl)=
25时, Ksp(HgS)=1
25时, Ksp(Ag2S)=
模型认知1 基于溶度积Ksp认识溶解过程
活动2:已知25 ℃时Ksp(AgCl) =,该温度下向定量的水中不断加入AgCl固体,直到析出固体,试分析整个过程溶液中c(Ag+)和c(Cl-)的变化
比较A、B、C三点离子积与溶度积的大小关系
针对训练 根据课本第122页附录Ⅲ表中具体数据,计算
分别将AgCl、AgBr、AgI溶于水形成饱和溶液,分别计算溶液中c(Ag+)
分别将CuS、 Ag2S溶于水形成饱和溶液,分别计算溶液中c(S2-)
(2)温度相同时,溶度积Ksp越大,其溶解度一定越大吗?
答:溶度积Ksp的大小反映了物质在水中的溶解能力,当电解质的类型相同时,溶度积Ksp越大,其溶解度一定越大;当电解质的类型不同时,溶度积Ksp越大,其溶解度不一定越大,需要通过计算进行确定
模型认知2 基于溶度积Ksp认识沉淀过程
活动3:25时,Ksp(AgCl) = ,向0.1mol/L的AgNO3溶液中逐步加入NaCl固体,试分析整个过程中溶液c(Ag+) 的变化图示(沉淀模型)
A点:Qc=Ksp,无沉淀的饱和溶液
B点:Qc=Ksp,有沉淀的饱和溶液
C点:Qc
两个关于沉淀的标准
(1)开始沉淀的标准(何时开始沉淀?)
当离子积Qc刚好等于溶度积Ksp时,开始沉淀。
(2)沉淀完全的标准(何时沉淀完全?)
当残留在溶液中的离子浓度mol/L时,认为离子已沉淀完全。
2.溶度积规则 难溶电解质的沉淀溶解模型
Qc
Qc=Ksp 溶液饱和,v(溶解)=v(沉淀)
Qc>Ksp 溶液过饱和,v(溶解)
计算Ag+开始沉淀时溶液中c(Cl-)
计算Ag+沉淀完全时溶液中c(Cl-)
当溶液中c(Ag+)降为 时计算溶液中c(Cl-)
练习:已知25时Ksp(AgCl)= 1.8×10-10,
(1)将AgCl溶于0.001mol·L-1 AgNO3溶液中形成饱和溶液,计算所得饱和溶液中c(Ag+)
(2)将AgCl溶于0.2mol·L-1 NaCl溶液中形成饱和溶液,计算所得饱和溶液中c(Cl-)
学以致用 1.已知25时Ksp(AgCl)= 1.8×10-10,
将1 L 0.002mol·L-1 AgNO3溶液与1 L 0.02mol·L-1 NaCl溶液混合,计算并用数据判断
(1)是否会析出AgCl沉淀?
(2)Ag+是否沉淀完全?
学以致用 2. 已知25时Ksp[Fe(OH)3]= 2.8×10-39,此温度下若在实验室中配制2.8mol·L-1 100mL FeCl3溶液,为使配制过程不出现浑浊现象,则至少需要加入 mL 2 mol·L-1 的盐酸(忽略加入盐酸的体积)
学以致用 3.已知Ksp(AgCl)= 1.8×10-10,Ksp(Ag2CrO4)= 1.1×10-12,向浓度均为0.01mol·L-1 的Cl-和Cr的混合液中滴加AgNO3溶液试计算并判断Cl-和Cr谁优先沉淀?
方法指导 如何判断离子沉淀的先后顺序
开始沉淀所需离子浓度越小,离子越先沉淀
板书 (二)溶度积Ksp
1概念
沉淀溶解平衡常数,称为溶度积常数,简称溶度积,符号为Ksp。
例: AgCl(s) Ag+(aq) + Cl-(aq)
平衡时 c(Ag+)·c(Cl-)=Ksp (溶度积)受温度影响
任意时 c(Ag+)·c(Cl-)=Qc (离子积)受浓度影响
2.溶度积规则 难溶电解质的沉淀溶解模型
Qc
Qc=Ksp 溶液饱和,v(溶解)=v(沉淀)
Qc>Ksp 溶液过饱和,v(溶解)
如何选择沉淀剂?力图使生成的沉淀越难溶越好
如何判断是否有沉淀?离子积Qc大于溶度积Ksp的体系产生沉淀
谁先沉淀?开始沉淀时所需离子浓度越小越先发生沉淀
何时开始沉淀?当离子积Qc刚好等于溶度积Ksp时,开始沉淀。
何时沉淀完全?当残留在溶液中的离子浓度mol/L时,认为离子已沉淀完全。
