鲁教版化学九年级下册9_1_2常见的金属材料学案(无答案)
文档属性
| 名称 | 鲁教版化学九年级下册9_1_2常见的金属材料学案(无答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 57.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 00:00:00 | ||
图片预览

文档简介
9.1.2常见的金属材料
【学习目标】:
1、了解常见铁矿石的主要成分。
2、掌握炼铁的原理、装置、现象。
【重点、难点】
重点:炼铁的原理、装置、现象。
难点:炼铁方程式。还原反应。
【基础知识预习】
(一)、认识金属矿物。
1、铁在自然界中大多以 存在。
2、常见的铁矿石主要有哪几种?每种矿石的主要成分分别是什么?
【课堂练习】
现有①磁铁矿(主要成分是Fe3O4)、②黄铁矿(主要成分是FeS2)③赤铁矿(主要成分是Fe2O3),请你从多角度分析三种矿石中不适合用来炼铁的是(填序号) ,原因是 。
(二)、铁的冶炼
根据一氧化碳还原氧化铁实验填写:
(1)试管中澄清石灰水的变化是________, 玻璃管中的红色固体粉末变成了________, 右侧玻璃管处_______________。
(2)实验中,先通入一氧化碳气体然后再加热的目的是__________,实验完毕后继续通入一氧化碳气体的目的是________________。
(3)你认为反应中生成了什么物质?如何判断生成的新物质?
该反应的化学方程式为________________ 。
(4)装置中右边的酒精灯起什么作用?对此你还有没有其他的处理方法?
实验表明,氧化铁和一氧化碳在高温条件下发生反应,生成金属铁和二氧化碳。反应的化学方程式为:_______________________________。
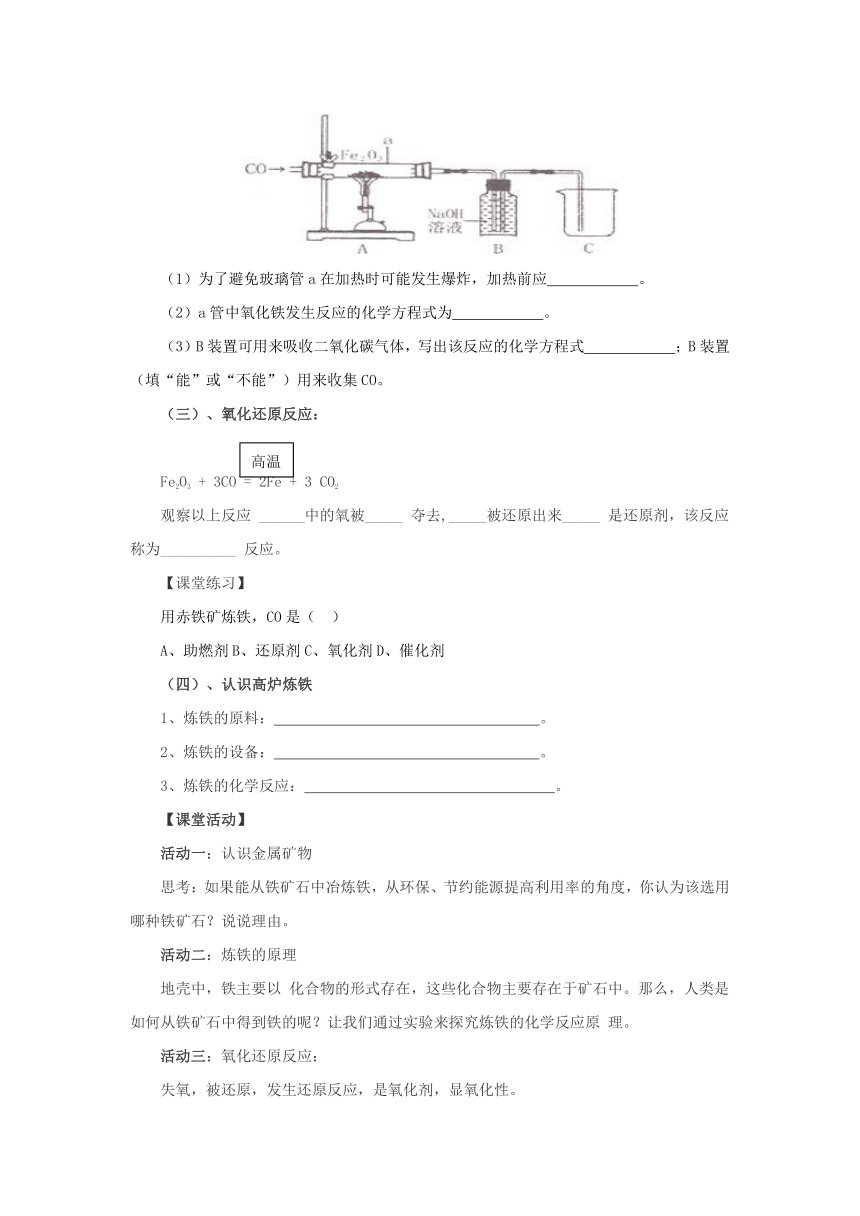
【课堂练习】某化学兴趣小组同学利用图中所示装置模拟炼铁:
(1)为了避免玻璃管a在加热时可能发生爆炸,加热前应 。
(2)a管中氧化铁发生反应的化学方程式为 。
(3)B装置可用来吸收二氧化碳气体,写出该反应的化学方程式 ;B装置 (填“能”或“不能”)用来收集CO。
(三)、氧化还原反应:
Fe2O3 + 3CO = 2Fe + 3 CO2
观察以上反应 ______中的氧被_____ 夺去,_____被还原出来_____ 是还原剂,该反应称为__________ 反应。
【课堂练习】
用赤铁矿炼铁,CO是( )
A、助燃剂B、还原剂C、氧化剂D、催化剂
(四)、认识高炉炼铁
1、炼铁的原料: 。
2、炼铁的设备: 。
3、炼铁的化学反应: 。
【课堂活动】
活动一:认识金属矿物
思考:如果能从铁矿石中冶炼铁,从环保、节约能源提高利用率的角度,你认为该选用哪种铁矿石?说说理由。
活动二:炼铁的原理
地壳中,铁主要以 化合物的形式存在,这些化合物主要存在于矿石中。那么,人类是如何从铁矿石中得到铁的呢?让我们通过实验来探究炼铁的化学反应原 理。
活动三:氧化还原反应:
失氧,被还原,发生还原反应,是氧化剂,显氧化性。
得氧,被氧化,发生氧化反应,是还原剂,显还原性。
活动四:认识高炉炼铁
原料、设备、主要的化学反应
【课堂检测】
1、常见的铁矿石有 、 、 、等,常用来炼铁的有 、 等,炼铁的主要原理是 。
2、下列物质中,属于化合物的是()
A、生铁 B、铁矿石 C、赤铁矿 D、四氧化三铁
3、人类应合理利用和开发金属资源.
(1)一氧化碳与氧化铁反应的化学方程式为 .
(2)高压电线一般用铝而不用铜的主要原因是 ;灯泡里的灯丝用钨而不用锡的主要原因是 .
(3)铁制品在潮湿的空气中易生锈,是因为铁与 发生化学反应,可以防止铁制品锈蚀的一种方法是 。
4、(1)空气通过进风口与原料中的焦炭充分反应,其化学方程式为 。
(2)由(1)中产生的气体与炽热的焦炭会继续反应,其化学方程式为 。
(3)生成生铁的主要反应为Fe2O3+3CO2Fe+3CO2,该反应中发生氧化反应的物质是 (填序号)。
A.Fe2O3 B.CO C.Fe D.CO2
(4)高炉气体的主要成分为N2、CO、CO2,如果将高炉气体通入足量的NaOH溶液中,发生反应的化学方程式为 。
【课堂小结】
1、认识常见的金属矿物,它们的成分。
2、一氧化碳还原氧化铁的装置、操作注意事项、现象以及化学方程式的书写。
高温
【学习目标】:
1、了解常见铁矿石的主要成分。
2、掌握炼铁的原理、装置、现象。
【重点、难点】
重点:炼铁的原理、装置、现象。
难点:炼铁方程式。还原反应。
【基础知识预习】
(一)、认识金属矿物。
1、铁在自然界中大多以 存在。
2、常见的铁矿石主要有哪几种?每种矿石的主要成分分别是什么?
【课堂练习】
现有①磁铁矿(主要成分是Fe3O4)、②黄铁矿(主要成分是FeS2)③赤铁矿(主要成分是Fe2O3),请你从多角度分析三种矿石中不适合用来炼铁的是(填序号) ,原因是 。
(二)、铁的冶炼
根据一氧化碳还原氧化铁实验填写:
(1)试管中澄清石灰水的变化是________, 玻璃管中的红色固体粉末变成了________, 右侧玻璃管处_______________。
(2)实验中,先通入一氧化碳气体然后再加热的目的是__________,实验完毕后继续通入一氧化碳气体的目的是________________。
(3)你认为反应中生成了什么物质?如何判断生成的新物质?
该反应的化学方程式为________________ 。
(4)装置中右边的酒精灯起什么作用?对此你还有没有其他的处理方法?
实验表明,氧化铁和一氧化碳在高温条件下发生反应,生成金属铁和二氧化碳。反应的化学方程式为:_______________________________。
【课堂练习】某化学兴趣小组同学利用图中所示装置模拟炼铁:
(1)为了避免玻璃管a在加热时可能发生爆炸,加热前应 。
(2)a管中氧化铁发生反应的化学方程式为 。
(3)B装置可用来吸收二氧化碳气体,写出该反应的化学方程式 ;B装置 (填“能”或“不能”)用来收集CO。
(三)、氧化还原反应:
Fe2O3 + 3CO = 2Fe + 3 CO2
观察以上反应 ______中的氧被_____ 夺去,_____被还原出来_____ 是还原剂,该反应称为__________ 反应。
【课堂练习】
用赤铁矿炼铁,CO是( )
A、助燃剂B、还原剂C、氧化剂D、催化剂
(四)、认识高炉炼铁
1、炼铁的原料: 。
2、炼铁的设备: 。
3、炼铁的化学反应: 。
【课堂活动】
活动一:认识金属矿物
思考:如果能从铁矿石中冶炼铁,从环保、节约能源提高利用率的角度,你认为该选用哪种铁矿石?说说理由。
活动二:炼铁的原理
地壳中,铁主要以 化合物的形式存在,这些化合物主要存在于矿石中。那么,人类是如何从铁矿石中得到铁的呢?让我们通过实验来探究炼铁的化学反应原 理。
活动三:氧化还原反应:
失氧,被还原,发生还原反应,是氧化剂,显氧化性。
得氧,被氧化,发生氧化反应,是还原剂,显还原性。
活动四:认识高炉炼铁
原料、设备、主要的化学反应
【课堂检测】
1、常见的铁矿石有 、 、 、等,常用来炼铁的有 、 等,炼铁的主要原理是 。
2、下列物质中,属于化合物的是()
A、生铁 B、铁矿石 C、赤铁矿 D、四氧化三铁
3、人类应合理利用和开发金属资源.
(1)一氧化碳与氧化铁反应的化学方程式为 .
(2)高压电线一般用铝而不用铜的主要原因是 ;灯泡里的灯丝用钨而不用锡的主要原因是 .
(3)铁制品在潮湿的空气中易生锈,是因为铁与 发生化学反应,可以防止铁制品锈蚀的一种方法是 。
4、(1)空气通过进风口与原料中的焦炭充分反应,其化学方程式为 。
(2)由(1)中产生的气体与炽热的焦炭会继续反应,其化学方程式为 。
(3)生成生铁的主要反应为Fe2O3+3CO2Fe+3CO2,该反应中发生氧化反应的物质是 (填序号)。
A.Fe2O3 B.CO C.Fe D.CO2
(4)高炉气体的主要成分为N2、CO、CO2,如果将高炉气体通入足量的NaOH溶液中,发生反应的化学方程式为 。
【课堂小结】
1、认识常见的金属矿物,它们的成分。
2、一氧化碳还原氧化铁的装置、操作注意事项、现象以及化学方程式的书写。
高温
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
