鲁教版化学九年级上册第4单元我们周围的空气复习课件(共23张PPT)
文档属性
| 名称 | 鲁教版化学九年级上册第4单元我们周围的空气复习课件(共23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 626.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
九年级
第四单元 我们周围的空气
组成
污染与
防治
氧气
性质
用途
制法
空气
我们周围
的空气
知识网络
知识点1 空气的组成
知识点2 空气的污染和防治
知识点3 氧气的性质
知识点4 氧气的制法
知识点5 催化剂和催化作用
内容整合
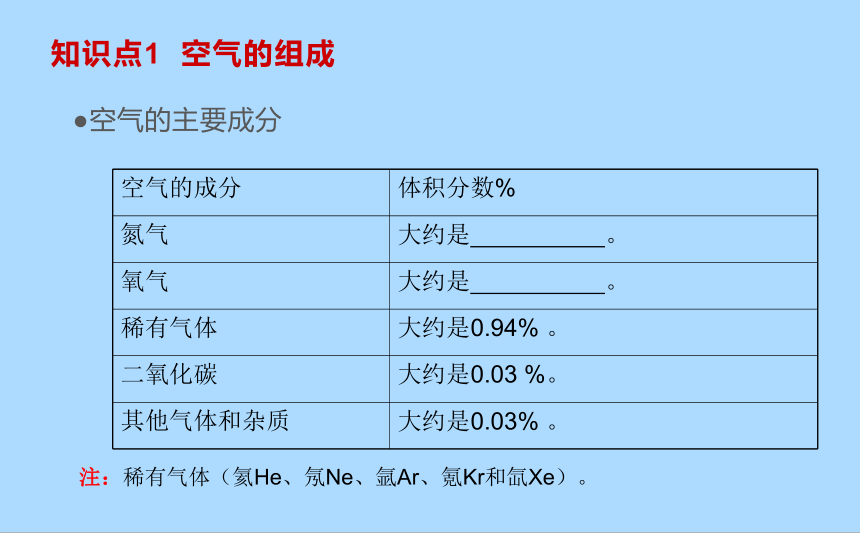
知识点1 空气的组成
空气的主要成分
空气的成分 体积分数%
氮气 大约是 。
氧气 大约是 。
稀有气体 大约是0.94% 。
二氧化碳 大约是0.03 %。
其他气体和杂质 大约是0.03% 。
注:稀有气体(氦He、氖Ne、氩Ar、氪Kr和氙Xe)。
氧气、氮气及稀有气体的性质和用途
物质 主要性质 重要用途
氧气 能供给呼吸 潜水、医疗急救等
能支持燃烧 燃料燃烧、炼钢等
氮气 化学性质不活泼 作保护气,灯泡中充氮,食品防腐等
稀有
气体 化学性质很不活泼 作保护气,充入灯泡使其经久耐用
通电时会发出不同颜色的光 制作霓虹灯等电光源
空气里氧气含量的测定
1.药品: 。
2.装置:如右图。
红磷
铁夹
水
测定空气里氧气含量
红磷在空气中燃烧的反应式:
P + O2 → P2O5(白色固体)
3.现象:有大量的 产生,
集气瓶内水面上升约 体积。
4.结论:空气是混合物;O2约占1/5,可支持燃烧;N2约占4/5,不支持燃烧,也不能燃烧,难溶于水。
注意:(1)要求反应物①稍过量②固体③在空气中只能和氧气发生反应④生成产物是固体;
(2)装置气密性要好
(3)观察水面进入容器里的高度应待容器中的温度冷却至常温
知识点2 空气污染和防治
空气污染: 造成空气污染的有害物质分为两类:粉层和有害气体。粉层又称为悬浮颗粒物。
有害气体主要是指: 、 和二氧化氮(或氮氧化物)等。
危害
防治
注:空气质量日报的主要内容,空气污染指数、首要污染物、空气质量级别和空气质量状况、PM2.5等。
知识点3 氧气的性质
物理性质
1.通常情况下,氧气是一种 色 未的气体。
2.标准状况下,氧气的密度略 空气的密度。
3.氧气 溶于水。
4.液体氧 色。
5.固体氧 色。
收集方法
排水法
不易溶于水的气体
向上排空气法
密度比空气大的气体
向上排空气法
密度比空气小的气体
不同物质在氧气中燃烧的实验记录
蜡烛在氧气中的燃烧
铁丝在氧气中的燃烧
木炭在氧气中的燃烧
反应的文字表达式
实验现象
实验名称
1、在氧气中燃烧发出白光
(在空气中红热)
2、放出热量
3、生成使澄清的石灰水浑浊的气体
C+ O2 CO2
点燃
碳+氧气 二氧化碳
点燃
铁+氧气 四氧化三铁
点燃
Fe+ O2 Fe3O4
点燃
石蜡+氧气 二氧化碳 +水
点燃
1、剧烈燃烧,火星四射
2、放出大量的热
3、生成黑色固体
1、火焰明亮发出白光
2、放出热量
3、瓶壁上有小液滴出现
4、生成使澄清石灰水变浑浊的气体
2.化合反应与氧化反应的区别和联系
化合反应 氧化反应
概念 由两种或两种以上物质生成
另一种物质的反应 物质与氧发生的反应
区别 属于基本反应类型 不属于基本反应类型
联系 化合反应不一定是氧化反应,氧化反应不一定是化合
反应,有氧参加的化合反应,同时也一定是氧化反
应。
注意:(1)判断某化学反应是不是化合反应,要看生成物是否只有一种,若只有一种,则属于化合反应。
(2)判断某化学反应是不是氧化反应,要看参加化学反应的物质有没有跟氧发生反应。
知识点4 氧气的制法
氧气实验室制法
药品 过氧化氢溶液和二氧化锰 高锰酸钾或
氯酸钾和二氧化锰
反应
原理
2H202 2 H2O + O2 ↑
KMnO4 2K2MnO4 + MnO2+O2↑
2KClO3 2KCl + 3O2↑
发生
装置
收集 排水法收集氧气或向上排空气法收集氧气。
检验 用带火星的木条伸到集气瓶中,若木条复燃,说明是氧气。
验满 用带火星的木条放在集气瓶口,若木条复燃,说明氧气已集满。
MnO2
△
MnO2
△
固+液 制取气体
固+固 制取气体
制取气体发生装置的比较与选择
特点:固体与液体反应,
不需要加热
特点:反应物为固体,需要加热
气体发生装置的选择依据:
反应物及生成物的状态及反应条件
用向上排空气法收集时,将带火星的木条放在瓶口,如果木条复燃,说明该瓶内的氧气已满。
验满方法
氧气的工业制法
工业制取氧气:分离液态空气法
原理:氮气和氧气 不同。
纯净的空气
加压
降温
液体空气
蒸发
氮气
液态氧
注意:①氧气的工业制法是 物理变化。
②氧气的实验室制法是化学变化。
化学反应类型
化合反应 分解反应
概念 由两种或两种以上物质生
成另一种物质的反应 由一种反应物生成两种或两
种以上其他物质的反应
特点 多变一 一变多
表示式 A+B→AB AB→A + B
举例 2CaO +2H2O==2
Ca(OH)2 H20 H2↑+ O2↑
化合反应与分解反应的区别
通电
知识点5 催化剂和催化作用
催化剂(触媒):在化学反应中能 其他物质的化学反应速率,而本身的 , 性质在反应前后都没有发生变化的物质。(一变两不变)
催化剂在化学反应中所起的作用叫催化作用。
注意:①催化剂能改变其他物质的反应速率,这里的“改变”包括加快和减慢两种含义。
②催化剂的化学性质在化学反应前后没用改变,但是物理性质可能改变。
③催化剂是针对具体反应而言。
1、NO是汽车尾气中的一种大气污染物,它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体。在实验室中,收集NO时可选用的集气方法是( )
A、排水集气法
B、向上排空气法
C、向下排空气法
D、排水法或向上排空气法
A
(1)写出下列仪器的名称:
① ② ③ 。
(2)选择A与E或 共同组合成制取装置可制取氧气。
(3)选B作制取气体的发生装置,应满足的
条件是: 。
2、根据下列实验装置图,回答问题:
酒精灯
试管
集气瓶
C
①反应物是固体和液体 ②不需加热
1、水是生命之源,以下生活中的“水”能看成纯净物的是 ( )
A、矿泉水; B、食盐水;
C、自来水;D、部分结冰的蒸馏水;
D
B
2、下列反应属于分解反应的是 ( )
A、硫 + 氧气 二氧化硫
B、氧化汞 氧气 + 汞
C、铁 + 氧气 四氧化三铁
D、石蜡 + 氧气 二氧化碳 + 水
点燃
点燃
加热
点燃
3、下列反应中,不是缓慢氧化的是( )
A、食物的腐烂 B、农家肥的腐熟
C、炸药的爆炸 D、动植物的呼吸
C
4、下列化学反应中,既是化合反应,又是氧化反应的是 ( )
A、H2O2 H2O + O2
B、P + O2 P2O5
C、CH4 + O2 CO2 + O2
D、KMnO4 K2MnO4 + MnO2 + O2
MnO2
点燃
点燃
加热
B
祝同学们学习愉快!
九年级
第四单元 我们周围的空气
组成
污染与
防治
氧气
性质
用途
制法
空气
我们周围
的空气
知识网络
知识点1 空气的组成
知识点2 空气的污染和防治
知识点3 氧气的性质
知识点4 氧气的制法
知识点5 催化剂和催化作用
内容整合
知识点1 空气的组成
空气的主要成分
空气的成分 体积分数%
氮气 大约是 。
氧气 大约是 。
稀有气体 大约是0.94% 。
二氧化碳 大约是0.03 %。
其他气体和杂质 大约是0.03% 。
注:稀有气体(氦He、氖Ne、氩Ar、氪Kr和氙Xe)。
氧气、氮气及稀有气体的性质和用途
物质 主要性质 重要用途
氧气 能供给呼吸 潜水、医疗急救等
能支持燃烧 燃料燃烧、炼钢等
氮气 化学性质不活泼 作保护气,灯泡中充氮,食品防腐等
稀有
气体 化学性质很不活泼 作保护气,充入灯泡使其经久耐用
通电时会发出不同颜色的光 制作霓虹灯等电光源
空气里氧气含量的测定
1.药品: 。
2.装置:如右图。
红磷
铁夹
水
测定空气里氧气含量
红磷在空气中燃烧的反应式:
P + O2 → P2O5(白色固体)
3.现象:有大量的 产生,
集气瓶内水面上升约 体积。
4.结论:空气是混合物;O2约占1/5,可支持燃烧;N2约占4/5,不支持燃烧,也不能燃烧,难溶于水。
注意:(1)要求反应物①稍过量②固体③在空气中只能和氧气发生反应④生成产物是固体;
(2)装置气密性要好
(3)观察水面进入容器里的高度应待容器中的温度冷却至常温
知识点2 空气污染和防治
空气污染: 造成空气污染的有害物质分为两类:粉层和有害气体。粉层又称为悬浮颗粒物。
有害气体主要是指: 、 和二氧化氮(或氮氧化物)等。
危害
防治
注:空气质量日报的主要内容,空气污染指数、首要污染物、空气质量级别和空气质量状况、PM2.5等。
知识点3 氧气的性质
物理性质
1.通常情况下,氧气是一种 色 未的气体。
2.标准状况下,氧气的密度略 空气的密度。
3.氧气 溶于水。
4.液体氧 色。
5.固体氧 色。
收集方法
排水法
不易溶于水的气体
向上排空气法
密度比空气大的气体
向上排空气法
密度比空气小的气体
不同物质在氧气中燃烧的实验记录
蜡烛在氧气中的燃烧
铁丝在氧气中的燃烧
木炭在氧气中的燃烧
反应的文字表达式
实验现象
实验名称
1、在氧气中燃烧发出白光
(在空气中红热)
2、放出热量
3、生成使澄清的石灰水浑浊的气体
C+ O2 CO2
点燃
碳+氧气 二氧化碳
点燃
铁+氧气 四氧化三铁
点燃
Fe+ O2 Fe3O4
点燃
石蜡+氧气 二氧化碳 +水
点燃
1、剧烈燃烧,火星四射
2、放出大量的热
3、生成黑色固体
1、火焰明亮发出白光
2、放出热量
3、瓶壁上有小液滴出现
4、生成使澄清石灰水变浑浊的气体
2.化合反应与氧化反应的区别和联系
化合反应 氧化反应
概念 由两种或两种以上物质生成
另一种物质的反应 物质与氧发生的反应
区别 属于基本反应类型 不属于基本反应类型
联系 化合反应不一定是氧化反应,氧化反应不一定是化合
反应,有氧参加的化合反应,同时也一定是氧化反
应。
注意:(1)判断某化学反应是不是化合反应,要看生成物是否只有一种,若只有一种,则属于化合反应。
(2)判断某化学反应是不是氧化反应,要看参加化学反应的物质有没有跟氧发生反应。
知识点4 氧气的制法
氧气实验室制法
药品 过氧化氢溶液和二氧化锰 高锰酸钾或
氯酸钾和二氧化锰
反应
原理
2H202 2 H2O + O2 ↑
KMnO4 2K2MnO4 + MnO2+O2↑
2KClO3 2KCl + 3O2↑
发生
装置
收集 排水法收集氧气或向上排空气法收集氧气。
检验 用带火星的木条伸到集气瓶中,若木条复燃,说明是氧气。
验满 用带火星的木条放在集气瓶口,若木条复燃,说明氧气已集满。
MnO2
△
MnO2
△
固+液 制取气体
固+固 制取气体
制取气体发生装置的比较与选择
特点:固体与液体反应,
不需要加热
特点:反应物为固体,需要加热
气体发生装置的选择依据:
反应物及生成物的状态及反应条件
用向上排空气法收集时,将带火星的木条放在瓶口,如果木条复燃,说明该瓶内的氧气已满。
验满方法
氧气的工业制法
工业制取氧气:分离液态空气法
原理:氮气和氧气 不同。
纯净的空气
加压
降温
液体空气
蒸发
氮气
液态氧
注意:①氧气的工业制法是 物理变化。
②氧气的实验室制法是化学变化。
化学反应类型
化合反应 分解反应
概念 由两种或两种以上物质生
成另一种物质的反应 由一种反应物生成两种或两
种以上其他物质的反应
特点 多变一 一变多
表示式 A+B→AB AB→A + B
举例 2CaO +2H2O==2
Ca(OH)2 H20 H2↑+ O2↑
化合反应与分解反应的区别
通电
知识点5 催化剂和催化作用
催化剂(触媒):在化学反应中能 其他物质的化学反应速率,而本身的 , 性质在反应前后都没有发生变化的物质。(一变两不变)
催化剂在化学反应中所起的作用叫催化作用。
注意:①催化剂能改变其他物质的反应速率,这里的“改变”包括加快和减慢两种含义。
②催化剂的化学性质在化学反应前后没用改变,但是物理性质可能改变。
③催化剂是针对具体反应而言。
1、NO是汽车尾气中的一种大气污染物,它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体。在实验室中,收集NO时可选用的集气方法是( )
A、排水集气法
B、向上排空气法
C、向下排空气法
D、排水法或向上排空气法
A
(1)写出下列仪器的名称:
① ② ③ 。
(2)选择A与E或 共同组合成制取装置可制取氧气。
(3)选B作制取气体的发生装置,应满足的
条件是: 。
2、根据下列实验装置图,回答问题:
酒精灯
试管
集气瓶
C
①反应物是固体和液体 ②不需加热
1、水是生命之源,以下生活中的“水”能看成纯净物的是 ( )
A、矿泉水; B、食盐水;
C、自来水;D、部分结冰的蒸馏水;
D
B
2、下列反应属于分解反应的是 ( )
A、硫 + 氧气 二氧化硫
B、氧化汞 氧气 + 汞
C、铁 + 氧气 四氧化三铁
D、石蜡 + 氧气 二氧化碳 + 水
点燃
点燃
加热
点燃
3、下列反应中,不是缓慢氧化的是( )
A、食物的腐烂 B、农家肥的腐熟
C、炸药的爆炸 D、动植物的呼吸
C
4、下列化学反应中,既是化合反应,又是氧化反应的是 ( )
A、H2O2 H2O + O2
B、P + O2 P2O5
C、CH4 + O2 CO2 + O2
D、KMnO4 K2MnO4 + MnO2 + O2
MnO2
点燃
点燃
加热
B
祝同学们学习愉快!
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
