化学人教版(2019)必修第一册2.3.1.物质的量的单位---摩尔(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.1.物质的量的单位---摩尔(共27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-17 07:59:16 | ||
图片预览





文档简介
(共27张PPT)
物质的量的单位---摩尔
人教版高中化学必修1
第三节 物质的量(第一课时)
人教版高中化学必修一
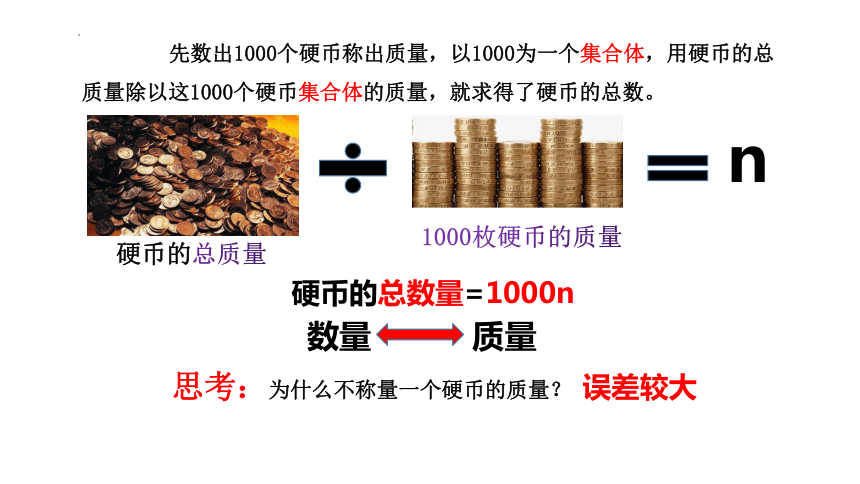
1994年美国俄亥俄州丹佛市的路易斯·史丹佛决定将他收藏了65年共40桶硬币存入银行,可是,他的财富对于银行的工作人员来说却意味着繁重的工作。
1000枚硬币的质量
硬币的总质量
n
硬币的总数量=1000n
思考:为什么不称量一个硬币的质量?
误差较大
先数出1000个硬币称出质量,以1000为一个集合体,用硬币的总质量除以这1000个硬币集合体的质量,就求得了硬币的总数。
数量
质量
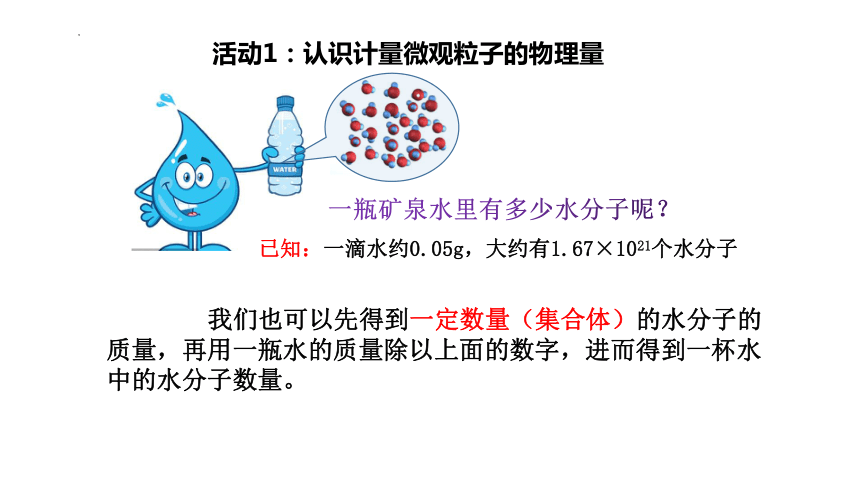
我们也可以先得到一定数量(集合体)的水分子的质量,再用一瓶水的质量除以上面的数字,进而得到一杯水中的水分子数量。
已知:一滴水约0.05g,大约有1.67×1021个水分子
一瓶矿泉水里有多少水分子呢?
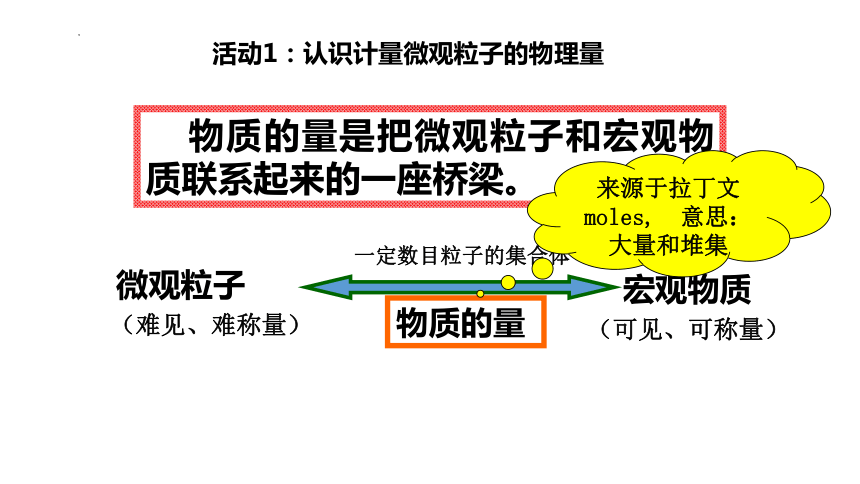
活动1:认识计量微观粒子的物理量
物质的量是把微观粒子和宏观物质联系起来的一座桥梁。
(难见、难称量)
微观粒子
宏观物质
(可见、可称量)
物质的量
一定数目粒子的集合体
活动1:认识计量微观粒子的物理量
来源于拉丁文 moles, 意思:大量和堆集
物质的量是一个物理量,它表示一定数目粒子的集合体。
活动1:认识计量微观粒子的物理量
一、物质的量
1972年,在第14届国际计量大会上,正式宣布了“物质的量”是国际单位制中的一个基本物理量。
符号:n
单位:摩尔,简称:摩,符号:mol
例如:1mol H2O,2mol Fe,3mol O2,4mol Na+
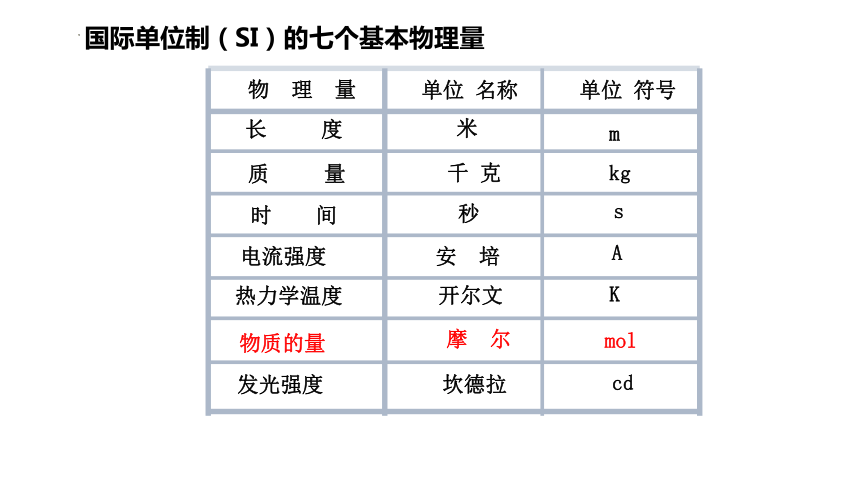
物 理 量
单位 名称
单位 符号
长 度
质 量
时 间
电流强度
热力学温度
发光强度
米
千 克
秒
安 培
开尔文
坎德拉
摩 尔
m
kg
s
A
K
cd
mol
物质的量
国际单位制(SI)的七个基本物理量
活动2:认识物质的量的单位
1件牛奶24瓶
二、物质的量的单位----摩尔(mol)
1包餐巾纸400张
………………
1mol粒子有多少个?
1盒图钉100颗
宏观物质的计量
微观物质的计量
二、物质的量的单位----摩尔
规定:1mol粒子的集合体所含的粒子数约为:6.02×1023。
阿伏伽德罗常数
通常用6.02×1023mol-1表示。
符号:NA
【多识一点】依据0.012kg 12C中所含C原子的数目
活动2:认识物质的量的单位
1、作为物质的量的单位,摩尔只能计量微观粒子(包括:原子、分子、离子、原子团、电子、质子、中子等),不能用来计量宏观物质。
例如:1mol Na、1molH2O 、1molFe2+、1molSO42-等
思考:能不能说1mol氧?
2、初中的粒子数量一般用“个”衡量,高中用“摩尔”衡量
1个CO2分子由1个C原子和2个O原子构成
1mol CO2分子中含有1mol C原子和2molO原子
活动2:认识物质的量的单位
例如:1mol H2O约含有6.02×1023个水分子。
2mol H2O约含有2×6.02×1023个水分子。
0.5mol H2O约含有0.5×6.02×1023个水分子。
3.01×1024个水分子的物质的量为多少?
N = n×NA
公式:
活动3:粒子数目、物质的量与阿伏伽德罗常数间的关系
n =
公式:
N
NA
微粒数
(N)
×NA
÷ NA
物质的量(n)
知识迁移
1个H2O---------2个H----------1个O
粒子数之比 = 物质的量之比
6.02×1023
2×6.02×1023
6.02×1023
1mol
2mol
1mol
N1
N2
=
n1
n2
活动3:粒子数目、物质的量与阿伏伽德罗常数间的关系
思考:从“1molH2O”你能获得哪些信息?
1、代表1mol水分子
2、1molH2O所含的水分子个数为6.02×1023个
3、1mol H2O所含氢原子个数为2×6.02×1023个
4、1mol H2O所含氧原子个数为6.02×1023个
6、1mol H2O所含2mol 氢原子、1mol氧原子、10mol电子
5、1mol H2O所含电子数为 10×6.02×1023个
………………
1.806×1024
4、1 mol Na2CO3中约含有___molNa+、___molCO32-离子,共含有离子的个数为 个。
1.806 ×1023
练习:
1、1 mol C中约含有 个碳原子
2、0.3 mol H2SO4含有 个硫酸分子,能电离出 mol H+。
3、 1.204 × 1024个H2O2分子的物质的量为 。
6.02×1023
2 mol
2
1
0.6
物质的量
微粒个数
2个
1个
2个
2mol
1mol
2mol
化学反应方程式中,系数之比即反应过程中
各物质的物质的量之比。
实验中,如何取出1mol或2mol粒子、或更多物质的量的物质?
三、摩尔质量
活动4:探究物质的量与质量间的关系
2×6.02×1023
2H2 + O2 2H2O
点燃
6.02×1023
2×6.02×1023
1个C原子 1.993×10-23 g
1万个C原子 104×1.993×10-23g= 1.993×10-18 g
1023个C原子 1023×1.993×10-23g= 1.993 g
6.02×1023个C原子 6.02×1023×1.993×10-23g=12 g
不好称
不好称
好称不方便
好称又方便
6.02×1023是个很好也很巧的数啊!!!
三、摩尔质量
怎么知道1mol物质的质量有多少?
请找出1mol物质的质量有什么规律?
O Al H2 H2O
一个分子或原子的质量 2.657×10-23g 4.485×10-23g 0.3294×10-23g 2.990×10-23g
物质的量 1mol 1mol 1mol 1mol
相对分子或原子质量
1mol物质的质量 16g 27g 2g 18g
16
27
2
18
1、不同物质由不同粒子组成,不同粒子质量不同
2、1mol任何粒子的质量以克为单位时,其数值都等于其相对分子或原子质量
——单位物质的量的物质所具有的质量
m = n · M
质量
(m)
×M
÷ M
物质的量(n)
(g)
n=m/M
(mol)
(g/mol)
符号:M 单位:g/mol g·mol-1
三、摩尔质量
例如:水的摩尔质量为18g/mol,
1mol H2O的质量为18g,
2mol H2O的质量为36g。
摩尔质量数值 = 相对分子(原子)质量
Na 的摩尔质量是 ,
KCl 的摩尔质量是 ,
Cl2 的摩尔质量是 ,
CO32- 的摩尔质量是 ,
注意:相对原子质量或相对分子质量与摩尔质量的数值相等但单位不同
23g/mol
74.5g/mol
71g/mol
60g/mol
[知识巩固]
物质的量为1mol的物质质量有多少?
2molH2SO4的质量是多少?
解:
m(H2SO4) = n(H2SO4)×M(H2SO4)
=2 mol×98g/mol
= 196g
答:2molH2SO4的质量为196g.
[知识巩固]
26.5gNa2CO3物质的量是多少?
【例题】
n(Na2CO3)=
2molH2SO4中氧元素的质量是多少?
解:1个硫酸分子中含有4个O,O的质量是
m(O) = n(H2SO4)×4 ×M(O)
=2 mol×4×16g/mol
= 128g
答:氧元素的质量为128g.
[知识巩固]
【练习】
(1)9.8g H2SO4的物质的量是 mol
(2)0.25mol CaCO3的质量是 g
(3)0.02mol某物质的质量为0.73g,,则该物质的摩尔质量为 g/mol
0.1
25
36.5
1、下列说法中,正确的是( )
A、28 g氮气含有氮原子数目为NA
B、1 molCH4的质量等于NA个甲烷分子质量之和
C、1 mol氧含有微粒数约为6.02×1023
D、1 mol H2O中含有1 mol H2和1 mol O
B
+
C
【提升训练】
完全中和10.2g某二元酸H2A需要氢氧化钠24g,则此二元酸H2A的物质的量是多少?A的相对原子质量是多少?
【提升训练】
H2A + 2NaOH = Na2A + 2H2O
1个H2A和2个NaOH中和,所以1mol H2A和2mol NaOH中和
24g氢氧化钠的物质的量为0.6mol,所以中和的H2A的物质的量为0.3mol
H2A的物质的量为0.3mol,已知其质量为10.2g,所以其摩尔质量为34g/mol,因为摩尔质量和相对分子质量在数值上相等,所以H2A的分子量为34,进而得到A的相对原子质量为32
1、物质的量:
小结:
衡量物质所含微观粒子数目的物理量
2、摩尔(mol):摩尔是物质的量的单位
1mol任何物质所含的粒子数量为阿伏加德罗常数(符号为NA),NA大约为6.02×1023mol-1
3、摩尔质量:
单位物质的量的物质所具有的质量,符号为M,单位为g/mol
物质的摩尔质量与其相对原子质量或相对分子质量的数值相同
物质的量的单位---摩尔
人教版高中化学必修1
第三节 物质的量(第一课时)
人教版高中化学必修一
1994年美国俄亥俄州丹佛市的路易斯·史丹佛决定将他收藏了65年共40桶硬币存入银行,可是,他的财富对于银行的工作人员来说却意味着繁重的工作。
1000枚硬币的质量
硬币的总质量
n
硬币的总数量=1000n
思考:为什么不称量一个硬币的质量?
误差较大
先数出1000个硬币称出质量,以1000为一个集合体,用硬币的总质量除以这1000个硬币集合体的质量,就求得了硬币的总数。
数量
质量
我们也可以先得到一定数量(集合体)的水分子的质量,再用一瓶水的质量除以上面的数字,进而得到一杯水中的水分子数量。
已知:一滴水约0.05g,大约有1.67×1021个水分子
一瓶矿泉水里有多少水分子呢?
活动1:认识计量微观粒子的物理量
物质的量是把微观粒子和宏观物质联系起来的一座桥梁。
(难见、难称量)
微观粒子
宏观物质
(可见、可称量)
物质的量
一定数目粒子的集合体
活动1:认识计量微观粒子的物理量
来源于拉丁文 moles, 意思:大量和堆集
物质的量是一个物理量,它表示一定数目粒子的集合体。
活动1:认识计量微观粒子的物理量
一、物质的量
1972年,在第14届国际计量大会上,正式宣布了“物质的量”是国际单位制中的一个基本物理量。
符号:n
单位:摩尔,简称:摩,符号:mol
例如:1mol H2O,2mol Fe,3mol O2,4mol Na+
物 理 量
单位 名称
单位 符号
长 度
质 量
时 间
电流强度
热力学温度
发光强度
米
千 克
秒
安 培
开尔文
坎德拉
摩 尔
m
kg
s
A
K
cd
mol
物质的量
国际单位制(SI)的七个基本物理量
活动2:认识物质的量的单位
1件牛奶24瓶
二、物质的量的单位----摩尔(mol)
1包餐巾纸400张
………………
1mol粒子有多少个?
1盒图钉100颗
宏观物质的计量
微观物质的计量
二、物质的量的单位----摩尔
规定:1mol粒子的集合体所含的粒子数约为:6.02×1023。
阿伏伽德罗常数
通常用6.02×1023mol-1表示。
符号:NA
【多识一点】依据0.012kg 12C中所含C原子的数目
活动2:认识物质的量的单位
1、作为物质的量的单位,摩尔只能计量微观粒子(包括:原子、分子、离子、原子团、电子、质子、中子等),不能用来计量宏观物质。
例如:1mol Na、1molH2O 、1molFe2+、1molSO42-等
思考:能不能说1mol氧?
2、初中的粒子数量一般用“个”衡量,高中用“摩尔”衡量
1个CO2分子由1个C原子和2个O原子构成
1mol CO2分子中含有1mol C原子和2molO原子
活动2:认识物质的量的单位
例如:1mol H2O约含有6.02×1023个水分子。
2mol H2O约含有2×6.02×1023个水分子。
0.5mol H2O约含有0.5×6.02×1023个水分子。
3.01×1024个水分子的物质的量为多少?
N = n×NA
公式:
活动3:粒子数目、物质的量与阿伏伽德罗常数间的关系
n =
公式:
N
NA
微粒数
(N)
×NA
÷ NA
物质的量(n)
知识迁移
1个H2O---------2个H----------1个O
粒子数之比 = 物质的量之比
6.02×1023
2×6.02×1023
6.02×1023
1mol
2mol
1mol
N1
N2
=
n1
n2
活动3:粒子数目、物质的量与阿伏伽德罗常数间的关系
思考:从“1molH2O”你能获得哪些信息?
1、代表1mol水分子
2、1molH2O所含的水分子个数为6.02×1023个
3、1mol H2O所含氢原子个数为2×6.02×1023个
4、1mol H2O所含氧原子个数为6.02×1023个
6、1mol H2O所含2mol 氢原子、1mol氧原子、10mol电子
5、1mol H2O所含电子数为 10×6.02×1023个
………………
1.806×1024
4、1 mol Na2CO3中约含有___molNa+、___molCO32-离子,共含有离子的个数为 个。
1.806 ×1023
练习:
1、1 mol C中约含有 个碳原子
2、0.3 mol H2SO4含有 个硫酸分子,能电离出 mol H+。
3、 1.204 × 1024个H2O2分子的物质的量为 。
6.02×1023
2 mol
2
1
0.6
物质的量
微粒个数
2个
1个
2个
2mol
1mol
2mol
化学反应方程式中,系数之比即反应过程中
各物质的物质的量之比。
实验中,如何取出1mol或2mol粒子、或更多物质的量的物质?
三、摩尔质量
活动4:探究物质的量与质量间的关系
2×6.02×1023
2H2 + O2 2H2O
点燃
6.02×1023
2×6.02×1023
1个C原子 1.993×10-23 g
1万个C原子 104×1.993×10-23g= 1.993×10-18 g
1023个C原子 1023×1.993×10-23g= 1.993 g
6.02×1023个C原子 6.02×1023×1.993×10-23g=12 g
不好称
不好称
好称不方便
好称又方便
6.02×1023是个很好也很巧的数啊!!!
三、摩尔质量
怎么知道1mol物质的质量有多少?
请找出1mol物质的质量有什么规律?
O Al H2 H2O
一个分子或原子的质量 2.657×10-23g 4.485×10-23g 0.3294×10-23g 2.990×10-23g
物质的量 1mol 1mol 1mol 1mol
相对分子或原子质量
1mol物质的质量 16g 27g 2g 18g
16
27
2
18
1、不同物质由不同粒子组成,不同粒子质量不同
2、1mol任何粒子的质量以克为单位时,其数值都等于其相对分子或原子质量
——单位物质的量的物质所具有的质量
m = n · M
质量
(m)
×M
÷ M
物质的量(n)
(g)
n=m/M
(mol)
(g/mol)
符号:M 单位:g/mol g·mol-1
三、摩尔质量
例如:水的摩尔质量为18g/mol,
1mol H2O的质量为18g,
2mol H2O的质量为36g。
摩尔质量数值 = 相对分子(原子)质量
Na 的摩尔质量是 ,
KCl 的摩尔质量是 ,
Cl2 的摩尔质量是 ,
CO32- 的摩尔质量是 ,
注意:相对原子质量或相对分子质量与摩尔质量的数值相等但单位不同
23g/mol
74.5g/mol
71g/mol
60g/mol
[知识巩固]
物质的量为1mol的物质质量有多少?
2molH2SO4的质量是多少?
解:
m(H2SO4) = n(H2SO4)×M(H2SO4)
=2 mol×98g/mol
= 196g
答:2molH2SO4的质量为196g.
[知识巩固]
26.5gNa2CO3物质的量是多少?
【例题】
n(Na2CO3)=
2molH2SO4中氧元素的质量是多少?
解:1个硫酸分子中含有4个O,O的质量是
m(O) = n(H2SO4)×4 ×M(O)
=2 mol×4×16g/mol
= 128g
答:氧元素的质量为128g.
[知识巩固]
【练习】
(1)9.8g H2SO4的物质的量是 mol
(2)0.25mol CaCO3的质量是 g
(3)0.02mol某物质的质量为0.73g,,则该物质的摩尔质量为 g/mol
0.1
25
36.5
1、下列说法中,正确的是( )
A、28 g氮气含有氮原子数目为NA
B、1 molCH4的质量等于NA个甲烷分子质量之和
C、1 mol氧含有微粒数约为6.02×1023
D、1 mol H2O中含有1 mol H2和1 mol O
B
+
C
【提升训练】
完全中和10.2g某二元酸H2A需要氢氧化钠24g,则此二元酸H2A的物质的量是多少?A的相对原子质量是多少?
【提升训练】
H2A + 2NaOH = Na2A + 2H2O
1个H2A和2个NaOH中和,所以1mol H2A和2mol NaOH中和
24g氢氧化钠的物质的量为0.6mol,所以中和的H2A的物质的量为0.3mol
H2A的物质的量为0.3mol,已知其质量为10.2g,所以其摩尔质量为34g/mol,因为摩尔质量和相对分子质量在数值上相等,所以H2A的分子量为34,进而得到A的相对原子质量为32
1、物质的量:
小结:
衡量物质所含微观粒子数目的物理量
2、摩尔(mol):摩尔是物质的量的单位
1mol任何物质所含的粒子数量为阿伏加德罗常数(符号为NA),NA大约为6.02×1023mol-1
3、摩尔质量:
单位物质的量的物质所具有的质量,符号为M,单位为g/mol
物质的摩尔质量与其相对原子质量或相对分子质量的数值相同
