鲁教版高中化学必修一第二章《元素与物质世界》 第3节《氧化剂和还原剂》课件(42张ppt)
文档属性
| 名称 | 鲁教版高中化学必修一第二章《元素与物质世界》 第3节《氧化剂和还原剂》课件(42张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-09 18:05:32 | ||
图片预览








文档简介
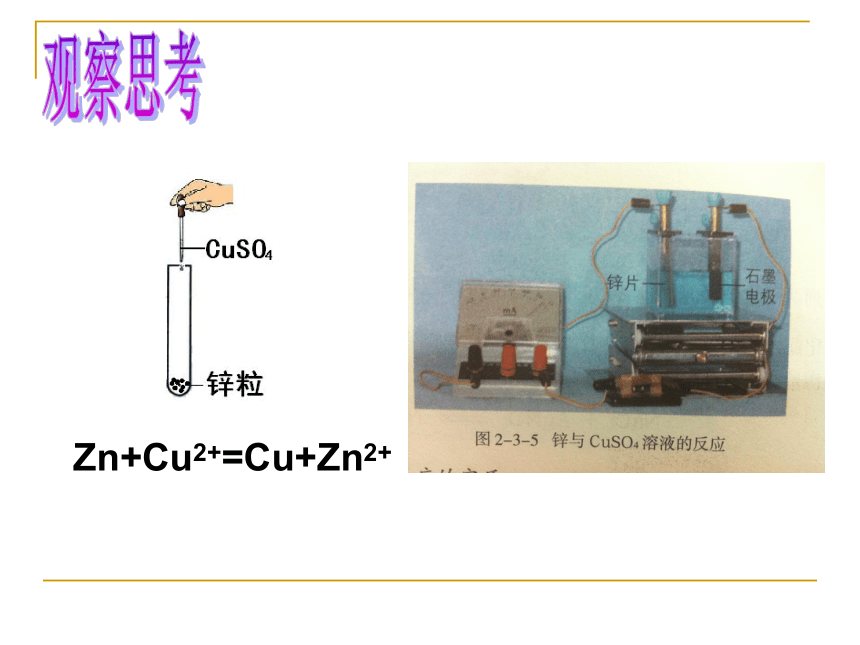
课件42张PPT。氧化剂和还原剂高一化学组第一课时① 4Na+O2==2Na2O③ NaOH + HCl == NaCl + H2O下列反应属于四种基本反应中的哪一种?化合反应置换反应复分解反应分解反应⑤ H2O + Cl2= HCl + HClO交流研讨?① 4Na+O2===2Na2O③ NaOH + HCl == NaCl + H2O交流研讨反应中元素化合价是否变化,怎样变化?⑤ H2O+Cl2=HCl+HClO0 0 +1 -2钠升氧降氢升铜降不变氧升氯降+2 0 0 +1部分氯升部分氯降 +5 -2 -1 0 0 -1 +1对于化学反应,由此你想到了怎样的分类方法?① 2Na+2H2O =2NaOH+H2 ↑② Zn +H2SO4=ZnSO4 + H2 ↑下列反应中哪些是氧化还原反应?③ 2Fe+3Cl2 2FeCl3④ BaCl2+H2SO4 =2HCl+ BaSO4↓⑤ 2Na +Cl2 == 2NaCl点燃学以致用钠原子和氯原子是经过怎样的变化形成Na+和Cl-,进而形成氯化钠的呢?观察思考Zn+Cu2+=Cu+Zn2+小组探究从化合价角度分析一下:
什么是还原剂?氧化剂?
什么是氧化产物?还原产物?
什么是氧化反应?还原反应? 以反应Fe2O3+3CO=2Fe+3CO2为例①Fe+2HCl=FeCl2+H2练习分析下列反应的氧化剂、还原剂、
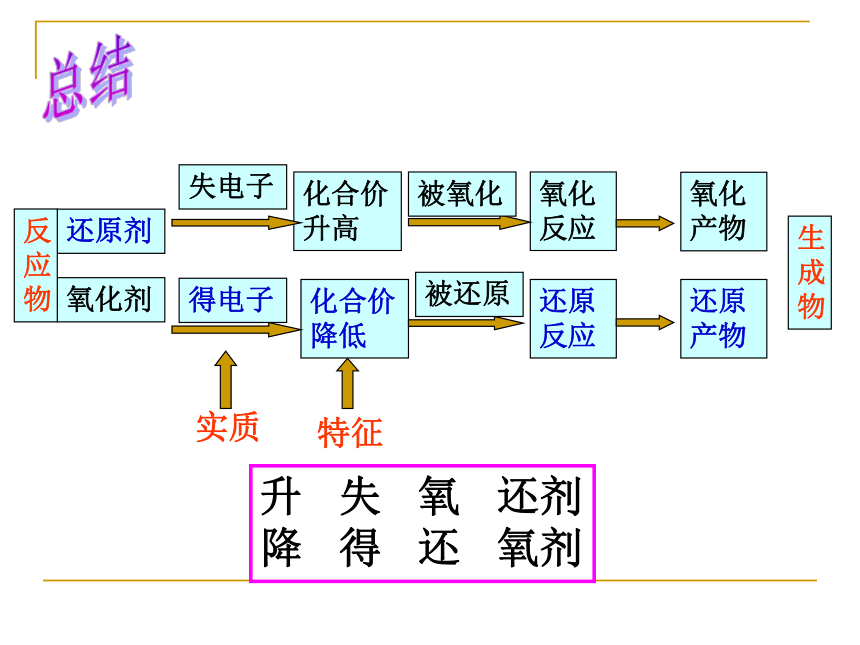
氧化产物、还原产物:氧化剂还原剂氧化反应化合价升高失电子化合价降低得电子还原反应还原产物氧化产物特征反应物生成物实质被氧化被还原升 失 氧 还剂
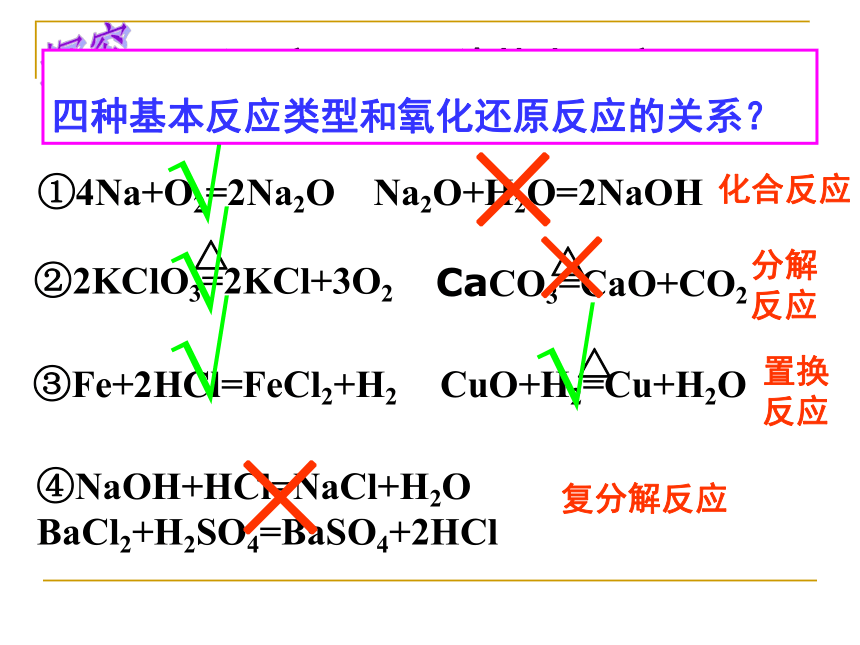
降 得 还 氧剂总结① 2Na+2H2O =2NaOH+H2 ↑② Zn +H2SO4=ZnSO4 + H2 ↑指出氧化剂、还原剂、氧化产物、还原产物③ 2Fe+3Cl2 2FeCl3④ BaCl2+H2SO4 =2HCl+ BaSO4↓⑤ Fe2O3 + 3CO ==2Fe + 3CO2高温练习①4Na+O2=2Na2O Na2O+H2O=2NaOH④NaOH+HCl=NaCl+H2O BaCl2+H2SO4=BaSO4+2HCl③Fe+2HCl=FeCl2+H2复分解反应化合反应分解
反应置换
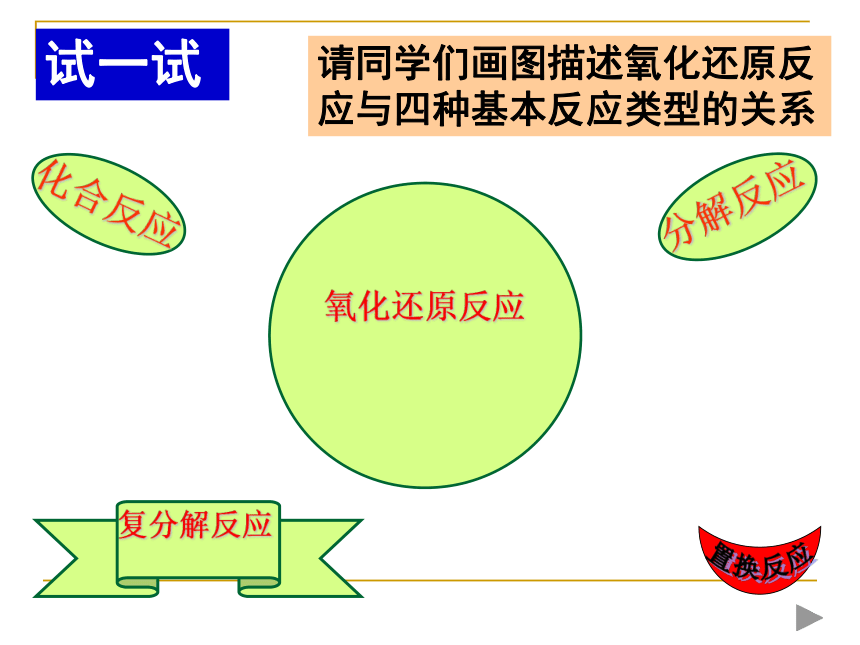
反应探究×√√√√××下列反应属于哪种基本反应? 是氧化还原反应吗?四种基本反应类型和氧化还原反应的关系?请同学们画图描述氧化还原反应与四种基本反应类型的关系氧化还原反应试一试1.氧化反应与还原反应能单独存在吗?2.有单质参加的反应一定是氧化还原反应吗?3.某元素由化合态变成游离态一定被还原吗?深入思考氧化剂和还原剂第二课时1.在反应MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
中,当有1molCl2生成时,有 molHCl
被氧化,MnO2得到 mol电子,反应中共转
移了 mol电子。练习2222.当反应2Na+2H2O=2NaOH+H2↑中转移了
0.5mol电子时,参加反应的Na是 mol。0. 5氧化剂还原剂还原产物氧化产物被氧化被还原还原性氧化性弱还原性弱氧化性探究氧化还原反应的规律:强弱律(1)根据反应方程式判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物根据反应式:
(1) 2Fe3++2I-=2Fe2++I2
(2) Br2+2Fe2+=2Br-+2Fe3+
可判断出离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br- 练习B探究氧化还原反应的规律:已知:
还原性(活泼性):Na>Ag
氧化性:Na+ Ag+
?强弱律(2)金属单质的还原性越强,
对应离子的氧化性越弱。探究氧化还原反应的规律:(3)根据反应条件判断
不同氧化剂与同一还原剂反应时,若氧化产物(价态)相同,反应条件越难,氧化剂的氧化性越弱。氧化性:KMnO4>MnO2>O2强弱律△探究氧化还原反应的规律:价态律Fe: 0 +2 +3最低价最高价中间价化合价只升高,只具有还原性化合价只降低,只具有氧化性既有氧化性,又有还原性高价氧化,低价还,
中间价态两边转。0价铁、+2价铁、+3铁具有氧化性还是还原性?在Fe3+、Fe2+、Al3+、H+、S、Cl-中 ,
只有氧化性的是_______________,
只有还原性的是_______________,
兼有的是_______________。练习Fe3+、Al3+、H+Cl-Fe2+、SHClO Na2O2
H2O2 MnO2 等KMnO4 FeCl3 KClO3HNO3 H2SO4(浓)Cl2 O2 活泼的
非金属单质含较高价态元素的含氧酸含较高价态元素的盐常 见 的 氧 化 剂Na、Zn、Fe 等H2 C 等CO SO2 Na2SO3KI Na2S较低价态元素的氧化物和盐非金属单质 活泼的
金属单质FeSO4常 见 的 还原 剂探究氧化还原反应的规律:价态转化律律同一元素的不同价态间反应时:
化合价只靠近,不交叉,不交换。分析:
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
的氧化产物和还原产物?练习分析:
2Na2O2+2H2O=4NaOH+O2的氧化产物和还原产物?探究氧化还原反应的规律:向含有Cu(NO3)2和AgNO3的混合液中加入Fe
粉时,先和Fe反应的是 。AgNO3当多种氧化剂(或还原剂)与同一种还原剂
(氧化剂)反应时,氧化性(还原性)最强
的优先反应。优先律双线桥法:
1.箭头由反应物指向生成物
2.箭头前后指的是同一种元素
3.标明电子得失和数目单线桥法:
1.箭头在反应物之间
2.箭头由还原剂的元素指向氧化剂的元素
3.只标明电子转移数目不标得失电子转移的表示方法:氧化还原反应配平:练习C+H2SO4(浓)—CO2+SO2+H2OCu+HNO3—Cu(NO3)2+NO+H2O2Na+2H2O=2NaOH+H2↑用单、双线桥分别表示下列反应中的电子转移:1.在Fe + 4HNO3(稀)= Fe(NO3)3 +NO ↑+2H2O反应中,判断以下说法是否正确,并解释原因。
A. Fe(NO3)3 是氧化剂
B.铁元素是还原剂
C. NO是还原剂
D.铁单质是还原剂
E.硝酸是氧化剂
F.硝酸中+5价的氮是氧化剂
错错错对对错练习
2.下列物质转化需要加入还原剂才能实现的是( )
A. SO32- →SO2 B. HCl→Cl2
C. Na →Na+ D. SO2→S D练习3.在下列三个反应中:
① SO2 + 2NaOH = Na2SO3 +H2O
② SO2 + 2H2S = 3S ↓ + 2 H2O
③ SO2 + Cl2 + 2 H2O = H2SO4 +2HCl
二氧化硫所起的作用( )
相同 B.不同 C. 作氧化剂 D.作还原剂B氧化剂和还原剂第三课时复习记忆1.价态律:
高价氧化,低价还,中间价态两边转
2.价态转化律:
a.相邻价态转化最容易;
b.同一元素的不同价态间反应时:
化合价只靠近,不交叉,不交换。
3.常见的氧化剂和还原剂(课本P53)思考铁元素常见化合价有哪些?你知道的对应物质有哪些?分别呈现什么颜色?黄铁矿(主FeS2)铁矿石磁铁矿(主Fe3O4)铁铁及其化合物FeO 黑色Fe2O3 红棕纯Fe
银白FeCl3(aq) 黄Fe(OH)2 白色Fe(OH)3 红褐FeCl3·6H2O棕黄FeSO4·7H2O浅绿FeCl2(aq) 浅绿Fe3O4黑色1.从化合价角度分析:
Fe具有 性;FeCl3具有 性;
FeCl2具有 性。 探究提供以下试剂:
稀硫酸、氯水、稀HNO3、FeCl3溶液、
FeCl2溶液、Fe粉、Zn粉、铜粉、KSCN溶液。其中可作氧化剂的有 ;
可作还原剂的有 。还原性氧化性氧化性、还原性稀硫酸、氯水、稀HNO3、FeCl3溶液FeCl2溶液、Fe粉、Zn粉、铜粉合作探究设计实验证明Fe、FeCl3、FeCl2的性质,
要证明反应的发生或产物的生成。 实验试剂:
氯水、FeCl3溶液、FeCl2溶液、
Zn粉、Fe粉、铜粉、KSCN溶液。思考2.如何检验Fe3+、Fe2+?1. FeCl3溶液中加入足量Zn粉会发生怎样的反应健康生活【知识运用】1.为什么实验室在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
答:防止Fe2+被氧化成Fe3+
Fe+2Fe3+=3Fe2+
http://www.e-huaxue.com 2.除去括号中的杂质,应选用的试剂分别
1)FeCl2溶液(FeCl3) ??? ? ?;
2) FeCl3溶液(FeCl2) ;
3)FeCl2溶液(CuCl2) 。
【知识运用】Fe粉氯水Fe粉3.现榨的苹果汁在空气中会由绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁含有Cu2+
C.苹果汁含有OH-
D.苹果汁含有Na+
4.为了检验某FeCl2溶液是否变质,可以向溶液中加入( )
A. NaOH 溶液 B. 铁片
C. KSCN 溶液 D.石蕊试液AC【知识运用】谢谢3.下列各组离子能大量共存于同一溶液的 是( )A. Fe3+ NH4+ Cl- H+ B. Fe2+ H+ CO32- Cl-C. Fe3+ OH- SO42- Cl- D. Fe2+ Ca2+ NO3- H+A【知识运用】
什么是还原剂?氧化剂?
什么是氧化产物?还原产物?
什么是氧化反应?还原反应? 以反应Fe2O3+3CO=2Fe+3CO2为例①Fe+2HCl=FeCl2+H2练习分析下列反应的氧化剂、还原剂、
氧化产物、还原产物:氧化剂还原剂氧化反应化合价升高失电子化合价降低得电子还原反应还原产物氧化产物特征反应物生成物实质被氧化被还原升 失 氧 还剂
降 得 还 氧剂总结① 2Na+2H2O =2NaOH+H2 ↑② Zn +H2SO4=ZnSO4 + H2 ↑指出氧化剂、还原剂、氧化产物、还原产物③ 2Fe+3Cl2 2FeCl3④ BaCl2+H2SO4 =2HCl+ BaSO4↓⑤ Fe2O3 + 3CO ==2Fe + 3CO2高温练习①4Na+O2=2Na2O Na2O+H2O=2NaOH④NaOH+HCl=NaCl+H2O BaCl2+H2SO4=BaSO4+2HCl③Fe+2HCl=FeCl2+H2复分解反应化合反应分解
反应置换
反应探究×√√√√××下列反应属于哪种基本反应? 是氧化还原反应吗?四种基本反应类型和氧化还原反应的关系?请同学们画图描述氧化还原反应与四种基本反应类型的关系氧化还原反应试一试1.氧化反应与还原反应能单独存在吗?2.有单质参加的反应一定是氧化还原反应吗?3.某元素由化合态变成游离态一定被还原吗?深入思考氧化剂和还原剂第二课时1.在反应MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
中,当有1molCl2生成时,有 molHCl
被氧化,MnO2得到 mol电子,反应中共转
移了 mol电子。练习2222.当反应2Na+2H2O=2NaOH+H2↑中转移了
0.5mol电子时,参加反应的Na是 mol。0. 5氧化剂还原剂还原产物氧化产物被氧化被还原还原性氧化性弱还原性弱氧化性探究氧化还原反应的规律:强弱律(1)根据反应方程式判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物根据反应式:
(1) 2Fe3++2I-=2Fe2++I2
(2) Br2+2Fe2+=2Br-+2Fe3+
可判断出离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br- 练习B探究氧化还原反应的规律:已知:
还原性(活泼性):Na>Ag
氧化性:Na+ Ag+
?强弱律(2)金属单质的还原性越强,
对应离子的氧化性越弱。探究氧化还原反应的规律:(3)根据反应条件判断
不同氧化剂与同一还原剂反应时,若氧化产物(价态)相同,反应条件越难,氧化剂的氧化性越弱。氧化性:KMnO4>MnO2>O2强弱律△探究氧化还原反应的规律:价态律Fe: 0 +2 +3最低价最高价中间价化合价只升高,只具有还原性化合价只降低,只具有氧化性既有氧化性,又有还原性高价氧化,低价还,
中间价态两边转。0价铁、+2价铁、+3铁具有氧化性还是还原性?在Fe3+、Fe2+、Al3+、H+、S、Cl-中 ,
只有氧化性的是_______________,
只有还原性的是_______________,
兼有的是_______________。练习Fe3+、Al3+、H+Cl-Fe2+、SHClO Na2O2
H2O2 MnO2 等KMnO4 FeCl3 KClO3HNO3 H2SO4(浓)Cl2 O2 活泼的
非金属单质含较高价态元素的含氧酸含较高价态元素的盐常 见 的 氧 化 剂Na、Zn、Fe 等H2 C 等CO SO2 Na2SO3KI Na2S较低价态元素的氧化物和盐非金属单质 活泼的
金属单质FeSO4常 见 的 还原 剂探究氧化还原反应的规律:价态转化律律同一元素的不同价态间反应时:
化合价只靠近,不交叉,不交换。分析:
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
的氧化产物和还原产物?练习分析:
2Na2O2+2H2O=4NaOH+O2的氧化产物和还原产物?探究氧化还原反应的规律:向含有Cu(NO3)2和AgNO3的混合液中加入Fe
粉时,先和Fe反应的是 。AgNO3当多种氧化剂(或还原剂)与同一种还原剂
(氧化剂)反应时,氧化性(还原性)最强
的优先反应。优先律双线桥法:
1.箭头由反应物指向生成物
2.箭头前后指的是同一种元素
3.标明电子得失和数目单线桥法:
1.箭头在反应物之间
2.箭头由还原剂的元素指向氧化剂的元素
3.只标明电子转移数目不标得失电子转移的表示方法:氧化还原反应配平:练习C+H2SO4(浓)—CO2+SO2+H2OCu+HNO3—Cu(NO3)2+NO+H2O2Na+2H2O=2NaOH+H2↑用单、双线桥分别表示下列反应中的电子转移:1.在Fe + 4HNO3(稀)= Fe(NO3)3 +NO ↑+2H2O反应中,判断以下说法是否正确,并解释原因。
A. Fe(NO3)3 是氧化剂
B.铁元素是还原剂
C. NO是还原剂
D.铁单质是还原剂
E.硝酸是氧化剂
F.硝酸中+5价的氮是氧化剂
错错错对对错练习
2.下列物质转化需要加入还原剂才能实现的是( )
A. SO32- →SO2 B. HCl→Cl2
C. Na →Na+ D. SO2→S D练习3.在下列三个反应中:
① SO2 + 2NaOH = Na2SO3 +H2O
② SO2 + 2H2S = 3S ↓ + 2 H2O
③ SO2 + Cl2 + 2 H2O = H2SO4 +2HCl
二氧化硫所起的作用( )
相同 B.不同 C. 作氧化剂 D.作还原剂B氧化剂和还原剂第三课时复习记忆1.价态律:
高价氧化,低价还,中间价态两边转
2.价态转化律:
a.相邻价态转化最容易;
b.同一元素的不同价态间反应时:
化合价只靠近,不交叉,不交换。
3.常见的氧化剂和还原剂(课本P53)思考铁元素常见化合价有哪些?你知道的对应物质有哪些?分别呈现什么颜色?黄铁矿(主FeS2)铁矿石磁铁矿(主Fe3O4)铁铁及其化合物FeO 黑色Fe2O3 红棕纯Fe
银白FeCl3(aq) 黄Fe(OH)2 白色Fe(OH)3 红褐FeCl3·6H2O棕黄FeSO4·7H2O浅绿FeCl2(aq) 浅绿Fe3O4黑色1.从化合价角度分析:
Fe具有 性;FeCl3具有 性;
FeCl2具有 性。 探究提供以下试剂:
稀硫酸、氯水、稀HNO3、FeCl3溶液、
FeCl2溶液、Fe粉、Zn粉、铜粉、KSCN溶液。其中可作氧化剂的有 ;
可作还原剂的有 。还原性氧化性氧化性、还原性稀硫酸、氯水、稀HNO3、FeCl3溶液FeCl2溶液、Fe粉、Zn粉、铜粉合作探究设计实验证明Fe、FeCl3、FeCl2的性质,
要证明反应的发生或产物的生成。 实验试剂:
氯水、FeCl3溶液、FeCl2溶液、
Zn粉、Fe粉、铜粉、KSCN溶液。思考2.如何检验Fe3+、Fe2+?1. FeCl3溶液中加入足量Zn粉会发生怎样的反应健康生活【知识运用】1.为什么实验室在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
答:防止Fe2+被氧化成Fe3+
Fe+2Fe3+=3Fe2+
http://www.e-huaxue.com 2.除去括号中的杂质,应选用的试剂分别
1)FeCl2溶液(FeCl3) ??? ? ?;
2) FeCl3溶液(FeCl2) ;
3)FeCl2溶液(CuCl2) 。
【知识运用】Fe粉氯水Fe粉3.现榨的苹果汁在空气中会由绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁含有Cu2+
C.苹果汁含有OH-
D.苹果汁含有Na+
4.为了检验某FeCl2溶液是否变质,可以向溶液中加入( )
A. NaOH 溶液 B. 铁片
C. KSCN 溶液 D.石蕊试液AC【知识运用】谢谢3.下列各组离子能大量共存于同一溶液的 是( )A. Fe3+ NH4+ Cl- H+ B. Fe2+ H+ CO32- Cl-C. Fe3+ OH- SO42- Cl- D. Fe2+ Ca2+ NO3- H+A【知识运用】
