化学人教版(2019)必修第一册3.2.金属材料(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2.金属材料(共35张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-17 15:54:55 | ||
图片预览









文档简介
(共35张PPT)
金属材料
01/常见的合金
03/金属铝
04/氧化铝
02/新型合金
05/氢氧化铝
目录
1.合金
(1)定义
合金是由两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质。
(2)特点
①合金的硬度及机械性能较好;
②合金的熔点低;
③合金具有各成分金属的化学性质。
一、常见的合金
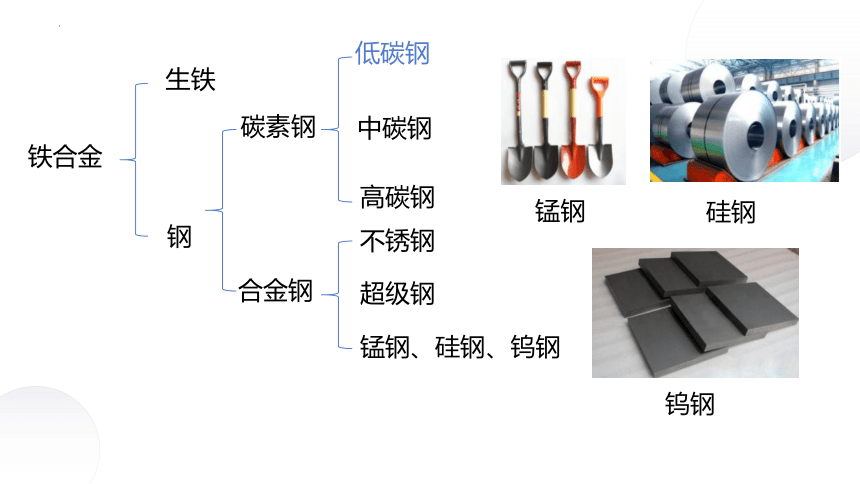
2.铁合金
生铁和钢是含碳量不同的两种铁碳合金。生铁的含碳量为2%~4.3%,生铁硬度大、抗压,性脆、可以铸造成型,是制造机座、管道的重要材料;钢是用量最大、用途最广的合金,钢的含碳量为0.03%~2%,根据化学成分钢又可分为两大类,即碳素钢和合金钢,钢有良好的延展性,机械性能好,可以锻轧和铸造,广泛用于制造机械和交通工具等。
铁合金
生铁
钢
碳素钢
合金钢
低碳钢
中碳钢
高碳钢
不锈钢
超级钢
锰钢、硅钢、钨钢
锰钢
硅钢
钨钢
3.铝合金
铝合金具有密度小、强度高、塑性好、制造工艺简单、成本低、耐抗腐蚀等特点,主要用于建筑业、交通运输业以及电子行业。铝合金可做建筑外墙材料及房屋的门窗,可制成汽车车轮骨架和飞机构件等。
【典例精讲】
1.下列有关铁和铁合金的说法错误的是( )
A.生铁比铁软
B.铁有良好的导热性
C.钢是铁的合金
D.生铁在潮湿的空气中容易生锈
A
1.钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的生物相容性。根据它们的主要性能,下列用途中不符合实际的是( )
A.用作保险丝 B.用于制造航天飞机
C.用于制造人造骨 D.用于家庭装修,作钛合金装饰门
【典例精讲】
A
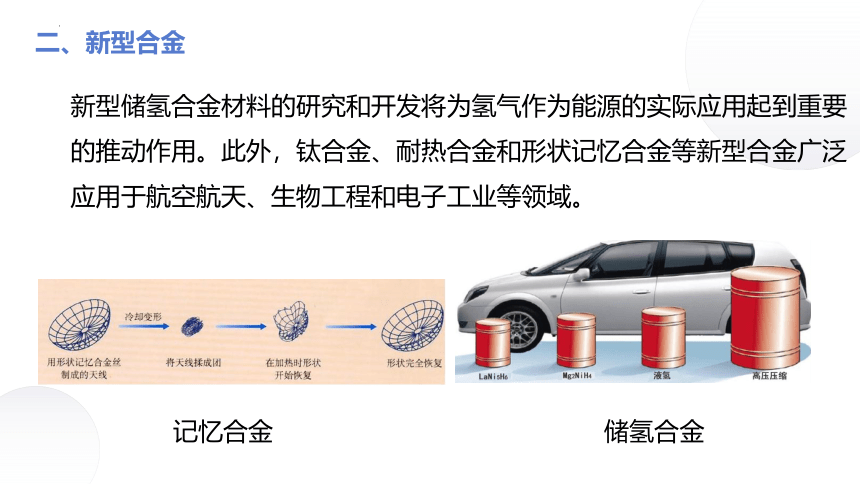
二、新型合金
新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。此外,钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
储氢合金
记忆合金
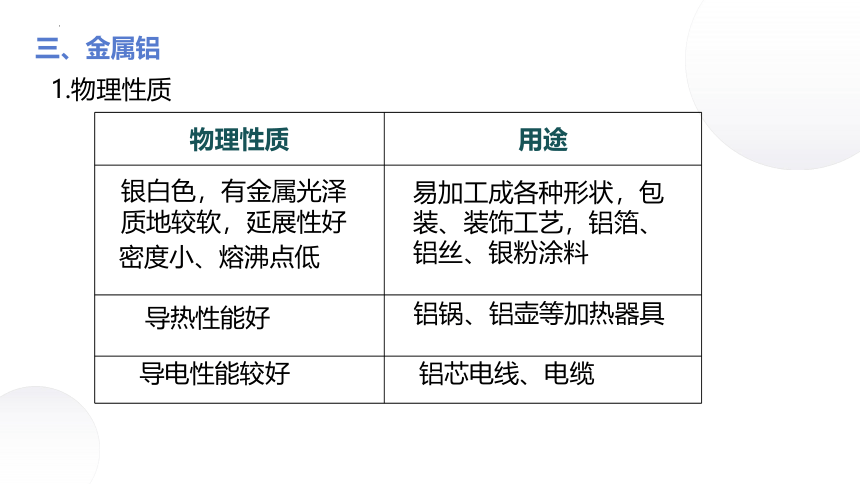
物理性质 用途
易加工成各种形状,包装、装饰工艺,铝箔、铝丝、银粉涂料
铝锅、铝壶等加热器具
铝芯电线、电缆
银白色,有金属光泽
质地较软,延展性好
密度小、熔沸点低
导热性能好
导电性能较好
三、金属铝
1.物理性质
自然界中没有单质铝存在,是因为铝原子最外层有3个电子,较易失去,表现较强的还原性。所以单质铝的化学性质较活泼,容易与氧气等物质发生反应。
2.金属铝的制取:
1854年,法国化学家德维尔把铝矾土、木炭、食盐混合,通入氯气后加热得到NaCl,AlCl3复盐,再将此复盐与过量的钠熔融,得到了金属铝。
1886年,美国的豪尔和法国的海朗特,分别独立地电解熔融的铝矾土和冰晶石(Na3AlF6)的混合物制得了金属铝,奠定了今后大规模生产铝的基础。
现象:在空气中铝不燃烧,铝箔熔化,表面失去光泽,但熔化的铝并没有滴落,好像有一层膜兜着。
用坩埚钳夹住一小片铝箔,在酒精灯上加热至熔化,轻轻晃动,仔细观察。
(1)铝与氧气反应
3.化学性质
讨论:另取一块铝箔,用砂纸打磨,除去表面的保护膜,再加热至熔化,又有什么现象?
磨去氧化膜的铝片在空气中很快又形成一层新的氧化膜。熔化的铝也没有滴落,被一层膜兜着。
结论:
1.铝很活泼,容易被氧化而生成一层有保护作用的致密氧化膜。
2. Al2O3的熔点比铝高。
4Al + 3O2 = 2Al2O3
现象:
铝箔在氧气里剧烈燃烧,产生白烟(白色固体),并放出大量的热、发出耀眼的白光。
将一小片用砂纸打磨过的铝箔,在纯氧中点燃,仔细观察。
4Al + 3O2 = 2Al2O3
点燃
2Al + Fe2O3
2Fe+ Al2O3
(2)铝与金属氧化物反应
8Al+ 3Fe3O4
9Fe+4Al2O3
10Al+3V2O5
5Al2O3+6V
铝热反应:
利用铝的还原性获得高熔点金属单质的方法。
铝与某些金属氧化物(三氧化二铁、三氧化二铬、二氧化锰等)
在高温条件下反应。
实验内容 实验现象 实验结论及化学方程式
铝与NaOH溶液反应
铝与HCl溶液反应
(3)铝与盐酸、氢氧化钠的反应
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
铝条溶解,有无色气体逸出
四羟基合铝酸钠
铝条溶解,有无色气体逸出
2Al+6HCl=2AlCl3+3H2↑
焊接钢轨
4.应用:焊接钢轨,冶炼钒、铬、锰等难熔金属。
知识整合:
Al
化合物
碱溶液
非金属单质
酸溶液
盐溶液
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2Al+6HCl=2AlCl3+3H2↑
2Al+3CuSO4=Al2(SO4)3+3Cu
4Al+3O2
2Al2O3
=
2Al + Fe2O3
2Fe+ Al2O3
通过上述所有化学反应,表现了铝具有强还原性。
【典例精讲】
1.下列关于铝说法不正确的是( )
A.铝是地壳中含量最多的金属元素
B.铝既能与盐酸反应,又能与NaOH溶液反应,都产生氢气,表现还原性
C.铝箔在空气中受热可以熔化,且剧烈燃烧
D.铝箔在空气中受热可以熔化,但由于氧化膜存在,熔化的铝并不掉落
C
【典例精讲】
2.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+4OH-=[Al(OH)4]-+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C
生活中,你或许有这样的经验:铝制器具不能用来盛放醋、酸梅汤、酸菜鱼或碱水等物质,如果长时间放置的话,铝制器具有可能被腐蚀,请分析其中的原因。
四、氧化铝
酸、碱可直接侵蚀铝的保护膜(氧化铝也能与酸或碱反应)以及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性的食物。
Al2O3——两性氧化物
Al2O3 +6H+=2Al3++3H2O
Al2O3 +2OH- = 2AlO2-+H2O
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2+ H2O
红宝石、蓝宝石是含少量不同金属氧化物的优质刚玉。
一般红宝石因含有少量铬元素而显红色,蓝宝石则因含少量铁和钛元素而显蓝色。
宝石的主要成分是氧化铝
【典例精讲】
1.下列化合物既能与稀盐酸反应又能与NaOH溶液反应的是( )
①Al ②(NH4)2CO3 ③Al2O3 ④Ca(HCO3)2 ⑤AgNO3 ⑥Al(OH)3
A.①②③④⑤⑥
B.②③④⑥
C.②③④⑤⑥
D.①②③⑥
A
【典例精讲】
2.下列说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.铝制品在生活中非常普遍,这是因为表面覆盖着氧化膜,对内部金属起保护作用
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.赤铁矿的主要成分是Fe3O4
D
实验探究: 制备Al(OH)3
现象:观察发现大试管中产生白色胶状物质。
AlCl3+3NH3·H2O = Al(OH)3↓+3NH4Cl
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
物理性质:难溶于水的白色胶状物,有吸附性,可作净水剂
五、氢氧化铝
操作:在一支大试管中加入10mL 1mol/L的AlCl3溶液,滴加过量氨水,观察现象。
取Al(OH)3分别装在2支试管中。向一支试管中滴加2mol/L盐酸,向另一支试管中滴加2mol/L NaOH溶液。边加边振荡,观察现象
两支试管中白色胶状沉淀均溶解。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2+ 2H2O
Al(OH)3既能与强酸反应,又能与强碱溶液反应。
2.氢氧化铝的性质
性质:
既能与强酸反应,又能与强碱反应——两性氢氧化物
Al(OH)3 +3H+=Al3++3H2O
Al(OH)3 +OH-=[Al (OH) 4] –
Al(OH)3 +OH-=Al O2-+2H2O
四羟基合铝酸根离子
Al(OH)3 -两性氢氧化物
氢氧化铝与酸和碱反应具有的性质
①反应均为离子反应;
②与酸反应计量比1:3,与碱反应计量比为1:1
3.氢氧化铝的热稳定性
2Al(OH)3 = Al2O3+3H2O
△
2Fe(OH)3 = Fe2O3+3H2O
△
Cu(OH)2 = CuO+H2O
△
铝元素形成的盐有很多种,高中常见的有AlCl3、NaAlO2、十二水合硫酸铝钾【KAl(SO4)2·12H2O】等。
KAl(SO4)2 ·12H2O
无色晶体、易溶于水
复盐:两种阳离子和一种酸根离子形成的盐
电离: KAl(SO4)2 =K++Al3++2SO42-
净水原理: 明矾在天然水中生成Al(OH)3胶体
Al(OH)3可以吸附水中悬浮泥沙形成絮状不溶物沉降下来,使水澄清
明矾(纯净物),用于净水剂
【典例精讲】
1.某学生向集满CO2的铝制易拉罐中加入过量的NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪,再过一段时间,罐壁又重新凸起。下列叙述正确的是( )
A.易拉罐渐渐凹瘪是因为发生了反应:CO2+OH-=HCO3-
B.反应过程中没有发生的反应:Al2O3+2OH-+3H2O=2[Al(OH)4]-
C.罐壁又重新凸起时发生反应的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
D.向NaOH溶液中滴加少量的AlCl3溶液可以制取Al(OH)3沉淀
C
【典例精讲】
2.某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、S2-
C.NH4+、Mg2+、SO42-、NO3-
D.H+、K+、Cl-、Na+
B
【典例精讲】
3.在10mL盐酸、氯化铝和氯化镁的混合溶液中,各阳离子的物质的量浓度相等,氯离子的物质的量浓度为7mol/L,向此溶液中加入1mol/L的NaOH溶液至沉淀质量最大时,此时所需NaOH溶液的体积为( )
A.70mL B.80mL C.50mL D.40mL
A
本次课结束!
金属材料
01/常见的合金
03/金属铝
04/氧化铝
02/新型合金
05/氢氧化铝
目录
1.合金
(1)定义
合金是由两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质。
(2)特点
①合金的硬度及机械性能较好;
②合金的熔点低;
③合金具有各成分金属的化学性质。
一、常见的合金
2.铁合金
生铁和钢是含碳量不同的两种铁碳合金。生铁的含碳量为2%~4.3%,生铁硬度大、抗压,性脆、可以铸造成型,是制造机座、管道的重要材料;钢是用量最大、用途最广的合金,钢的含碳量为0.03%~2%,根据化学成分钢又可分为两大类,即碳素钢和合金钢,钢有良好的延展性,机械性能好,可以锻轧和铸造,广泛用于制造机械和交通工具等。
铁合金
生铁
钢
碳素钢
合金钢
低碳钢
中碳钢
高碳钢
不锈钢
超级钢
锰钢、硅钢、钨钢
锰钢
硅钢
钨钢
3.铝合金
铝合金具有密度小、强度高、塑性好、制造工艺简单、成本低、耐抗腐蚀等特点,主要用于建筑业、交通运输业以及电子行业。铝合金可做建筑外墙材料及房屋的门窗,可制成汽车车轮骨架和飞机构件等。
【典例精讲】
1.下列有关铁和铁合金的说法错误的是( )
A.生铁比铁软
B.铁有良好的导热性
C.钢是铁的合金
D.生铁在潮湿的空气中容易生锈
A
1.钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的生物相容性。根据它们的主要性能,下列用途中不符合实际的是( )
A.用作保险丝 B.用于制造航天飞机
C.用于制造人造骨 D.用于家庭装修,作钛合金装饰门
【典例精讲】
A
二、新型合金
新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。此外,钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
储氢合金
记忆合金
物理性质 用途
易加工成各种形状,包装、装饰工艺,铝箔、铝丝、银粉涂料
铝锅、铝壶等加热器具
铝芯电线、电缆
银白色,有金属光泽
质地较软,延展性好
密度小、熔沸点低
导热性能好
导电性能较好
三、金属铝
1.物理性质
自然界中没有单质铝存在,是因为铝原子最外层有3个电子,较易失去,表现较强的还原性。所以单质铝的化学性质较活泼,容易与氧气等物质发生反应。
2.金属铝的制取:
1854年,法国化学家德维尔把铝矾土、木炭、食盐混合,通入氯气后加热得到NaCl,AlCl3复盐,再将此复盐与过量的钠熔融,得到了金属铝。
1886年,美国的豪尔和法国的海朗特,分别独立地电解熔融的铝矾土和冰晶石(Na3AlF6)的混合物制得了金属铝,奠定了今后大规模生产铝的基础。
现象:在空气中铝不燃烧,铝箔熔化,表面失去光泽,但熔化的铝并没有滴落,好像有一层膜兜着。
用坩埚钳夹住一小片铝箔,在酒精灯上加热至熔化,轻轻晃动,仔细观察。
(1)铝与氧气反应
3.化学性质
讨论:另取一块铝箔,用砂纸打磨,除去表面的保护膜,再加热至熔化,又有什么现象?
磨去氧化膜的铝片在空气中很快又形成一层新的氧化膜。熔化的铝也没有滴落,被一层膜兜着。
结论:
1.铝很活泼,容易被氧化而生成一层有保护作用的致密氧化膜。
2. Al2O3的熔点比铝高。
4Al + 3O2 = 2Al2O3
现象:
铝箔在氧气里剧烈燃烧,产生白烟(白色固体),并放出大量的热、发出耀眼的白光。
将一小片用砂纸打磨过的铝箔,在纯氧中点燃,仔细观察。
4Al + 3O2 = 2Al2O3
点燃
2Al + Fe2O3
2Fe+ Al2O3
(2)铝与金属氧化物反应
8Al+ 3Fe3O4
9Fe+4Al2O3
10Al+3V2O5
5Al2O3+6V
铝热反应:
利用铝的还原性获得高熔点金属单质的方法。
铝与某些金属氧化物(三氧化二铁、三氧化二铬、二氧化锰等)
在高温条件下反应。
实验内容 实验现象 实验结论及化学方程式
铝与NaOH溶液反应
铝与HCl溶液反应
(3)铝与盐酸、氢氧化钠的反应
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
铝条溶解,有无色气体逸出
四羟基合铝酸钠
铝条溶解,有无色气体逸出
2Al+6HCl=2AlCl3+3H2↑
焊接钢轨
4.应用:焊接钢轨,冶炼钒、铬、锰等难熔金属。
知识整合:
Al
化合物
碱溶液
非金属单质
酸溶液
盐溶液
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2Al+6HCl=2AlCl3+3H2↑
2Al+3CuSO4=Al2(SO4)3+3Cu
4Al+3O2
2Al2O3
=
2Al + Fe2O3
2Fe+ Al2O3
通过上述所有化学反应,表现了铝具有强还原性。
【典例精讲】
1.下列关于铝说法不正确的是( )
A.铝是地壳中含量最多的金属元素
B.铝既能与盐酸反应,又能与NaOH溶液反应,都产生氢气,表现还原性
C.铝箔在空气中受热可以熔化,且剧烈燃烧
D.铝箔在空气中受热可以熔化,但由于氧化膜存在,熔化的铝并不掉落
C
【典例精讲】
2.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+4OH-=[Al(OH)4]-+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C
生活中,你或许有这样的经验:铝制器具不能用来盛放醋、酸梅汤、酸菜鱼或碱水等物质,如果长时间放置的话,铝制器具有可能被腐蚀,请分析其中的原因。
四、氧化铝
酸、碱可直接侵蚀铝的保护膜(氧化铝也能与酸或碱反应)以及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性的食物。
Al2O3——两性氧化物
Al2O3 +6H+=2Al3++3H2O
Al2O3 +2OH- = 2AlO2-+H2O
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2+ H2O
红宝石、蓝宝石是含少量不同金属氧化物的优质刚玉。
一般红宝石因含有少量铬元素而显红色,蓝宝石则因含少量铁和钛元素而显蓝色。
宝石的主要成分是氧化铝
【典例精讲】
1.下列化合物既能与稀盐酸反应又能与NaOH溶液反应的是( )
①Al ②(NH4)2CO3 ③Al2O3 ④Ca(HCO3)2 ⑤AgNO3 ⑥Al(OH)3
A.①②③④⑤⑥
B.②③④⑥
C.②③④⑤⑥
D.①②③⑥
A
【典例精讲】
2.下列说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.铝制品在生活中非常普遍,这是因为表面覆盖着氧化膜,对内部金属起保护作用
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.赤铁矿的主要成分是Fe3O4
D
实验探究: 制备Al(OH)3
现象:观察发现大试管中产生白色胶状物质。
AlCl3+3NH3·H2O = Al(OH)3↓+3NH4Cl
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
物理性质:难溶于水的白色胶状物,有吸附性,可作净水剂
五、氢氧化铝
操作:在一支大试管中加入10mL 1mol/L的AlCl3溶液,滴加过量氨水,观察现象。
取Al(OH)3分别装在2支试管中。向一支试管中滴加2mol/L盐酸,向另一支试管中滴加2mol/L NaOH溶液。边加边振荡,观察现象
两支试管中白色胶状沉淀均溶解。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2+ 2H2O
Al(OH)3既能与强酸反应,又能与强碱溶液反应。
2.氢氧化铝的性质
性质:
既能与强酸反应,又能与强碱反应——两性氢氧化物
Al(OH)3 +3H+=Al3++3H2O
Al(OH)3 +OH-=[Al (OH) 4] –
Al(OH)3 +OH-=Al O2-+2H2O
四羟基合铝酸根离子
Al(OH)3 -两性氢氧化物
氢氧化铝与酸和碱反应具有的性质
①反应均为离子反应;
②与酸反应计量比1:3,与碱反应计量比为1:1
3.氢氧化铝的热稳定性
2Al(OH)3 = Al2O3+3H2O
△
2Fe(OH)3 = Fe2O3+3H2O
△
Cu(OH)2 = CuO+H2O
△
铝元素形成的盐有很多种,高中常见的有AlCl3、NaAlO2、十二水合硫酸铝钾【KAl(SO4)2·12H2O】等。
KAl(SO4)2 ·12H2O
无色晶体、易溶于水
复盐:两种阳离子和一种酸根离子形成的盐
电离: KAl(SO4)2 =K++Al3++2SO42-
净水原理: 明矾在天然水中生成Al(OH)3胶体
Al(OH)3可以吸附水中悬浮泥沙形成絮状不溶物沉降下来,使水澄清
明矾(纯净物),用于净水剂
【典例精讲】
1.某学生向集满CO2的铝制易拉罐中加入过量的NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪,再过一段时间,罐壁又重新凸起。下列叙述正确的是( )
A.易拉罐渐渐凹瘪是因为发生了反应:CO2+OH-=HCO3-
B.反应过程中没有发生的反应:Al2O3+2OH-+3H2O=2[Al(OH)4]-
C.罐壁又重新凸起时发生反应的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
D.向NaOH溶液中滴加少量的AlCl3溶液可以制取Al(OH)3沉淀
C
【典例精讲】
2.某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、S2-
C.NH4+、Mg2+、SO42-、NO3-
D.H+、K+、Cl-、Na+
B
【典例精讲】
3.在10mL盐酸、氯化铝和氯化镁的混合溶液中,各阳离子的物质的量浓度相等,氯离子的物质的量浓度为7mol/L,向此溶液中加入1mol/L的NaOH溶液至沉淀质量最大时,此时所需NaOH溶液的体积为( )
A.70mL B.80mL C.50mL D.40mL
A
本次课结束!
