5.1 .2质量守恒定律的应用课件—2022—2023学年九年级化学人教版上册(共35张PPT)
文档属性
| 名称 | 5.1 .2质量守恒定律的应用课件—2022—2023学年九年级化学人教版上册(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 36.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-16 22:22:49 | ||
图片预览











文档简介
(共35张PPT)
质量守恒定律的应用
1.什么是质量守恒定律?
温
故
知
新
参加化学反应的各物质的质量总和等于反应生成的各物质的质量总和。
1.什么是质量守恒定律?
参加化学反应的各物质的质量总和,等于反应生成的各物质的质量总和。
适用范围
研究的量
研究对象
各物质
总质量
适用于所有的化学变化,不适用于物理变化
是质量的守恒,不包括体积等其他方面的守恒
“参加化学反应”的物质,即实际反应掉的那一部分物质,没有参加反应的物质不计算在内
指所有参与反应的反应物和生成物,包括固态、液态、气态的所有物质
指物质的总质量守恒,而非某一种或几种物质的质量守恒
温
故
知
新
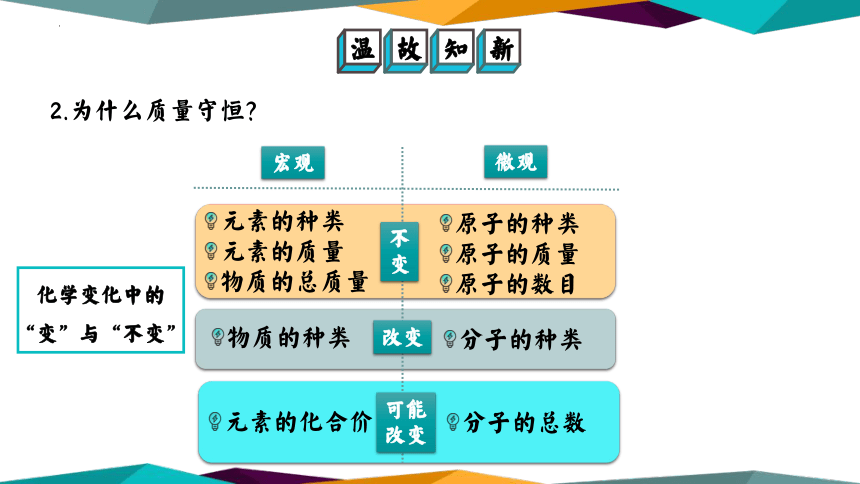
2.为什么质量守恒?
温
故
知
新
化学反应的实质是参加反应的各物质(反应物)原子重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示如下:
分子
原子
新分子
新物质
分裂
重新组合
聚集
2.为什么质量守恒?
温
故
知
新
元素的种类
元素的质量
物质的总质量
原子的种类
原子的质量
原子的数目
物质的种类
分子的种类
元素的化合价
分子的总数
不
变
改变
可能改变
宏观
微观
化学变化中的“变”与“不变”
解释化学变化中质量变化的现象
1
一、解释化学变化中质量变化的现象
例1.下列现象不能用质量守恒定律解释的是( )。
A.水结冰前后质量保持不变
B.5g蔗糖溶于95g水中,总质量为100g。
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g的水。
D.1.2g的碳和3.2g氧气恰好完全反应可生成4.4g二氧化碳。
质量守恒定律只适用于化学变化。
答案:D
一、解释化学变化中质量变化的现象
训练1 下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.5 g蔗糖溶于95 g水中,总质量为100 g
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g水
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
答案:D
一、解释化学变化中质量变化的现象
训练2 下列说法中,不能用质量守恒定律解释的是 ( )
A.蜡烛完全燃烧后,生成水和二氧化碳质量之和等于蜡烛的质量和参加反应的氧气的质量总和
B.镁带在空气中燃烧后,生成物的质量比镁带的质量增加了
C.高锰酸钾受热分解后,剩余固体的质量与反应物相比较质量减轻了
D. 50g的纸张用粉碎机粉碎后还是50g
答案:A
计算某一反应物或生成物的质量
2
二、计算某一反应物或生成物的质量。
例2 将agKClO3和bgMnO2混合加热到质量不再减少,得到剩余固体的质量为cg,该反应生成O2的质量 g,同时生成KCl的质量为 g。
思路2 反应前物质的总质量=反应后物质的总质量
思路1 参加反应的物质的总质量=反应生成的物质的总质量
氯酸钾的质量(ag)
氯化钾的质量+氧气的质量
氯酸钾 氯化钾+氧气
二氧化锰
加热
=
氯化钾的质量+二氧化锰的质量(bg)
(c-b)g
故氧气的质量=【a-(c-b)】g=(a+b-c)g
氯酸钾的质量(ag)+二氧化锰的质量(bg)
剩余固体的质量(cg)+氧气的质量
=
故氧气的质量=(a+b-c)g
二、计算某一反应物或生成物的质量。
训练3 在A+B=C+D化学反应中,6gA和9gB恰好完全反应,生成14gC和________gD。
参加反应的物质的总质量=反应生成的物质的总质量
6gA+9gB
=
14gC+?gD
1g
训练4 agKClO3和bgMnO2混合加热,完全反应后,可得到cgKCl,则反应中得到氧气的质量为( )A.(a+b-c)g B.(b-c)g C.(a+b+c)g D.(a-c)g
参加反应的物质的总质量=反应生成的物质的总质量
氯化钾的质量(cg)+氧气的质量
=
氯酸钾的质量(ag)
(a-c)g
答案:D
二、计算某一反应物或生成物的质量。
训练5 现将10 gA和足量的B混合加热,A和B发生化学反应。10 gA完全反应后生成8 gC和4 gD,则参加反应的A与B的质量比是 ( )
A.1 :l B.2 :1 C.5 :l D.4 :l
参加反应的物质的总质量=反应生成的物质的总质量
10gA+ gB
=
8gC+4gD
2g
参加反应的A与B的质量比是10g:2g=5:1
答案:C
推断物质的组成
3
三、推断物质的组成
例3 某物质在空气中完全燃烧生成二氧化硫和水,则该物质( )
A.只含有S、H
B.一定含有S,可能含有H、O
C.一定含有S、H元素,可能含有O
D.一定含有S、H、O三种元素
答案:C
化学反应前后元素的种类(定性分析)和质量(定量分析)不变。
三、推断物质的组成
训练6 某物质在加热条件下分解生成二氧化碳、碳酸钠和水,则该物质中 ( )
A.只含有碳、氢、钠三种元素
B.一定含钠、氢、氧三种元素
C.一定含有碳、氢、钠元素,可能含氧元素
D.一定含有碳、氢、钠、氧四种元素
答案:D
训练7 “神舟七号”安全返航,标志着我国载人航天技术取得历史性突破。火箭所用的燃料为偏二甲肼[(CH3)2N2H2],其主要反应为(CH3)2N2H2+N2O4 →X+CO2 +H2O,由此可知X中一定含有的元素是( )
A.碳 B.氢 C.氧 D.氮 训练8 NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )A.CO2 B.Cl2 C.O2 D.N2
三、推断物质的组成
答案:D
答案:A
三、推断物质的组成
例4 将4.6g某化合物在空气中完全燃烧,共得到8.8g二氧化碳和5.4g的水,则该化合物的组成元素是( )
A.一定含有C、H
B.一定含有C、H,可能含有O
C.一定含有C、H、O
D.只含有C
答案:C
8.8gCO2中碳元素的质量=8.8g×(
12
44
=2.4g
×100%)
2.4g+0.6g<4.6g
5.4gH2O中氢元素的质量=5.4g×(
2
18
=0.6g
×100%)
训练9 某化合物完全燃烧,生成8.8g CO2和5.4g水,则此化合物中( )
A. 只含碳、氢两种元素 B.只含碳、氧两种元素
C. 一定含碳、氢、氧三种元素 D.一定含碳、氢元素,可能含氧元素
三、推断物质的组成
8.8gCO2中碳元素的质量=8.8g×(
12
44
=2.4g
×100%)
5.4gH2O中氢元素的质量=5.4g×(
2
18
=0.6g
×100%)
答案:D
三、推断物质的组成
训练10 1.6 g可燃物在足量的氧气中燃烧,生成4.4 g二氧化碳和3.6 g水,则关于可燃物的下列判断,正确的是 ( )
①一定有C、H ②一定不含O ③可能含有O ④一定有O
⑤该物质中C、H的质量比3︰1
A. ①② B. ①②⑤ C. ①③⑤ D. ①④⑤
4.4gCO2中碳元素的质量=4.4g×(
12
44
=1.2g
×100%)
3.6gH2O中氢元素的质量=3.6g×(
2
18
=0.4g
×100%)
1.2g+0.4g=1.6g
答案:B
三、推断物质的组成
训练11 某化合物完全燃烧,需要4.8 g氧气,同时只生成4.4 g二氧化碳和2.7 g 水,则该化合物中( )
A.只含有碳、氢两种元素 B. 只含有碳、氧两种元素
C.含有碳、氢、氧三种元素 D. 无法确定
4.4gCO2中氧元素的质量=4.4g×(
32
44
=3.2g
×100%)
2.7gH2O中氧元素的质量=2.7g×(
16
18
=2.4g
×100%)
3.2g+2.4g>4.8g
答案:C
根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比。
4
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
例5 在一定条件下,甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
物质 甲 乙 丙 丁
反应前的质量/g 1 30 17 2
反应后的质量/g M 31 0 18
关于此反应,下列认识不正确的是( )
A.该反应是分解反应
B.甲肯定是催化剂
C.表中M=1g
D.反应中丙、乙的质量比是17:1
根据反应前物质的总质量=反应后物质的总质量得出1+30+17+2=M+31+0+18,
M=1+30+17+2-(31+0+18)=1
参加反应(反应生成)的物质的质量
0
+1
-17
+16
生成物
生成物
反应物
甲可能是催化剂,可能是没有参加反应。
分解反应
反应中丙、乙的质量比是17:1
答案:B
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
训练12 在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
物质 A B C D
反应前的质量/g 4 6 111 4
反应后的质量/g 待测 15 0 84
则正确的说法是( )
A.反应后,待测A的质量为26g B.该反应的反应物为A和C
C.反应后,生成D的质量为84g D.容器中发生的化学反应,属于化合反应
根据反应前物质的总质量=反应后物质的总质量得出4+6+111+4=待测+15+0+84,
待测=4+6+111+4-(15+0+84)=26
参加反应(反应生成)的物质的质量
+22
+9
-111
+80
生成物
生成物
反应物
分解反应
生成物
答案:A
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
训练13 在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前的质量/g 20 m 20 20
反应后的质量/g 2 待测 32 26
对该反应,下列描述正确的是 ( )
A. 待测质量一定为4 g
B.乙在该反应中一定是催化剂
C. 该反应中甲、丙、丁的质量比为1:16:13
D.该反应是分解反应
根据反应前物质的总质量=反应后物质的总质量得出20+m+20+20=2+待测+32+26,待测=m
参加反应(反应生成)的物质的质量
-18
0
+12
+6
生成物
生成物
反应物
分解反应
答案:D
可能是催化剂
18:12:6=3:2:1
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
训练14 在一密闭容器中有A、B、C、D四种物质,一定条件下使之反应,一段时间后,测得反应前后各物质的质量如下:
物质 A B C D
反应前物质质量/g 90 10 8 2
反应后物质质量/ g X 59.25 29.75 12
下列说法正确的是( )
A.参加反应的A的质量为9g
B. 该反应是化合反应
C.反应中A和D质量的变化之比为79:12
D. A一定是化合物
根据反应前物质的总质量=反应后物质的总质量得出90+10+8+2=X+59.25
+29.75+12,X=9
参加反应(反应生成)的物质的质量
-81
49.25
+21.25
+10
生成物
生成物
反应物
分解反应
答案:D
81:10
生成物
81g
分解反应
微观角度认识质量守恒
5
五、微观角度认识质量守恒
例6 如下图所示:2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )
+
→
+ 3乙
表示A原子
甲
甲
丙
表示B原子
A.反应生成的丙物质属于单质
B.根据质量守恒定律可推知,1个乙分子中含有2个A原子
C.该反应中原子的种类发生了改变
D.参加反应的甲物质属于化合物
化学反应前后原子的种类和数目相同。
答案:C
五、微观角度认识质量守恒
训练15 下图为某化学反应的微观过程,其中“ ”和“ ”表示两种不同原子。
(1)该反应属于 反应(填基本反应类型)。
(2)虚线框内应填的微观图示是 (选填A、B、C、D),你推断的依据是 。
+
→
+
+
A. B. C. D.
分解
D
化学反应前后原子的种类和数目相同
五、微观角度认识质量守恒
训练16 如图是某化学反应的微观示意图,其中不同的圆球代表不同原子。下列说法中正确的是( )
催化剂
反应前
反应后
A.该反应涉及到四种原子
B.该反应属于分解反应
C.参加反应的两种分子的个数比为1∶1
D.该反应前后所有元素的化合价都没有变化
三种
既不是化合反应,也不是分解反应
答案:C
变化
推断物质的化学式
6
六、推断物质的化学式
例7 某发电厂烟气处理的新工艺:CH4十2NO2= N2+X+2H2O,则X的化学式为( )A. CO B.CO2 C. O2 D. C
CH4十2NO2= N2+X+2H2O
化学反应前后原子的种类和数目相同。
C
H
N
O
1个
4个
2个
4个
2个
4个
2个
1个X分子中1个碳原子和2个氧原子
X的化学式为CO2
答案:B
C
H
N
O
六、推断物质的化学式
训练17 黄铁矿在一定条件下发生如下反应:4FeS2+11O2 =2X +8SO2,推断X的化学式是( )
A. Fe2O3 B. FeO C.Fe3O4 D. Fe
4FeS2+11O2 =2X +8SO2
化学反应前后原子的种类和数目相同。
Fe
S
O
4个
8个
22个
8个
16个
2个X分子中4个铁原子和6个氧原子
X的化学式为Fe2O3
答案:C
Fe
S
O
六、推断物质的化学式
训练18 葡萄糖在人体组织中缓慢氧化放出热量,供给人体所需能量,这是人类生命活动所需能量的重要来源之一。若R代表葡萄糖,所发生的氧化反应为:R+6O2=6CO2+6H2O,则葡萄糖的化学式为( )
A、C6H12 B、C6H12O6 C、C6H10O5 D、C5H6O2
R+6O2=6CO2+6H2O
化学反应前后原子的种类和数目相同。
C
O
H
12个
6个
12个
1个R分子中6个碳原子、12个氢原子和6个氧原子
R的化学式为C6H12O6
答案:B
C
O
H
18个
六、推断物质的化学式
训练19 某物质X在空气中燃烧,:2X + 5O2 = 4CO2 + 2H2O,则X的化学式是( )
A.CH4 B.C2H4 C.C2H2 D.C2H6
答案:C
训练20 在化学反应2X2+3Y2=2R中,若用X、Y表示R的化学式,则正确的是( )
A、X2 Y2 B、X2 Y3 C、X4Y5 D、X3 Y2
答案:B
训练21 2008年奥运会“祥云”火炬中燃料燃烧后不会对环境造成污染,体现了“绿色奥运”的理念。反应的化学方程式为C3H8+xO2= 3CO2+4H2O,则x的数值是 ( )
A. 1 B.2 C. 3 D .5
答案:D
质量守恒定律的应用
1.什么是质量守恒定律?
温
故
知
新
参加化学反应的各物质的质量总和等于反应生成的各物质的质量总和。
1.什么是质量守恒定律?
参加化学反应的各物质的质量总和,等于反应生成的各物质的质量总和。
适用范围
研究的量
研究对象
各物质
总质量
适用于所有的化学变化,不适用于物理变化
是质量的守恒,不包括体积等其他方面的守恒
“参加化学反应”的物质,即实际反应掉的那一部分物质,没有参加反应的物质不计算在内
指所有参与反应的反应物和生成物,包括固态、液态、气态的所有物质
指物质的总质量守恒,而非某一种或几种物质的质量守恒
温
故
知
新
2.为什么质量守恒?
温
故
知
新
化学反应的实质是参加反应的各物质(反应物)原子重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示如下:
分子
原子
新分子
新物质
分裂
重新组合
聚集
2.为什么质量守恒?
温
故
知
新
元素的种类
元素的质量
物质的总质量
原子的种类
原子的质量
原子的数目
物质的种类
分子的种类
元素的化合价
分子的总数
不
变
改变
可能改变
宏观
微观
化学变化中的“变”与“不变”
解释化学变化中质量变化的现象
1
一、解释化学变化中质量变化的现象
例1.下列现象不能用质量守恒定律解释的是( )。
A.水结冰前后质量保持不变
B.5g蔗糖溶于95g水中,总质量为100g。
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g的水。
D.1.2g的碳和3.2g氧气恰好完全反应可生成4.4g二氧化碳。
质量守恒定律只适用于化学变化。
答案:D
一、解释化学变化中质量变化的现象
训练1 下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.5 g蔗糖溶于95 g水中,总质量为100 g
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g水
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
答案:D
一、解释化学变化中质量变化的现象
训练2 下列说法中,不能用质量守恒定律解释的是 ( )
A.蜡烛完全燃烧后,生成水和二氧化碳质量之和等于蜡烛的质量和参加反应的氧气的质量总和
B.镁带在空气中燃烧后,生成物的质量比镁带的质量增加了
C.高锰酸钾受热分解后,剩余固体的质量与反应物相比较质量减轻了
D. 50g的纸张用粉碎机粉碎后还是50g
答案:A
计算某一反应物或生成物的质量
2
二、计算某一反应物或生成物的质量。
例2 将agKClO3和bgMnO2混合加热到质量不再减少,得到剩余固体的质量为cg,该反应生成O2的质量 g,同时生成KCl的质量为 g。
思路2 反应前物质的总质量=反应后物质的总质量
思路1 参加反应的物质的总质量=反应生成的物质的总质量
氯酸钾的质量(ag)
氯化钾的质量+氧气的质量
氯酸钾 氯化钾+氧气
二氧化锰
加热
=
氯化钾的质量+二氧化锰的质量(bg)
(c-b)g
故氧气的质量=【a-(c-b)】g=(a+b-c)g
氯酸钾的质量(ag)+二氧化锰的质量(bg)
剩余固体的质量(cg)+氧气的质量
=
故氧气的质量=(a+b-c)g
二、计算某一反应物或生成物的质量。
训练3 在A+B=C+D化学反应中,6gA和9gB恰好完全反应,生成14gC和________gD。
参加反应的物质的总质量=反应生成的物质的总质量
6gA+9gB
=
14gC+?gD
1g
训练4 agKClO3和bgMnO2混合加热,完全反应后,可得到cgKCl,则反应中得到氧气的质量为( )A.(a+b-c)g B.(b-c)g C.(a+b+c)g D.(a-c)g
参加反应的物质的总质量=反应生成的物质的总质量
氯化钾的质量(cg)+氧气的质量
=
氯酸钾的质量(ag)
(a-c)g
答案:D
二、计算某一反应物或生成物的质量。
训练5 现将10 gA和足量的B混合加热,A和B发生化学反应。10 gA完全反应后生成8 gC和4 gD,则参加反应的A与B的质量比是 ( )
A.1 :l B.2 :1 C.5 :l D.4 :l
参加反应的物质的总质量=反应生成的物质的总质量
10gA+ gB
=
8gC+4gD
2g
参加反应的A与B的质量比是10g:2g=5:1
答案:C
推断物质的组成
3
三、推断物质的组成
例3 某物质在空气中完全燃烧生成二氧化硫和水,则该物质( )
A.只含有S、H
B.一定含有S,可能含有H、O
C.一定含有S、H元素,可能含有O
D.一定含有S、H、O三种元素
答案:C
化学反应前后元素的种类(定性分析)和质量(定量分析)不变。
三、推断物质的组成
训练6 某物质在加热条件下分解生成二氧化碳、碳酸钠和水,则该物质中 ( )
A.只含有碳、氢、钠三种元素
B.一定含钠、氢、氧三种元素
C.一定含有碳、氢、钠元素,可能含氧元素
D.一定含有碳、氢、钠、氧四种元素
答案:D
训练7 “神舟七号”安全返航,标志着我国载人航天技术取得历史性突破。火箭所用的燃料为偏二甲肼[(CH3)2N2H2],其主要反应为(CH3)2N2H2+N2O4 →X+CO2 +H2O,由此可知X中一定含有的元素是( )
A.碳 B.氢 C.氧 D.氮 训练8 NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )A.CO2 B.Cl2 C.O2 D.N2
三、推断物质的组成
答案:D
答案:A
三、推断物质的组成
例4 将4.6g某化合物在空气中完全燃烧,共得到8.8g二氧化碳和5.4g的水,则该化合物的组成元素是( )
A.一定含有C、H
B.一定含有C、H,可能含有O
C.一定含有C、H、O
D.只含有C
答案:C
8.8gCO2中碳元素的质量=8.8g×(
12
44
=2.4g
×100%)
2.4g+0.6g<4.6g
5.4gH2O中氢元素的质量=5.4g×(
2
18
=0.6g
×100%)
训练9 某化合物完全燃烧,生成8.8g CO2和5.4g水,则此化合物中( )
A. 只含碳、氢两种元素 B.只含碳、氧两种元素
C. 一定含碳、氢、氧三种元素 D.一定含碳、氢元素,可能含氧元素
三、推断物质的组成
8.8gCO2中碳元素的质量=8.8g×(
12
44
=2.4g
×100%)
5.4gH2O中氢元素的质量=5.4g×(
2
18
=0.6g
×100%)
答案:D
三、推断物质的组成
训练10 1.6 g可燃物在足量的氧气中燃烧,生成4.4 g二氧化碳和3.6 g水,则关于可燃物的下列判断,正确的是 ( )
①一定有C、H ②一定不含O ③可能含有O ④一定有O
⑤该物质中C、H的质量比3︰1
A. ①② B. ①②⑤ C. ①③⑤ D. ①④⑤
4.4gCO2中碳元素的质量=4.4g×(
12
44
=1.2g
×100%)
3.6gH2O中氢元素的质量=3.6g×(
2
18
=0.4g
×100%)
1.2g+0.4g=1.6g
答案:B
三、推断物质的组成
训练11 某化合物完全燃烧,需要4.8 g氧气,同时只生成4.4 g二氧化碳和2.7 g 水,则该化合物中( )
A.只含有碳、氢两种元素 B. 只含有碳、氧两种元素
C.含有碳、氢、氧三种元素 D. 无法确定
4.4gCO2中氧元素的质量=4.4g×(
32
44
=3.2g
×100%)
2.7gH2O中氧元素的质量=2.7g×(
16
18
=2.4g
×100%)
3.2g+2.4g>4.8g
答案:C
根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比。
4
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
例5 在一定条件下,甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
物质 甲 乙 丙 丁
反应前的质量/g 1 30 17 2
反应后的质量/g M 31 0 18
关于此反应,下列认识不正确的是( )
A.该反应是分解反应
B.甲肯定是催化剂
C.表中M=1g
D.反应中丙、乙的质量比是17:1
根据反应前物质的总质量=反应后物质的总质量得出1+30+17+2=M+31+0+18,
M=1+30+17+2-(31+0+18)=1
参加反应(反应生成)的物质的质量
0
+1
-17
+16
生成物
生成物
反应物
甲可能是催化剂,可能是没有参加反应。
分解反应
反应中丙、乙的质量比是17:1
答案:B
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
训练12 在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
物质 A B C D
反应前的质量/g 4 6 111 4
反应后的质量/g 待测 15 0 84
则正确的说法是( )
A.反应后,待测A的质量为26g B.该反应的反应物为A和C
C.反应后,生成D的质量为84g D.容器中发生的化学反应,属于化合反应
根据反应前物质的总质量=反应后物质的总质量得出4+6+111+4=待测+15+0+84,
待测=4+6+111+4-(15+0+84)=26
参加反应(反应生成)的物质的质量
+22
+9
-111
+80
生成物
生成物
反应物
分解反应
生成物
答案:A
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
训练13 在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前的质量/g 20 m 20 20
反应后的质量/g 2 待测 32 26
对该反应,下列描述正确的是 ( )
A. 待测质量一定为4 g
B.乙在该反应中一定是催化剂
C. 该反应中甲、丙、丁的质量比为1:16:13
D.该反应是分解反应
根据反应前物质的总质量=反应后物质的总质量得出20+m+20+20=2+待测+32+26,待测=m
参加反应(反应生成)的物质的质量
-18
0
+12
+6
生成物
生成物
反应物
分解反应
答案:D
可能是催化剂
18:12:6=3:2:1
四、根据质量守恒定律判断反应物、生成物、反应类型以及反应中物质的质量比
训练14 在一密闭容器中有A、B、C、D四种物质,一定条件下使之反应,一段时间后,测得反应前后各物质的质量如下:
物质 A B C D
反应前物质质量/g 90 10 8 2
反应后物质质量/ g X 59.25 29.75 12
下列说法正确的是( )
A.参加反应的A的质量为9g
B. 该反应是化合反应
C.反应中A和D质量的变化之比为79:12
D. A一定是化合物
根据反应前物质的总质量=反应后物质的总质量得出90+10+8+2=X+59.25
+29.75+12,X=9
参加反应(反应生成)的物质的质量
-81
49.25
+21.25
+10
生成物
生成物
反应物
分解反应
答案:D
81:10
生成物
81g
分解反应
微观角度认识质量守恒
5
五、微观角度认识质量守恒
例6 如下图所示:2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )
+
→
+ 3乙
表示A原子
甲
甲
丙
表示B原子
A.反应生成的丙物质属于单质
B.根据质量守恒定律可推知,1个乙分子中含有2个A原子
C.该反应中原子的种类发生了改变
D.参加反应的甲物质属于化合物
化学反应前后原子的种类和数目相同。
答案:C
五、微观角度认识质量守恒
训练15 下图为某化学反应的微观过程,其中“ ”和“ ”表示两种不同原子。
(1)该反应属于 反应(填基本反应类型)。
(2)虚线框内应填的微观图示是 (选填A、B、C、D),你推断的依据是 。
+
→
+
+
A. B. C. D.
分解
D
化学反应前后原子的种类和数目相同
五、微观角度认识质量守恒
训练16 如图是某化学反应的微观示意图,其中不同的圆球代表不同原子。下列说法中正确的是( )
催化剂
反应前
反应后
A.该反应涉及到四种原子
B.该反应属于分解反应
C.参加反应的两种分子的个数比为1∶1
D.该反应前后所有元素的化合价都没有变化
三种
既不是化合反应,也不是分解反应
答案:C
变化
推断物质的化学式
6
六、推断物质的化学式
例7 某发电厂烟气处理的新工艺:CH4十2NO2= N2+X+2H2O,则X的化学式为( )A. CO B.CO2 C. O2 D. C
CH4十2NO2= N2+X+2H2O
化学反应前后原子的种类和数目相同。
C
H
N
O
1个
4个
2个
4个
2个
4个
2个
1个X分子中1个碳原子和2个氧原子
X的化学式为CO2
答案:B
C
H
N
O
六、推断物质的化学式
训练17 黄铁矿在一定条件下发生如下反应:4FeS2+11O2 =2X +8SO2,推断X的化学式是( )
A. Fe2O3 B. FeO C.Fe3O4 D. Fe
4FeS2+11O2 =2X +8SO2
化学反应前后原子的种类和数目相同。
Fe
S
O
4个
8个
22个
8个
16个
2个X分子中4个铁原子和6个氧原子
X的化学式为Fe2O3
答案:C
Fe
S
O
六、推断物质的化学式
训练18 葡萄糖在人体组织中缓慢氧化放出热量,供给人体所需能量,这是人类生命活动所需能量的重要来源之一。若R代表葡萄糖,所发生的氧化反应为:R+6O2=6CO2+6H2O,则葡萄糖的化学式为( )
A、C6H12 B、C6H12O6 C、C6H10O5 D、C5H6O2
R+6O2=6CO2+6H2O
化学反应前后原子的种类和数目相同。
C
O
H
12个
6个
12个
1个R分子中6个碳原子、12个氢原子和6个氧原子
R的化学式为C6H12O6
答案:B
C
O
H
18个
六、推断物质的化学式
训练19 某物质X在空气中燃烧,:2X + 5O2 = 4CO2 + 2H2O,则X的化学式是( )
A.CH4 B.C2H4 C.C2H2 D.C2H6
答案:C
训练20 在化学反应2X2+3Y2=2R中,若用X、Y表示R的化学式,则正确的是( )
A、X2 Y2 B、X2 Y3 C、X4Y5 D、X3 Y2
答案:B
训练21 2008年奥运会“祥云”火炬中燃料燃烧后不会对环境造成污染,体现了“绿色奥运”的理念。反应的化学方程式为C3H8+xO2= 3CO2+4H2O,则x的数值是 ( )
A. 1 B.2 C. 3 D .5
答案:D
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
