2022-2023学年高一上学期化学人教版必修1第二章第三节氧化还原反应课件(26张ppt)
文档属性
| 名称 | 2022-2023学年高一上学期化学人教版必修1第二章第三节氧化还原反应课件(26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 408.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-17 17:58:23 | ||
图片预览








文档简介
(共26张PPT)
第三节 氧化还原反应
(1)C + O2 == CO2
(2)2H2O2 == 2H2O + O2↑
(3) H2 + CuO == Cu + H2O
(4)2NaOH + H2SO4 == Na2SO4 + 2H2O
点燃
MnO2
△
思考:指出下列反应各属于何种类型?
化合反应、氧化反应
分解反应
置换反应、还原反应
复分解反应
失去氧,被还原(还原反应)
得到氧,被氧化(氧化反应)
Cu
O
H
H
H
H
Cu
O
H2 + CuO == Cu + H2O
△
还原反应和氧化反应是同时发生的,这样的反应称为氧化还原反应。
一、氧化还原反应
思考:分析下列氧化还原反应中各种元素的化合价在反应前后有无变化?
2CuO + C == 2Cu + CO2↑
H2O + C == H2 + CO
CuO + H2 == Cu + H2O
+2 0 0 +4
+1 0 0 +2
+2 0 0 +1
高温
高温
△
在氧化还原反应中,某些元素的化合价在反应前后发生了变化。
一、氧化还原反应
1.氧化还原反应特征:元素化合价发生了变化
(判断依据)
氧化剂
失氧,被还原(还原反应)
得氧,被氧化(氧化反应)
H2 + CuO == Cu + H2O
△
0 +2 0 +1
化合价升高,被氧化
化合价降低,被还原
思考:氧化还原反应中,为什么元素化合价在反应前后发生改变呢?
还原剂
还原产物
氧化产物
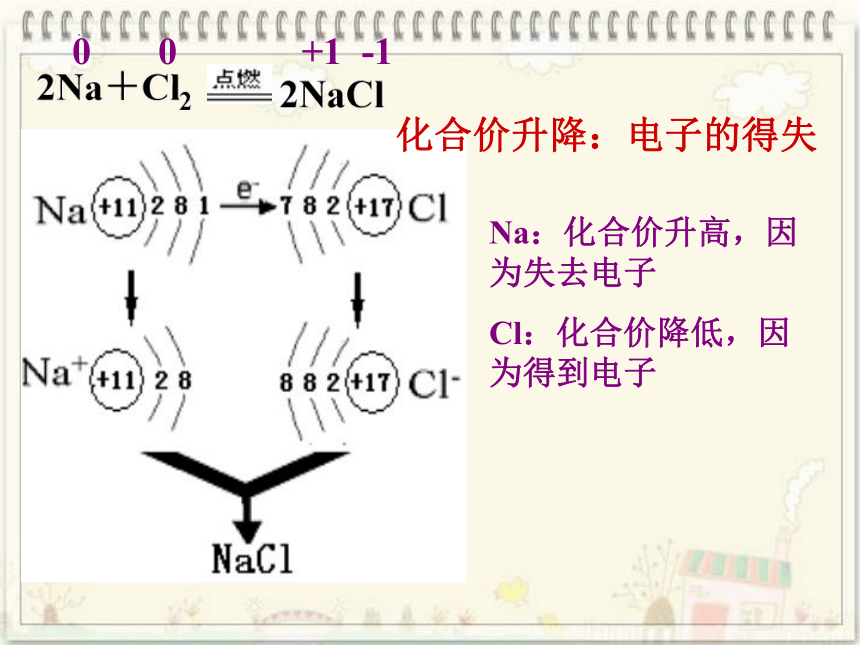
从微观的角度(原子结构)分析下面的这两个反应化合价升降的原因:
2NaCl
2Na+Cl2
H2+Cl2
2HCl
0 0 +1 -1
0 0 +1 -1
2NaCl
2Na+Cl2
Na:化合价升高,因为失去电子
Cl:化合价降低,因为得到电子
0 0 +1 -1
化合价升降:电子的得失
H2+Cl2
2HCl
0 0 +1 -1
H:化合价升高,因为共用电子对偏离
Cl:化合价降低,因为共用电子对偏向
化合价升降:电子对的偏移
一、氧化还原反应
2.氧化还原反应实质:电子转移(得失或偏移)
1.氧化还原反应特征:元素化合价发生了变化
(判断依据)
2NaCl
2Na + Cl2
0 0 +1 -1
失去电子,化合价升高,被氧化
得到电子,化合价降低,被还原
氧化剂
还原剂
还原产物,氧化产物
一、氧化还原反应
2.氧化还原反应实质:电子转移(得失或偏移)
3.判断方法:升失氧,降得还,若说剂,正相反
1.氧化还原反应特征:元素化合价发生了变化
(判断依据)
练习
1.下列反应不属于氧化还原反应的是( )
A.2KMnO4 K2MnO4+MnO2+O2↑
B.2Fe(OH)3 Fe2O3+3H2O
C.CaO+H2O=Ca(OH)2
D.C+H2O(气) CO+H2
BC
几种基本类型反应与氧化还原反应的关系
有单质参加的化合反应
有单质生成的分解反应
2. 下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应D.氧化反应和还原反应是同时发生的
3.氧化还原反应的实质是 ( )
A.化合价的升降 B.分子中各原子重新组合
C.电子的得失或偏移 D.氧原子的得失
D
C
4.实现:
Fe2+ → Fe3+的转化,需要加入 剂
HNO3 → NO的转化,需要加入 剂
5.下列粒子:Fe、Fe2+、Fe3+
只具有还原性的是 ,
只具有氧化性的是 ,
既有氧化性又有还原性的是 。
氧化
还原
Fe
Fe2+
Fe3+
元素化合价降低, 电子,被 , 是氧化剂
Zn + H2SO4 == ZnSO4 + H2↑
元素化合价升高, 电子,被 , 是还原剂
Zn
H
失去
得到
氧化
还原
Zn
H2SO4
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
元素化合价降低, 电子,被 , 是氧化剂, 是还原剂,氧化产物是 ,还原产物是 。
Mn
得到
还原
MnO2
HCl
MnCl2
Cl2
二、氧化还原反应的几种常见情况
1.反应发生在不同物质的不同元素之间
2KClO3 === 2KCl + 3O2↑
MnO2
△
元素化合价升高, 电子,被 ,
是还原剂, 元素化合价降低, 电子,被 , 是氧化剂。
电子转移总数是 。
2H2O === 2H2↑ + O2↑
通电
2.反应发生在同一物质的不同元素之间
O
失
氧化
KClO3
KClO3
Cl
得
还原
12
2KMnO4 === K2MnO4 + MnO2 + O2↑
△
是还原剂, 是氧化剂,
是氧化产物, 是还原产物。
KMnO4
KMnO4
K2MnO4
和MnO2
O2
2KNO3+S+3C==K2S+N2+3CO2
元素化合价降低, 电子,被 , 是
氧化剂, 是还原剂,氧化产物是 ,还原产物
是 。
还原剂和氧化剂的物质的量之比是 。
Cl2 + 2NaOH == NaCl + NaClO + H2O
2NO2 + 2NaOH == NaNO3 + NaNO2 + H2O
3.反应发生在同一物质的同一元素之间
Cl
NaCl
还原
得
Cl2
Cl2
NaClO
1:1
4.反应发生在不同物质的同一元素之间
2H2S + SO2== 3S + 2H2O
元素化合价降低, 电子,被 , 是
氧化剂, 是还原剂,氧化产物是 ,还原产物
是 。
氧化产物和还原产物的质量比是 。
2FeCl3 + Fe == 3FeCl2
5. …………
S
得
还原
SO2
H2S
S
S
2:1
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
元素化合价降低, 电子,被 , 是氧化剂, 是还原剂,氧化产物是 ,还原产物是 。
Mn
得到
还原
MnO2
HCl
MnCl2
Cl2
n(氧化剂):n(还原剂)=___________
电子转移总数是_______________。
1:2
2
3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
已知铜和浓硫酸的反应是:Cu+2H2SO4==CuSO4+SO2↑+2H2O
若有6.4g铜参加反应,计算:
(1)参加反应的H2SO4是多少克?
(2)被还原的H2SO4是多少克?
(3)转移电子多少mol?
(4)生成标准状况下SO2多少升?
根据离子方程式:①2Fe3+ + 2I— == 2Fe2+ + I2 ②2Fe2+ + Br2 == 2Fe3+ + 2Br—,可判断离子的还原性从强到弱的顺序是( )
A. Br—﹥Fe2+﹥I— B. I—﹥Fe2+ ﹥Br—
C. Br—﹥I—﹥Fe2+ D. Fe2+ ﹥I—﹥Br—
B
氧化性:氧化剂﹥氧化产物
还原性:还原剂﹥还原产物
有A.B.C.D四种物质,已知它们能发生下列变化:①A2+ + B == B2+ + A ②A2+ + C ==C2+ +A
③B2+ + C == C2+ +B ④C2+ +D == D2+ + C
由此推知,各物质的氧化性、还原性强弱顺序正确的是( )
氧化性:A2+﹥B2+﹥C2+ ﹥D2+
B. 氧化性:D2+﹥C2+﹥B2+﹥A2+
C. 还原性:A﹥B ﹥C ﹥D
D. 还原性:D ﹥C﹥B ﹥A
AD
第三节 氧化还原反应
(1)C + O2 == CO2
(2)2H2O2 == 2H2O + O2↑
(3) H2 + CuO == Cu + H2O
(4)2NaOH + H2SO4 == Na2SO4 + 2H2O
点燃
MnO2
△
思考:指出下列反应各属于何种类型?
化合反应、氧化反应
分解反应
置换反应、还原反应
复分解反应
失去氧,被还原(还原反应)
得到氧,被氧化(氧化反应)
Cu
O
H
H
H
H
Cu
O
H2 + CuO == Cu + H2O
△
还原反应和氧化反应是同时发生的,这样的反应称为氧化还原反应。
一、氧化还原反应
思考:分析下列氧化还原反应中各种元素的化合价在反应前后有无变化?
2CuO + C == 2Cu + CO2↑
H2O + C == H2 + CO
CuO + H2 == Cu + H2O
+2 0 0 +4
+1 0 0 +2
+2 0 0 +1
高温
高温
△
在氧化还原反应中,某些元素的化合价在反应前后发生了变化。
一、氧化还原反应
1.氧化还原反应特征:元素化合价发生了变化
(判断依据)
氧化剂
失氧,被还原(还原反应)
得氧,被氧化(氧化反应)
H2 + CuO == Cu + H2O
△
0 +2 0 +1
化合价升高,被氧化
化合价降低,被还原
思考:氧化还原反应中,为什么元素化合价在反应前后发生改变呢?
还原剂
还原产物
氧化产物
从微观的角度(原子结构)分析下面的这两个反应化合价升降的原因:
2NaCl
2Na+Cl2
H2+Cl2
2HCl
0 0 +1 -1
0 0 +1 -1
2NaCl
2Na+Cl2
Na:化合价升高,因为失去电子
Cl:化合价降低,因为得到电子
0 0 +1 -1
化合价升降:电子的得失
H2+Cl2
2HCl
0 0 +1 -1
H:化合价升高,因为共用电子对偏离
Cl:化合价降低,因为共用电子对偏向
化合价升降:电子对的偏移
一、氧化还原反应
2.氧化还原反应实质:电子转移(得失或偏移)
1.氧化还原反应特征:元素化合价发生了变化
(判断依据)
2NaCl
2Na + Cl2
0 0 +1 -1
失去电子,化合价升高,被氧化
得到电子,化合价降低,被还原
氧化剂
还原剂
还原产物,氧化产物
一、氧化还原反应
2.氧化还原反应实质:电子转移(得失或偏移)
3.判断方法:升失氧,降得还,若说剂,正相反
1.氧化还原反应特征:元素化合价发生了变化
(判断依据)
练习
1.下列反应不属于氧化还原反应的是( )
A.2KMnO4 K2MnO4+MnO2+O2↑
B.2Fe(OH)3 Fe2O3+3H2O
C.CaO+H2O=Ca(OH)2
D.C+H2O(气) CO+H2
BC
几种基本类型反应与氧化还原反应的关系
有单质参加的化合反应
有单质生成的分解反应
2. 下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应D.氧化反应和还原反应是同时发生的
3.氧化还原反应的实质是 ( )
A.化合价的升降 B.分子中各原子重新组合
C.电子的得失或偏移 D.氧原子的得失
D
C
4.实现:
Fe2+ → Fe3+的转化,需要加入 剂
HNO3 → NO的转化,需要加入 剂
5.下列粒子:Fe、Fe2+、Fe3+
只具有还原性的是 ,
只具有氧化性的是 ,
既有氧化性又有还原性的是 。
氧化
还原
Fe
Fe2+
Fe3+
元素化合价降低, 电子,被 , 是氧化剂
Zn + H2SO4 == ZnSO4 + H2↑
元素化合价升高, 电子,被 , 是还原剂
Zn
H
失去
得到
氧化
还原
Zn
H2SO4
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
元素化合价降低, 电子,被 , 是氧化剂, 是还原剂,氧化产物是 ,还原产物是 。
Mn
得到
还原
MnO2
HCl
MnCl2
Cl2
二、氧化还原反应的几种常见情况
1.反应发生在不同物质的不同元素之间
2KClO3 === 2KCl + 3O2↑
MnO2
△
元素化合价升高, 电子,被 ,
是还原剂, 元素化合价降低, 电子,被 , 是氧化剂。
电子转移总数是 。
2H2O === 2H2↑ + O2↑
通电
2.反应发生在同一物质的不同元素之间
O
失
氧化
KClO3
KClO3
Cl
得
还原
12
2KMnO4 === K2MnO4 + MnO2 + O2↑
△
是还原剂, 是氧化剂,
是氧化产物, 是还原产物。
KMnO4
KMnO4
K2MnO4
和MnO2
O2
2KNO3+S+3C==K2S+N2+3CO2
元素化合价降低, 电子,被 , 是
氧化剂, 是还原剂,氧化产物是 ,还原产物
是 。
还原剂和氧化剂的物质的量之比是 。
Cl2 + 2NaOH == NaCl + NaClO + H2O
2NO2 + 2NaOH == NaNO3 + NaNO2 + H2O
3.反应发生在同一物质的同一元素之间
Cl
NaCl
还原
得
Cl2
Cl2
NaClO
1:1
4.反应发生在不同物质的同一元素之间
2H2S + SO2== 3S + 2H2O
元素化合价降低, 电子,被 , 是
氧化剂, 是还原剂,氧化产物是 ,还原产物
是 。
氧化产物和还原产物的质量比是 。
2FeCl3 + Fe == 3FeCl2
5. …………
S
得
还原
SO2
H2S
S
S
2:1
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
元素化合价降低, 电子,被 , 是氧化剂, 是还原剂,氧化产物是 ,还原产物是 。
Mn
得到
还原
MnO2
HCl
MnCl2
Cl2
n(氧化剂):n(还原剂)=___________
电子转移总数是_______________。
1:2
2
3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
已知铜和浓硫酸的反应是:Cu+2H2SO4==CuSO4+SO2↑+2H2O
若有6.4g铜参加反应,计算:
(1)参加反应的H2SO4是多少克?
(2)被还原的H2SO4是多少克?
(3)转移电子多少mol?
(4)生成标准状况下SO2多少升?
根据离子方程式:①2Fe3+ + 2I— == 2Fe2+ + I2 ②2Fe2+ + Br2 == 2Fe3+ + 2Br—,可判断离子的还原性从强到弱的顺序是( )
A. Br—﹥Fe2+﹥I— B. I—﹥Fe2+ ﹥Br—
C. Br—﹥I—﹥Fe2+ D. Fe2+ ﹥I—﹥Br—
B
氧化性:氧化剂﹥氧化产物
还原性:还原剂﹥还原产物
有A.B.C.D四种物质,已知它们能发生下列变化:①A2+ + B == B2+ + A ②A2+ + C ==C2+ +A
③B2+ + C == C2+ +B ④C2+ +D == D2+ + C
由此推知,各物质的氧化性、还原性强弱顺序正确的是( )
氧化性:A2+﹥B2+﹥C2+ ﹥D2+
B. 氧化性:D2+﹥C2+﹥B2+﹥A2+
C. 还原性:A﹥B ﹥C ﹥D
D. 还原性:D ﹥C﹥B ﹥A
AD
