2022-2023学年高二上学期化学人教版(2019)选择性必修1-3.3.2水解平衡的影响因素 课件 (26张ppt)
文档属性
| 名称 | 2022-2023学年高二上学期化学人教版(2019)选择性必修1-3.3.2水解平衡的影响因素 课件 (26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 49.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-17 17:59:14 | ||
图片预览




文档简介
第2课时
影响盐类水解的主要因素
1、能通过实验探究温度、浓度对盐类水解平衡的影响。
2、认识影响盐类水解平衡的主要因素,并能解释反应条件影响盐类水解平衡的因素。
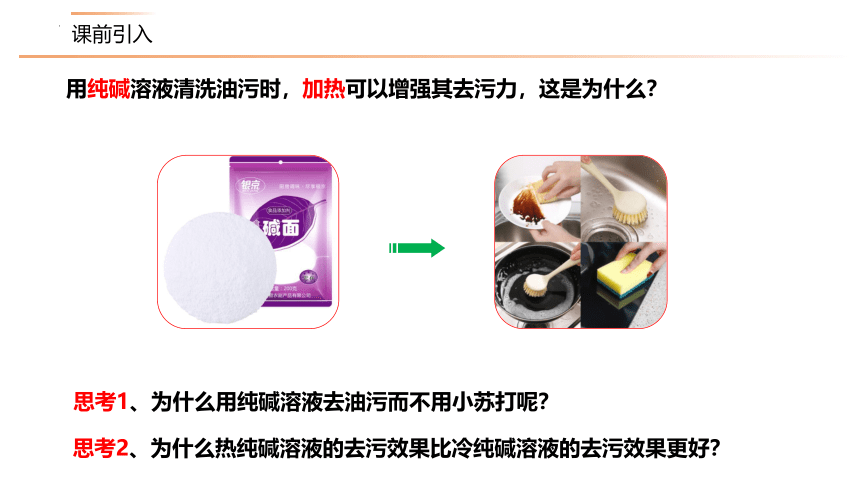
思考1、为什么用纯碱溶液去油污而不用小苏打呢?
思考2、为什么热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
用纯碱溶液清洗油污时,加热可以增强其去污力,这是为什么?
2、研究盐类水解时,一般从两个方面考虑:一是反应物的性质,二是反应条件。
影响盐类水解平衡的因素
1、盐类水解平衡有什么特点?
可逆、微弱、吸热
影响盐类水解
平衡的因素
一、本身性质
二、外界条件:温度、浓度等
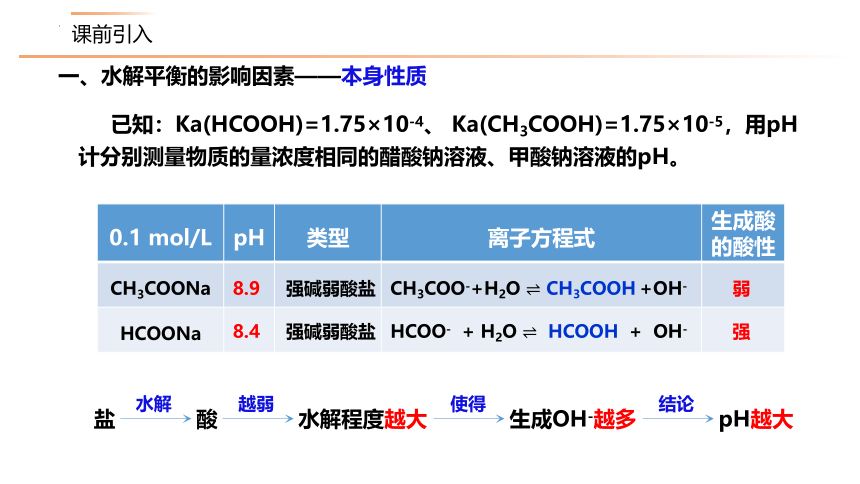
一、水解平衡的影响因素——本身性质
已知:Ka(HCOOH)=1.75×10-4、 Ka(CH3COOH)=1.75×10-5,用pH计分别测量物质的量浓度相同的醋酸钠溶液、甲酸钠溶液的pH。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}0.1 mol/L
pH
类型
离子方程式
生成酸
的酸性
CH3COONa
HCOONa
强碱弱酸盐
强碱弱酸盐
8.9
8.4
CH3COO-+H2O ? CH3COOH +OH-
?
HCOO- + H2O ? HCOOH + OH-
?
弱
强
盐
水解
酸
越弱
pH越大
结论
生成OH-越多
水解程度越大
使得
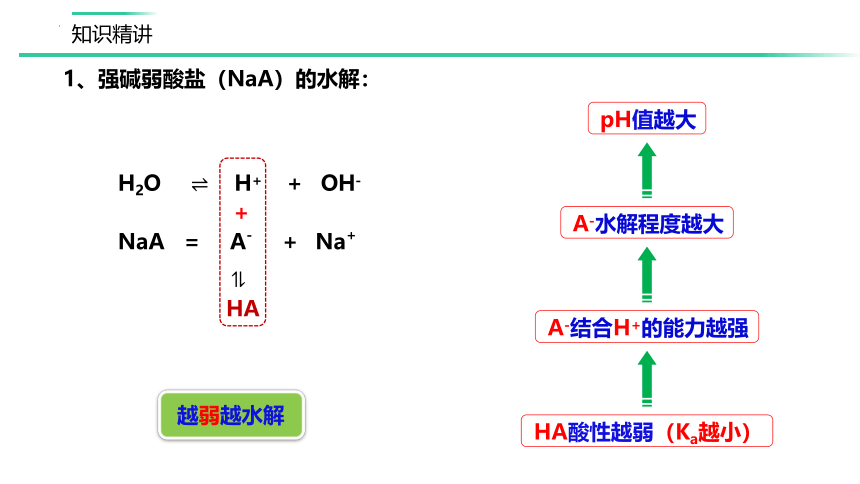
H2O ?? H+ + OH-
?
NaA = A- + Na+
A-结合H+的能力越强
HA酸性越弱(Ka越小)
A-水解程度越大
1、强碱弱酸盐(NaA)的水解:
HA
?
?
+
pH值越大
越弱越水解
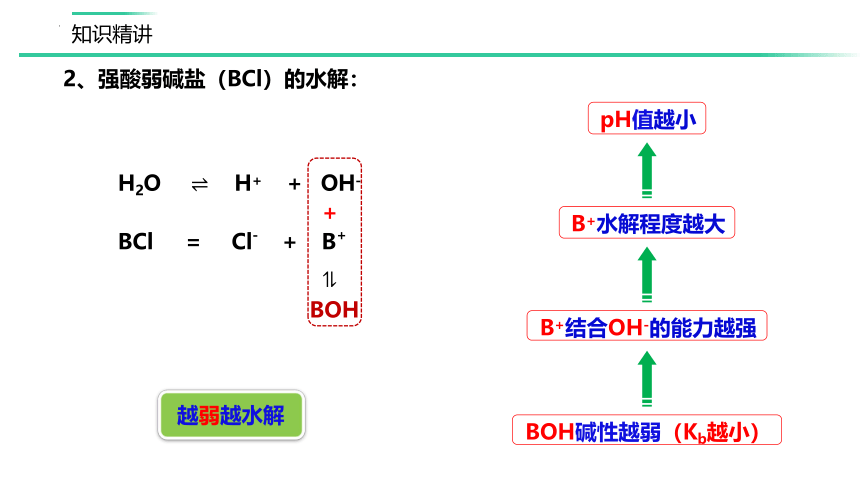
H2O ?? H+ + OH-
?
BCl = Cl- + B+
BOH
?
?
+
2、强酸弱碱盐(BCl)的水解:
B+结合OH-的能力越强
BOH碱性越弱(Kb越小)
B+水解程度越大
pH值越小
越弱越水解
例1、请同学们预测相同浓度的Na2CO3溶液与Na2SiO3溶液的pH大小,并说明理由。
例2、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
B
思考与讨论
1、FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
呈酸性
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
2、FeCl3水解反应是吸热还是放热?
酸 + 碱 ?? 盐 + 水
?
中和
水解
吸热
3、根据勒夏特列原理,升高温度,FeCl3水解平衡反应向什么方向移动?
正向移动
谁强显谁性
二、水解平衡的影响因素——外界条件
1、温度
预测现象:
实验原理:
烧杯、三角架、pH计、酒精灯、火柴、0.01 mol/L FeCl3溶液
实验用品:
Fe3+ + 3H2O ? Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
越热越水解
预测结论:
温度升高,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
增大
实验探究1:温度对FeCl3水解平衡的影响
二、水解平衡的影响因素——外界条件
2、增大反应物浓度
预测现象:
实验原理:
量筒、试管、pH计、药匙、0.01 mol/L FeCl3溶液、FeCl3晶体
实验用品:
Fe3+ + 3H2O ? Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
预测结论:
增大反应物浓度,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
减小
实验探究2:反应物浓度对FeCl3水解平衡的影响
思考与讨论
向0.1 mol/L FeCl3溶液中加水稀释10倍,溶液将pH如何变化呢?
0.1 mol/L FeCl3溶液
0.01 mol/L FeCl3溶液
结论:加水稀释,促进FeCl3的水解,水解程度增大。
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
越稀越水解
二、水解平衡的影响因素——外界条件
3、增大生成物浓度
预测现象:
实验原理:
量筒、试管、蒸馏水、0.01 mol/L FeCl3溶液、浓盐酸
实验用品:
Fe3+ + 3H2O ? Fe(OH)3 + 3H+ ΔH >0
颜色变浅
预测结论:
增大生成物浓度,FeCl3水解平衡逆向移动。
FeCl3水解程度 。
减小
实验探究3:生成物浓度对FeCl3水解平衡的影响
思考与讨论
向5 mL 0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液,有什么现象?
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
结论:加入NaOH后,H+浓度减小,FeCl3的水解平衡正向移动。
溶液颜色加深
FeCl3水解程度 。
减小
思考与讨论
向5mL 0.1mol/L FeCl3溶液中,①加入少量AlCl3固体,②加入少量NaCl固体, ③加入少量NaHCO3固体,各有什么现象 ?
显酸性,平衡逆移,溶液颜色变浅
平衡不移动,溶液颜色不变
显碱性,平衡正移,溶液颜色加深
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
① Al3+ + 3H2O ? Al(OH)3 + 3H+
③ HCO3- + H2O ? H2CO3+ OH-
?
②NaCl不水解
同性相抑,异性相促
显酸性
思考1、为什么用纯碱溶液去油污而不用小苏打呢?
思考2、为什么热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
用纯碱溶液清洗油污时,加热可以增强其去污力,这是为什么?
影响盐类水解平衡的因素
一、本身性质
二、外界条件
——符合勒夏特列原理
越弱越水解
1、温度:
越热越水解
2、浓度
加盐(本身):
稀释:
加酸、加碱、加水解盐:
平衡正移,水解程度增大
平衡正移,水解程度增大
越稀越水解
平衡正移,水解程度减小
同性相抑,异性相促
练习1、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A、加热 B、通入HCl
C、加入少量Na2SO4(s) D、加入NaCl溶液
D
练习2、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A、减小、增大、减小 B、增大、减小、减小
C、减小、增大、增大 D、增大、减小、增大
A
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}种类
H2SO3
CH3COOH
H2CO3
HClO
电离常数
Ka1=1.40×l0-2
Ka2=6.00×l0-8?
1.75×10-5
Ka1=4.50×l0-7
Ka2=4.70×10-11
4.00×10-8
练习3、在相同温度下,比较0.1mol/L的NaHSO3、CH3COONa、Na2CO3、NaHCO3、NaClO溶液中pH值的大小。
{22838BEF-8BB2-4498-84A7-C5851F593DF1}改变条件
平衡移动
c(H+)
pH
水解程度
现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐↓无色↑
颜色变浅
红褐↓
练习4、在0.01mol/LFeCl3溶液中,Fe3++3H2O ? Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
在配制FeCl3溶液时,若将FeCl3晶体直接溶于蒸馏水中,制得的液体会出现丁达尔效应,为什么?
思考1、如何配制澄清的FeCl3溶液?
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
再 见
谢谢
各位老师:
您好!如果您有幸下载到此课件,这是我的荣幸!在此我非常感谢您使用本课件。若有不到之处请大家批评指正。
如果您想去掉校徽,步骤如下:
请点击:
视图
幻灯片母版
选定校徽删除
影响盐类水解的主要因素
1、能通过实验探究温度、浓度对盐类水解平衡的影响。
2、认识影响盐类水解平衡的主要因素,并能解释反应条件影响盐类水解平衡的因素。
思考1、为什么用纯碱溶液去油污而不用小苏打呢?
思考2、为什么热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
用纯碱溶液清洗油污时,加热可以增强其去污力,这是为什么?
2、研究盐类水解时,一般从两个方面考虑:一是反应物的性质,二是反应条件。
影响盐类水解平衡的因素
1、盐类水解平衡有什么特点?
可逆、微弱、吸热
影响盐类水解
平衡的因素
一、本身性质
二、外界条件:温度、浓度等
一、水解平衡的影响因素——本身性质
已知:Ka(HCOOH)=1.75×10-4、 Ka(CH3COOH)=1.75×10-5,用pH计分别测量物质的量浓度相同的醋酸钠溶液、甲酸钠溶液的pH。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}0.1 mol/L
pH
类型
离子方程式
生成酸
的酸性
CH3COONa
HCOONa
强碱弱酸盐
强碱弱酸盐
8.9
8.4
CH3COO-+H2O ? CH3COOH +OH-
?
HCOO- + H2O ? HCOOH + OH-
?
弱
强
盐
水解
酸
越弱
pH越大
结论
生成OH-越多
水解程度越大
使得
H2O ?? H+ + OH-
?
NaA = A- + Na+
A-结合H+的能力越强
HA酸性越弱(Ka越小)
A-水解程度越大
1、强碱弱酸盐(NaA)的水解:
HA
?
?
+
pH值越大
越弱越水解
H2O ?? H+ + OH-
?
BCl = Cl- + B+
BOH
?
?
+
2、强酸弱碱盐(BCl)的水解:
B+结合OH-的能力越强
BOH碱性越弱(Kb越小)
B+水解程度越大
pH值越小
越弱越水解
例1、请同学们预测相同浓度的Na2CO3溶液与Na2SiO3溶液的pH大小,并说明理由。
例2、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
B
思考与讨论
1、FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
呈酸性
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
2、FeCl3水解反应是吸热还是放热?
酸 + 碱 ?? 盐 + 水
?
中和
水解
吸热
3、根据勒夏特列原理,升高温度,FeCl3水解平衡反应向什么方向移动?
正向移动
谁强显谁性
二、水解平衡的影响因素——外界条件
1、温度
预测现象:
实验原理:
烧杯、三角架、pH计、酒精灯、火柴、0.01 mol/L FeCl3溶液
实验用品:
Fe3+ + 3H2O ? Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
越热越水解
预测结论:
温度升高,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
增大
实验探究1:温度对FeCl3水解平衡的影响
二、水解平衡的影响因素——外界条件
2、增大反应物浓度
预测现象:
实验原理:
量筒、试管、pH计、药匙、0.01 mol/L FeCl3溶液、FeCl3晶体
实验用品:
Fe3+ + 3H2O ? Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
预测结论:
增大反应物浓度,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
减小
实验探究2:反应物浓度对FeCl3水解平衡的影响
思考与讨论
向0.1 mol/L FeCl3溶液中加水稀释10倍,溶液将pH如何变化呢?
0.1 mol/L FeCl3溶液
0.01 mol/L FeCl3溶液
结论:加水稀释,促进FeCl3的水解,水解程度增大。
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
越稀越水解
二、水解平衡的影响因素——外界条件
3、增大生成物浓度
预测现象:
实验原理:
量筒、试管、蒸馏水、0.01 mol/L FeCl3溶液、浓盐酸
实验用品:
Fe3+ + 3H2O ? Fe(OH)3 + 3H+ ΔH >0
颜色变浅
预测结论:
增大生成物浓度,FeCl3水解平衡逆向移动。
FeCl3水解程度 。
减小
实验探究3:生成物浓度对FeCl3水解平衡的影响
思考与讨论
向5 mL 0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液,有什么现象?
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
结论:加入NaOH后,H+浓度减小,FeCl3的水解平衡正向移动。
溶液颜色加深
FeCl3水解程度 。
减小
思考与讨论
向5mL 0.1mol/L FeCl3溶液中,①加入少量AlCl3固体,②加入少量NaCl固体, ③加入少量NaHCO3固体,各有什么现象 ?
显酸性,平衡逆移,溶液颜色变浅
平衡不移动,溶液颜色不变
显碱性,平衡正移,溶液颜色加深
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
① Al3+ + 3H2O ? Al(OH)3 + 3H+
③ HCO3- + H2O ? H2CO3+ OH-
?
②NaCl不水解
同性相抑,异性相促
显酸性
思考1、为什么用纯碱溶液去油污而不用小苏打呢?
思考2、为什么热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
用纯碱溶液清洗油污时,加热可以增强其去污力,这是为什么?
影响盐类水解平衡的因素
一、本身性质
二、外界条件
——符合勒夏特列原理
越弱越水解
1、温度:
越热越水解
2、浓度
加盐(本身):
稀释:
加酸、加碱、加水解盐:
平衡正移,水解程度增大
平衡正移,水解程度增大
越稀越水解
平衡正移,水解程度减小
同性相抑,异性相促
练习1、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A、加热 B、通入HCl
C、加入少量Na2SO4(s) D、加入NaCl溶液
D
练习2、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A、减小、增大、减小 B、增大、减小、减小
C、减小、增大、增大 D、增大、减小、增大
A
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}种类
H2SO3
CH3COOH
H2CO3
HClO
电离常数
Ka1=1.40×l0-2
Ka2=6.00×l0-8?
1.75×10-5
Ka1=4.50×l0-7
Ka2=4.70×10-11
4.00×10-8
练习3、在相同温度下,比较0.1mol/L的NaHSO3、CH3COONa、Na2CO3、NaHCO3、NaClO溶液中pH值的大小。
{22838BEF-8BB2-4498-84A7-C5851F593DF1}改变条件
平衡移动
c(H+)
pH
水解程度
现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐↓无色↑
颜色变浅
红褐↓
练习4、在0.01mol/LFeCl3溶液中,Fe3++3H2O ? Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
在配制FeCl3溶液时,若将FeCl3晶体直接溶于蒸馏水中,制得的液体会出现丁达尔效应,为什么?
思考1、如何配制澄清的FeCl3溶液?
Fe3+ + 3H2O ? Fe(OH)3 + 3H+
再 见
谢谢
各位老师:
您好!如果您有幸下载到此课件,这是我的荣幸!在此我非常感谢您使用本课件。若有不到之处请大家批评指正。
如果您想去掉校徽,步骤如下:
请点击:
视图
幻灯片母版
选定校徽删除
