高一化学人教版(2019)必修第二册课件:5.2 氮及其化合物(第1课时)(18张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第二册课件:5.2 氮及其化合物(第1课时)(18张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-17 19:32:04 | ||
图片预览





文档简介
(共18张PPT)
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物(一)
氮气
氮的氧化物
氨的性质
氨的实验室制法
考法解读
高考考向
1、通过分析元素化合价的变化,从氧化还原反应的本质掌握含氮物质间的转化。
2、通过实验认识氨的性质和制备。提高观察、描述和分析实验现象的能力。
1、考查内容:氮氧化合物、氨的性质、用途和计算
2、考察题型:选择题、非选择题
3、分值情况:选择题3~5分,非选择题2~3分
Nitrogen
1、氮原子结构
氮元素是 元素,位于元素周期表的 周期、 族。
氮原子最外层有 个电子既不容易得到3个电子,也不容易失去5个电子。因此,氮原子一般通过 与其他原子相互结合构成物质。
非金属
二
ⅤA
5
共用电子对
2、氮元素存在形式
主要以 的形式存在于空气中,部分氮元素存在于动植物体内的 中,还有部分存在于土壤、海洋里的 和 中。
氮分子
蛋白质
硝酸盐
铵盐
3、物理性质
4、化学性质
颜色 状态 气味 密度 溶解性
无色 气体 无味 比空气稍小 难溶于水
由于氮分子内氮原子间以共价三键结合,断开需要较多的能量,所以通常情况下,氮气的化学性质很稳定。在高温、放电等条件下,氮分子获得足够的能量,使氮氮三键断裂。
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
自然固氮
生物固氮
芒硝
Na2SO4·10H2O
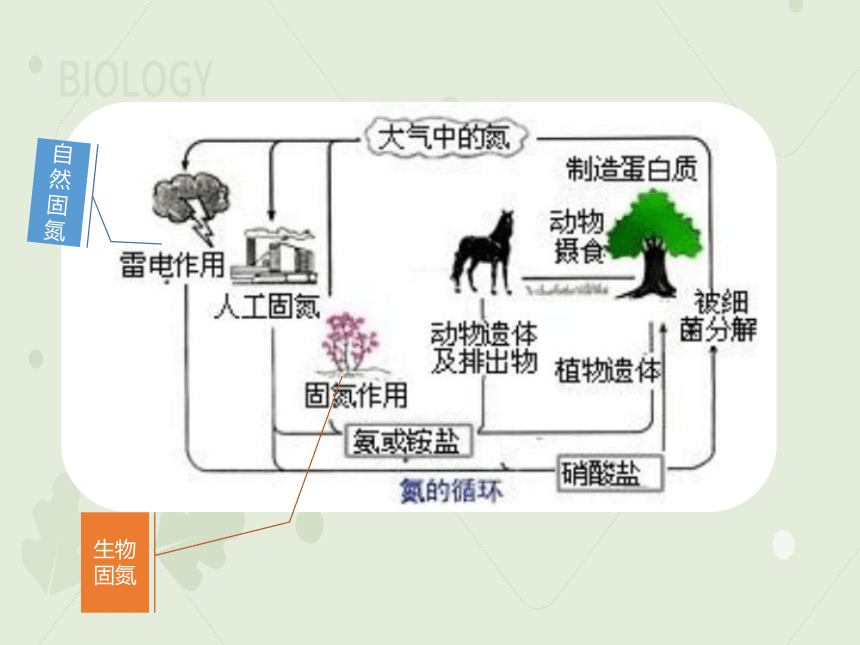
5、氮的固定
(1)概念:将大气中游离态的氮转化为氮的化合物的过程叫作氮的固定。
(2)类型
氮的固定
人工固氮 (如工业合成氨:N2 + 3H2 2NH3)
自然固氮(如“雷雨发庄稼”;
N2 + O2 2NO NO2 HNO3 硝酸盐
生物固氮(如豆科植物的根瘤菌能够将空气中的氮转化为氨)
化学模拟生物固氮(利用化学方法模拟固氮酶的作用,在温和条件下将氮转化为氨)
一、NO和NO2性质的对比
NO NO2
物理性质 色、味、态 无色、无味气体 红棕色气体、刺激性气味
毒性 有毒
水溶性 不溶 易溶且与水反应
化学性质 与O2反应 2NO + O2 =2NO2 ——
与H2O反应 —— 3NO2 + H2O=2HNO3 + NO
与H2O、O2共同反应 4NO + 3O2 + 2H2O=4HNO3 4NO2 + O2 + 2H2O=4HNO3
氧化性 6NO + 4NH3 5N2 + 6H2O 6NO2 + 8NH3 7N2 + 12H2O
NO2 + SO2 =SO3 +NO
NO2能使湿润的淀粉碘化钾试纸变蓝
2、氮的氧化物溶于水的计算
原理:无论是单一气体(NO2),还是NO、NO2、O2中的两者或三者的混合气体,反 应实质都是:3NO2 + H2O=2HNO3 + NO
2NO + O2 =2NO2
若有气体剩余,只能是NO、 O2 ,不能是NO2。
计算方法:——加合式法
①NO2和O2混合气体溶于水的计算
4NO2 + O2 + 2H2O=4HNO3
V(NO2):V(O2)
< 4:1 剩余O2
= 4:1 恰好完全反应
> 4:1 剩余NO
②NO和O2同时通入水中的计算
4NO + 3O2 + 2H2O=4HNO3
V(NO):V(O2)
< 4:3 剩余O2
= 4:3 恰好完全反应
> 4:3 剩余NO
③NO、NO2、O2混合通入水中
可先将NO和O2转化为NO2,在按上述分情况讨论。
也可先将NO2和H2O转化为NO,在按4NO + 3O2 + 2H2O=4HNO3 情况计算。
3、氮的氧化物对空气的污染
(1)空气中氮的氧化物的来源
机动车排放尾气
NOX
硝酸厂排放的废气
(2)二氧化氮的危害
①引起大气污染,直接危害身体健康,严重时会使人死亡。
②酸雨:2NO + O2 = 2NO2 , 3NO2 + H2O =2HNO3 +NO
③光化学烟雾:含氮氧化合物和碳氢化合物等一次污染物的大气,在阳光下发生化学反应而产生的二次污染物,这种一次污染物和二次污染物的混合物所形成的烟雾污染现象称为光化学烟雾。
(3)防治
①调整能源结构,发展清洁能源
②改进汽车尾气的处理技术,提高汽车尾气排放标准。
③改进煤燃烧技术,研究煤脱硫技术,减少SO2和氮氧化物的排放。
氨的性质
氨气泄漏
1、氨的物理性质
颜色 状态 气味 特性 溶解性
无色 气体 刺激性 易液化 极易溶于水,(1:700)
氨对人的器官有刺激作用,若不慎接触过多,及时吸入新鲜空气和水蒸气,并用大量水清洗。
2、氨的化学性质
与水反应
与酸反应
与O2反应
氨气
NH3 + H2O NH3 H2O NH4+ + OH-
NH3 + HCl = NH4Cl
NH3 + H2SO4 = (NH4)2SO4
NH3 + 5O2 4NO + 6H2O
产生大量白烟
应用:用浓盐酸检验氨气
工业制硝酸的基础实验
可用湿润的红色石蕊试纸检验NH3
『思考与讨论』为什么氨的催化氧化反应的产物是NO而不是NO2
4、氨的用途
实验操作:在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象, 分析出现这些现象的可能原因。
现象:烧杯中的溶液由玻璃管进入烧杯,形成喷泉,瓶内液体呈红色。
结论:氨极易溶于水,水溶液呈碱性。
3、喷泉实验
①氨是氮肥工业、有机合成工业、制造硝酸、铵盐和纯碱的原料。
②液氨可做制冷剂。
还有哪些物质可以形成喷泉实验?
氨的制备
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
1、实验室制备
方法一 铵盐与碱共热
实验原理:
收集:氨的密度比空气小,且氨易溶于水。可用向下排空气法。
检验:用湿润的红色石蕊试纸(变蓝)或蘸有浓硫酸的玻璃棒(有白烟)接近试管口。
思考:棉花的作用是什么?
防止试管内的NH3与试管外的空气对流,以便收集较为纯净的氨。
净化:装有碱石灰的干燥管,不能用浓硫酸和无氯化钙
方法二 浓氨水中加固态碱性物质
原理:向浓氨水中加入固态碱性物质(如:CaO 、碱石灰、NaOH等),消耗浓氨水中的水,同时反应放热,促进氨水分解。
方法三 加热浓氨水
原理: NH3 H2O NH3 ↑ + H2O
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物(一)
氮气
氮的氧化物
氨的性质
氨的实验室制法
考法解读
高考考向
1、通过分析元素化合价的变化,从氧化还原反应的本质掌握含氮物质间的转化。
2、通过实验认识氨的性质和制备。提高观察、描述和分析实验现象的能力。
1、考查内容:氮氧化合物、氨的性质、用途和计算
2、考察题型:选择题、非选择题
3、分值情况:选择题3~5分,非选择题2~3分
Nitrogen
1、氮原子结构
氮元素是 元素,位于元素周期表的 周期、 族。
氮原子最外层有 个电子既不容易得到3个电子,也不容易失去5个电子。因此,氮原子一般通过 与其他原子相互结合构成物质。
非金属
二
ⅤA
5
共用电子对
2、氮元素存在形式
主要以 的形式存在于空气中,部分氮元素存在于动植物体内的 中,还有部分存在于土壤、海洋里的 和 中。
氮分子
蛋白质
硝酸盐
铵盐
3、物理性质
4、化学性质
颜色 状态 气味 密度 溶解性
无色 气体 无味 比空气稍小 难溶于水
由于氮分子内氮原子间以共价三键结合,断开需要较多的能量,所以通常情况下,氮气的化学性质很稳定。在高温、放电等条件下,氮分子获得足够的能量,使氮氮三键断裂。
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
自然固氮
生物固氮
芒硝
Na2SO4·10H2O
5、氮的固定
(1)概念:将大气中游离态的氮转化为氮的化合物的过程叫作氮的固定。
(2)类型
氮的固定
人工固氮 (如工业合成氨:N2 + 3H2 2NH3)
自然固氮(如“雷雨发庄稼”;
N2 + O2 2NO NO2 HNO3 硝酸盐
生物固氮(如豆科植物的根瘤菌能够将空气中的氮转化为氨)
化学模拟生物固氮(利用化学方法模拟固氮酶的作用,在温和条件下将氮转化为氨)
一、NO和NO2性质的对比
NO NO2
物理性质 色、味、态 无色、无味气体 红棕色气体、刺激性气味
毒性 有毒
水溶性 不溶 易溶且与水反应
化学性质 与O2反应 2NO + O2 =2NO2 ——
与H2O反应 —— 3NO2 + H2O=2HNO3 + NO
与H2O、O2共同反应 4NO + 3O2 + 2H2O=4HNO3 4NO2 + O2 + 2H2O=4HNO3
氧化性 6NO + 4NH3 5N2 + 6H2O 6NO2 + 8NH3 7N2 + 12H2O
NO2 + SO2 =SO3 +NO
NO2能使湿润的淀粉碘化钾试纸变蓝
2、氮的氧化物溶于水的计算
原理:无论是单一气体(NO2),还是NO、NO2、O2中的两者或三者的混合气体,反 应实质都是:3NO2 + H2O=2HNO3 + NO
2NO + O2 =2NO2
若有气体剩余,只能是NO、 O2 ,不能是NO2。
计算方法:——加合式法
①NO2和O2混合气体溶于水的计算
4NO2 + O2 + 2H2O=4HNO3
V(NO2):V(O2)
< 4:1 剩余O2
= 4:1 恰好完全反应
> 4:1 剩余NO
②NO和O2同时通入水中的计算
4NO + 3O2 + 2H2O=4HNO3
V(NO):V(O2)
< 4:3 剩余O2
= 4:3 恰好完全反应
> 4:3 剩余NO
③NO、NO2、O2混合通入水中
可先将NO和O2转化为NO2,在按上述分情况讨论。
也可先将NO2和H2O转化为NO,在按4NO + 3O2 + 2H2O=4HNO3 情况计算。
3、氮的氧化物对空气的污染
(1)空气中氮的氧化物的来源
机动车排放尾气
NOX
硝酸厂排放的废气
(2)二氧化氮的危害
①引起大气污染,直接危害身体健康,严重时会使人死亡。
②酸雨:2NO + O2 = 2NO2 , 3NO2 + H2O =2HNO3 +NO
③光化学烟雾:含氮氧化合物和碳氢化合物等一次污染物的大气,在阳光下发生化学反应而产生的二次污染物,这种一次污染物和二次污染物的混合物所形成的烟雾污染现象称为光化学烟雾。
(3)防治
①调整能源结构,发展清洁能源
②改进汽车尾气的处理技术,提高汽车尾气排放标准。
③改进煤燃烧技术,研究煤脱硫技术,减少SO2和氮氧化物的排放。
氨的性质
氨气泄漏
1、氨的物理性质
颜色 状态 气味 特性 溶解性
无色 气体 刺激性 易液化 极易溶于水,(1:700)
氨对人的器官有刺激作用,若不慎接触过多,及时吸入新鲜空气和水蒸气,并用大量水清洗。
2、氨的化学性质
与水反应
与酸反应
与O2反应
氨气
NH3 + H2O NH3 H2O NH4+ + OH-
NH3 + HCl = NH4Cl
NH3 + H2SO4 = (NH4)2SO4
NH3 + 5O2 4NO + 6H2O
产生大量白烟
应用:用浓盐酸检验氨气
工业制硝酸的基础实验
可用湿润的红色石蕊试纸检验NH3
『思考与讨论』为什么氨的催化氧化反应的产物是NO而不是NO2
4、氨的用途
实验操作:在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象, 分析出现这些现象的可能原因。
现象:烧杯中的溶液由玻璃管进入烧杯,形成喷泉,瓶内液体呈红色。
结论:氨极易溶于水,水溶液呈碱性。
3、喷泉实验
①氨是氮肥工业、有机合成工业、制造硝酸、铵盐和纯碱的原料。
②液氨可做制冷剂。
还有哪些物质可以形成喷泉实验?
氨的制备
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
1、实验室制备
方法一 铵盐与碱共热
实验原理:
收集:氨的密度比空气小,且氨易溶于水。可用向下排空气法。
检验:用湿润的红色石蕊试纸(变蓝)或蘸有浓硫酸的玻璃棒(有白烟)接近试管口。
思考:棉花的作用是什么?
防止试管内的NH3与试管外的空气对流,以便收集较为纯净的氨。
净化:装有碱石灰的干燥管,不能用浓硫酸和无氯化钙
方法二 浓氨水中加固态碱性物质
原理:向浓氨水中加入固态碱性物质(如:CaO 、碱石灰、NaOH等),消耗浓氨水中的水,同时反应放热,促进氨水分解。
方法三 加热浓氨水
原理: NH3 H2O NH3 ↑ + H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
