高一化学人教版(2019)必修第二册课件:7.1认识有机化合物(25张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第二册课件:7.1认识有机化合物(25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-17 19:45:32 | ||
图片预览





文档简介
(共25张PPT)
第七章 有机化合物
第一节 认识有机化合物
考法解读
1、能描述有机化合物中碳原子的成键特点(证据推理与模型认识)
2、认识烷烃的结构、性质及应用,取代反应(科学探究与创新意识)
3、知道有机化合物存在同分异构现象,能写出丁烷和戊烷的同分异构体(证据推理与模型认知)
高考导向
1、考查内容:CH4的取代反应,烷烃的结构、性质及应用,烷烃物理性质的递变规律,同系物的判断,同分异构体的书写与判断。
2、考察题型:选择题
3、分值情况:2~6分
有机化合物
cv
目前。人们在自然界发现和人工合成的物质已经超过1亿种,其中绝大多数是有机物。
为什么有机物如此繁多?
cv
有机化合物中碳原子的成键特点
一
最简单的有机物——甲烷结构是什么样的?
电子式
结构式
知识点:
1、有机化合物一般指含碳化合物。
2、组成元素:除含有碳外,通常好含有氢、氧、氮、硫、卤素、磷等。
3、甲烷是最简单、相对分子质量最小的烃,也是碳元素质量分数最小的烃。
CH4
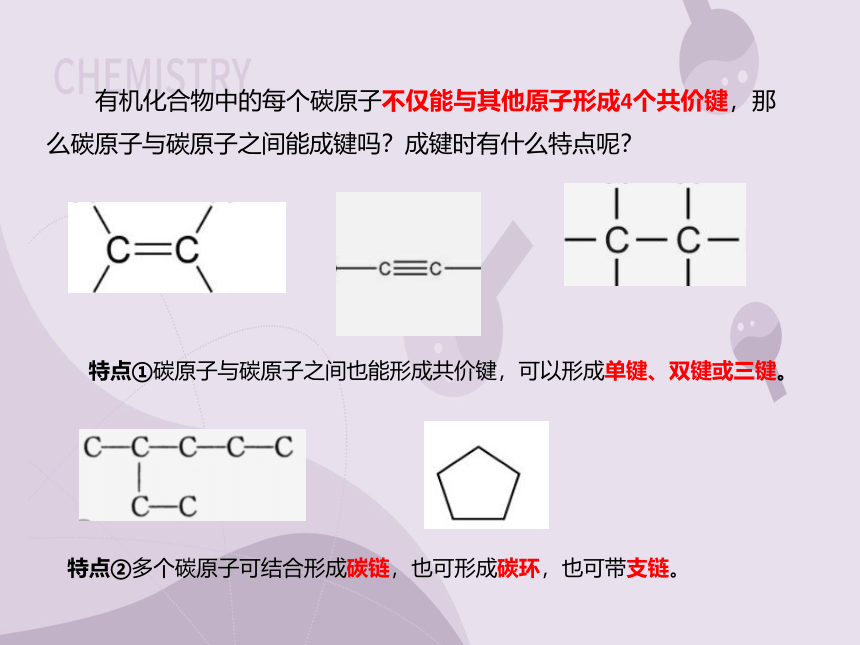
有机化合物中的每个碳原子不仅能与其他原子形成4个共价键,那么碳原子与碳原子之间能成键吗?成键时有什么特点呢?
特点①碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
特点②多个碳原子可结合形成碳链,也可形成碳环,也可带支链。
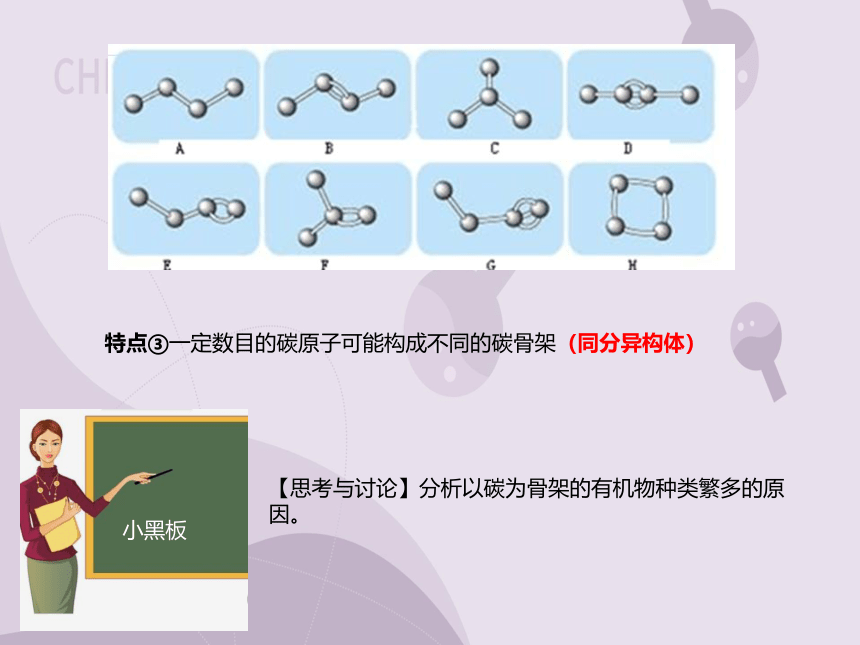
【思考与讨论】分析以碳为骨架的有机物种类繁多的原因。
小黑板
特点③一定数目的碳原子可能构成不同的碳骨架(同分异构体)
烷烃的结构
二
空间结构示意图
空间结构示意图
为什么是正四面体?
甲烷分子中,4个C-H键的长度
和强度相同夹角相等(均为109 28'或109.5 )
空间充填模型
球棍模型
都属于物理模型
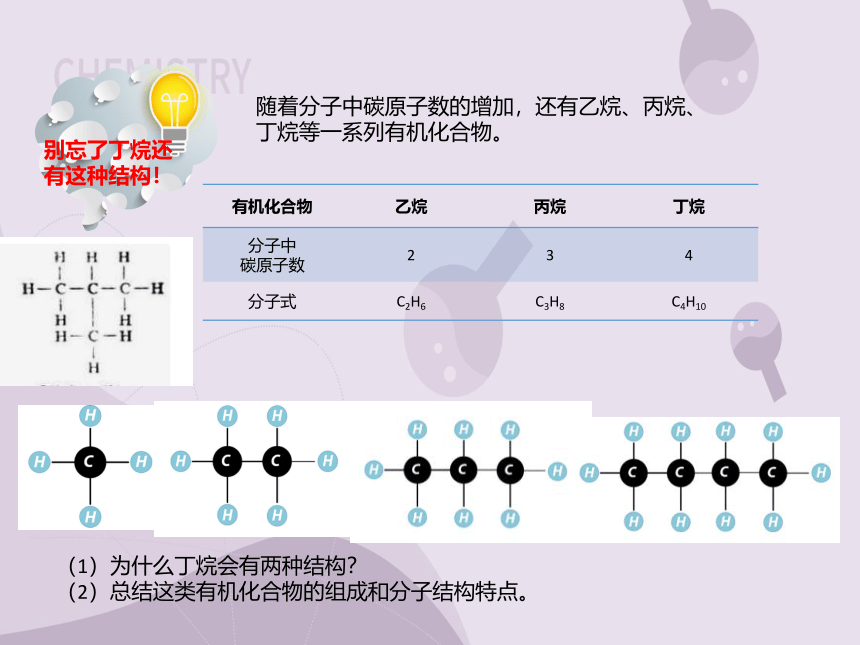
别忘了丁烷还有这种结构!
随着分子中碳原子数的增加,还有乙烷、丙烷、丁烷等一系列有机化合物。
有机化合物 乙烷 丙烷 丁烷
分子中 碳原子数 2 3 4
分子式 C2H6 C3H8 C4H10
(1)为什么丁烷会有两种结构?
(2)总结这类有机化合物的组成和分子结构特点。
(1)定义:只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样一类有机化合物叫做饱和烃,又叫烷烃。
链状、饱和是烷烃区别于其他烃的本质。
(2)链状烷烃通式:CnH2n+2 (n≥1,n∈N)
(3)结构特点:
①烷烃分子中每个碳原子与4个原子相连,对于烷烃的任意一个碳原子来说,它周围的4个原子以它为中心构成四面体,否则就不是正四面体。
②链状烷烃为开链式结构,可以是直链,也可带支链。碳原子数≥3的链状烷烃分子中的碳链均非直线型,为锯齿形。
③烷烃中C-H单键和C-C单键都可以旋转。
烷烃的习惯命名法
它们的名字都是什么呢?
1、碳原子数在10以内,依次用甲、乙、丙、丁、戊、己、庚、辛、壬、癸代表碳原子数,其后加上“烷”字,如甲烷、乙烷等。
2、碳原子数在10以上,用汉字数字表示,如十二烷、十七烷等。
3、对于碳原子数相同而结构不同的烷烃,一般在烷烃命名之前再加上“正”、“异”、“新”等字样加以区别。
正戊烷
异戊烷
新戊烷
结构式与结构简式
(1)结构式:
把每一个共价键都用一条短线“—”表示,反映分子结构的式子。
(2)结构简式:
既反映分子的结构又相对较为简略的式子称为结构简式。
例如:甲烷的结构简式为:CH4
甲烷的结构式为:
你造吗?
同分异构体、同系物
三
知识解读
对比甲烷、乙烷、丙烷、丁烷的结构简式,我们发现相邻烷烃的分子在组成上相差一个CH2原子团,像这种结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
1、同系物的组成元素相同;分子组成通式相同;物质类别相同。
2、同系物的分子结构不同;分子式不同;摩尔质量不同;是不同的物质。
3、同系物的分子结构相似,物理性质不同,化学性质相似。
4、同系物具有相同的通式,但具有相同通式的有机物不一定是同系物。
5、同系物的分子组成相差n个CH2,相对分子质量相差14n(n=1,2,3……)
6、判断两种或多种有机物是否互为同系物,充要条件有两点:一是分子结构相似,二是分子组成相差一个或若干CH2原子团,两者缺一不可。
概念获取
像正戊烷、异戊烷、新戊烷这种化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象。
具有同分异构现象的化合物互称为同分异构体。
考法解读1
化学“四同”的比较
内容 同位素 同素异形体 同系物 同分异构体
定义 质子数相同、中子数不同的原子(核素) 由一种元素组成的不同单质 结构相似,分子组成上相差一个或若干个CH2原子团的物质 分子式相、
结构不同的化合物
对象 原子 单质 化合物 化合物
性质 化学性质几乎一样,物理性质有差异 化学性质相似,物理性质差别较大 化学性质相似,熔、沸点,密度呈规律性变化 化学性质可能相似也可能不同,物理性质不同。
实例 H、D、T 金刚石与石墨 甲烷与丙烷 正戊烷与新戊烷
概念获取
给出一种物质,你能书写它所有的同分异构体吗?
以C6H14为例,比一比,谁写出的同分异构体最多?
C6H14
口诀:
定主链,选支链,
主链由长到短,
支链由整到散,
位置由心到边,
排布由对到邻、间。
考法解读2
练习写出C7H16所有的同分异构体
考法解读3
判断烷烃一元取代物的方法——“等效氢法”
有机物中,化学环境相同的的氢原子叫做等效氢。显然,有几种不同的等效氢,一元取代物就有几种。例如:
1种等效氢
1种等效氢
2种等效氢
4种等效氢
来数数!
1、分子中同一个碳原子上连接的所有氢原子等效。
2、同一碳原子上连接的所有甲基上的氢原子等效。
3、分子中处于镜面对称位置上对应的氢原子是等效的。
甲烷的性质及用途
四
(1)物理性质
无色无味气体、难溶于水,密度比空气小,熔、沸点很低,难液化。
(2)化学性质
①氧化反应
甲烷具有可燃性,火焰淡蓝色。
②取代反应
条件 光照(不能强光直射) 暗处
现象 试管内气体颜色逐渐变浅、试管内壁有油状液滴;试管中有少量白雾;试管内液面上升;水槽中有固体析出。 无名显现象。
原理
一氯甲烷和氯化氢是气体,二氯甲烷、三氯甲烷、四氯化碳是液体。
结论
甲烷与氯气的反应是一种连锁反应,不会停留在某一反应上,不会只生成一种或两种产物,而是生成多种产物的混合物。与氯气的量无关。
注意事项:
1、用排饱和食盐水收集氯气的目的是净化氯气和减少氯气在水中的溶解度。
2、控制甲烷和氯气的体积比为1:1
3、甲烷和氯气的混合气体在弱光下安静地发生反应,在强光下照射下能发生爆炸。
4、氯气有毒,注意在通风下进行操作。
5、甲烷与氯气在光照下发生取代反应,与氯水、溴水不反应。
(3)用途
取代反应的特点:
上一下一,取而代之。
清洁燃料;制氟利昂制冷剂;氧化制甲醇;裂解制黑炭。
像这样有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应。
烷烃的性质
五
天然气
天然气、沼气的和煤层气的主要成分是甲烷;
护肤品、医用软膏中的“凡士林”和蜡烛、蜡笔中的的石蜡,其主要成分是含有碳原子较多的烷烃。
(1)物理性质
①烷烃的熔、沸点较低,随着碳原子数的增加而逐渐升高;
②常温常压下,碳原子数≤4的烷烃及新戊烷是气体。
③烷烃的相对密度较小,且随碳原子数的增加逐渐增大。
④碳原子数相同的烷烃,支链越多。熔、沸点越低。
⑤烷烃均为无色、难溶于水易溶于有机溶剂的物质。
(2)化学性质
①稳定性
通常情况比较稳定,不宜强酸、强碱或高锰酸钾等氧化剂发生反应。
②氧化反应
与甲烷类似,可以在空气中完全燃烧。随着烷烃分子中碳原子数的增加,燃烧越来越不充分,火焰越来越明亮,有些伴有黑烟。
燃烧反应通式:
③取代反应
在光照情况下与卤素单质发生取代反应。
(甲烷与氯气的反应)
④在较高温度下会发生分解。这个性质常被应用于石油化
工和天然气化工生产,从烷烃中得到一些化工基本原料和燃料。
第七章 有机化合物
第一节 认识有机化合物
考法解读
1、能描述有机化合物中碳原子的成键特点(证据推理与模型认识)
2、认识烷烃的结构、性质及应用,取代反应(科学探究与创新意识)
3、知道有机化合物存在同分异构现象,能写出丁烷和戊烷的同分异构体(证据推理与模型认知)
高考导向
1、考查内容:CH4的取代反应,烷烃的结构、性质及应用,烷烃物理性质的递变规律,同系物的判断,同分异构体的书写与判断。
2、考察题型:选择题
3、分值情况:2~6分
有机化合物
cv
目前。人们在自然界发现和人工合成的物质已经超过1亿种,其中绝大多数是有机物。
为什么有机物如此繁多?
cv
有机化合物中碳原子的成键特点
一
最简单的有机物——甲烷结构是什么样的?
电子式
结构式
知识点:
1、有机化合物一般指含碳化合物。
2、组成元素:除含有碳外,通常好含有氢、氧、氮、硫、卤素、磷等。
3、甲烷是最简单、相对分子质量最小的烃,也是碳元素质量分数最小的烃。
CH4
有机化合物中的每个碳原子不仅能与其他原子形成4个共价键,那么碳原子与碳原子之间能成键吗?成键时有什么特点呢?
特点①碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
特点②多个碳原子可结合形成碳链,也可形成碳环,也可带支链。
【思考与讨论】分析以碳为骨架的有机物种类繁多的原因。
小黑板
特点③一定数目的碳原子可能构成不同的碳骨架(同分异构体)
烷烃的结构
二
空间结构示意图
空间结构示意图
为什么是正四面体?
甲烷分子中,4个C-H键的长度
和强度相同夹角相等(均为109 28'或109.5 )
空间充填模型
球棍模型
都属于物理模型
别忘了丁烷还有这种结构!
随着分子中碳原子数的增加,还有乙烷、丙烷、丁烷等一系列有机化合物。
有机化合物 乙烷 丙烷 丁烷
分子中 碳原子数 2 3 4
分子式 C2H6 C3H8 C4H10
(1)为什么丁烷会有两种结构?
(2)总结这类有机化合物的组成和分子结构特点。
(1)定义:只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样一类有机化合物叫做饱和烃,又叫烷烃。
链状、饱和是烷烃区别于其他烃的本质。
(2)链状烷烃通式:CnH2n+2 (n≥1,n∈N)
(3)结构特点:
①烷烃分子中每个碳原子与4个原子相连,对于烷烃的任意一个碳原子来说,它周围的4个原子以它为中心构成四面体,否则就不是正四面体。
②链状烷烃为开链式结构,可以是直链,也可带支链。碳原子数≥3的链状烷烃分子中的碳链均非直线型,为锯齿形。
③烷烃中C-H单键和C-C单键都可以旋转。
烷烃的习惯命名法
它们的名字都是什么呢?
1、碳原子数在10以内,依次用甲、乙、丙、丁、戊、己、庚、辛、壬、癸代表碳原子数,其后加上“烷”字,如甲烷、乙烷等。
2、碳原子数在10以上,用汉字数字表示,如十二烷、十七烷等。
3、对于碳原子数相同而结构不同的烷烃,一般在烷烃命名之前再加上“正”、“异”、“新”等字样加以区别。
正戊烷
异戊烷
新戊烷
结构式与结构简式
(1)结构式:
把每一个共价键都用一条短线“—”表示,反映分子结构的式子。
(2)结构简式:
既反映分子的结构又相对较为简略的式子称为结构简式。
例如:甲烷的结构简式为:CH4
甲烷的结构式为:
你造吗?
同分异构体、同系物
三
知识解读
对比甲烷、乙烷、丙烷、丁烷的结构简式,我们发现相邻烷烃的分子在组成上相差一个CH2原子团,像这种结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
1、同系物的组成元素相同;分子组成通式相同;物质类别相同。
2、同系物的分子结构不同;分子式不同;摩尔质量不同;是不同的物质。
3、同系物的分子结构相似,物理性质不同,化学性质相似。
4、同系物具有相同的通式,但具有相同通式的有机物不一定是同系物。
5、同系物的分子组成相差n个CH2,相对分子质量相差14n(n=1,2,3……)
6、判断两种或多种有机物是否互为同系物,充要条件有两点:一是分子结构相似,二是分子组成相差一个或若干CH2原子团,两者缺一不可。
概念获取
像正戊烷、异戊烷、新戊烷这种化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象。
具有同分异构现象的化合物互称为同分异构体。
考法解读1
化学“四同”的比较
内容 同位素 同素异形体 同系物 同分异构体
定义 质子数相同、中子数不同的原子(核素) 由一种元素组成的不同单质 结构相似,分子组成上相差一个或若干个CH2原子团的物质 分子式相、
结构不同的化合物
对象 原子 单质 化合物 化合物
性质 化学性质几乎一样,物理性质有差异 化学性质相似,物理性质差别较大 化学性质相似,熔、沸点,密度呈规律性变化 化学性质可能相似也可能不同,物理性质不同。
实例 H、D、T 金刚石与石墨 甲烷与丙烷 正戊烷与新戊烷
概念获取
给出一种物质,你能书写它所有的同分异构体吗?
以C6H14为例,比一比,谁写出的同分异构体最多?
C6H14
口诀:
定主链,选支链,
主链由长到短,
支链由整到散,
位置由心到边,
排布由对到邻、间。
考法解读2
练习写出C7H16所有的同分异构体
考法解读3
判断烷烃一元取代物的方法——“等效氢法”
有机物中,化学环境相同的的氢原子叫做等效氢。显然,有几种不同的等效氢,一元取代物就有几种。例如:
1种等效氢
1种等效氢
2种等效氢
4种等效氢
来数数!
1、分子中同一个碳原子上连接的所有氢原子等效。
2、同一碳原子上连接的所有甲基上的氢原子等效。
3、分子中处于镜面对称位置上对应的氢原子是等效的。
甲烷的性质及用途
四
(1)物理性质
无色无味气体、难溶于水,密度比空气小,熔、沸点很低,难液化。
(2)化学性质
①氧化反应
甲烷具有可燃性,火焰淡蓝色。
②取代反应
条件 光照(不能强光直射) 暗处
现象 试管内气体颜色逐渐变浅、试管内壁有油状液滴;试管中有少量白雾;试管内液面上升;水槽中有固体析出。 无名显现象。
原理
一氯甲烷和氯化氢是气体,二氯甲烷、三氯甲烷、四氯化碳是液体。
结论
甲烷与氯气的反应是一种连锁反应,不会停留在某一反应上,不会只生成一种或两种产物,而是生成多种产物的混合物。与氯气的量无关。
注意事项:
1、用排饱和食盐水收集氯气的目的是净化氯气和减少氯气在水中的溶解度。
2、控制甲烷和氯气的体积比为1:1
3、甲烷和氯气的混合气体在弱光下安静地发生反应,在强光下照射下能发生爆炸。
4、氯气有毒,注意在通风下进行操作。
5、甲烷与氯气在光照下发生取代反应,与氯水、溴水不反应。
(3)用途
取代反应的特点:
上一下一,取而代之。
清洁燃料;制氟利昂制冷剂;氧化制甲醇;裂解制黑炭。
像这样有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应。
烷烃的性质
五
天然气
天然气、沼气的和煤层气的主要成分是甲烷;
护肤品、医用软膏中的“凡士林”和蜡烛、蜡笔中的的石蜡,其主要成分是含有碳原子较多的烷烃。
(1)物理性质
①烷烃的熔、沸点较低,随着碳原子数的增加而逐渐升高;
②常温常压下,碳原子数≤4的烷烃及新戊烷是气体。
③烷烃的相对密度较小,且随碳原子数的增加逐渐增大。
④碳原子数相同的烷烃,支链越多。熔、沸点越低。
⑤烷烃均为无色、难溶于水易溶于有机溶剂的物质。
(2)化学性质
①稳定性
通常情况比较稳定,不宜强酸、强碱或高锰酸钾等氧化剂发生反应。
②氧化反应
与甲烷类似,可以在空气中完全燃烧。随着烷烃分子中碳原子数的增加,燃烧越来越不充分,火焰越来越明亮,有些伴有黑烟。
燃烧反应通式:
③取代反应
在光照情况下与卤素单质发生取代反应。
(甲烷与氯气的反应)
④在较高温度下会发生分解。这个性质常被应用于石油化
工和天然气化工生产,从烷烃中得到一些化工基本原料和燃料。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
