高中化学人教版(2019)必修一 同步练习 1.2离子反应(含解析)
文档属性
| 名称 | 高中化学人教版(2019)必修一 同步练习 1.2离子反应(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 14:45:41 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第1章 第二节 离子反应 同步练习
一、单选题
1.下列物质既不属于电解质也不属于非电解质的是
A.Cu B.NaCl C.BaSO4 D.CO
2.下列指定溶液中离子一定能大量共存的是
A.在强酸性溶液中:、Na+、K+
B.在 溶液中:H2O2、、Na+
C.在稀硫酸溶液中:K+、、
D.在强碱性溶液中:Na+、、I-
3.下列离子方程式书写正确的是
A.明矾溶液与足量氨水反应:Al3++4NH3·H2O=AlO+2H2O+4NH
B.Fe3O4溶于HI溶液:Fe3O4 + 8H+ =Fe2+ + 2Fe3+ +4H2O
C.NaOH和Na2CO3等物质的量浓度混合溶液中加足量的盐酸:CO+ OH-+3H+=CO2↑ + 2H2O
D.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:
4.下列实验现象和结论相符的是
操作及现象 结论
A 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 溶液中一定含有
B 某溶液中加入硝酸银,产生白色沉淀 溶液中一定含有
C 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 溶液中一定有
D 向某溶液中加入溶液,有白色沉淀生成 溶液中一定含有
A.A B.B C.C D.D
5.下列各组中两稀溶液间的反应不可以用同一个离子方程式表示的是
A.少量的NH4HSO4与KOH溶液;少量的NaOH溶液与NH4HSO4溶液
B.少量的KHCO3溶液与Ca(OH)2溶液;少量的NaOH溶液与Ca(HCO3)2溶液
C.少量的Ba(OH)2与H2SO4溶液;少量的Ba(OH)2溶液与NaHSO4溶液
D.浓硝酸与NaOH溶液;KHSO4溶液与NaOH溶液
6.下列对应的化学用语错误的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na+ + HSO
B.Fe(OH)3在水溶中的电离方程式:Fe(OH)3=Fe3+ + 3OH-
C.明矾化学式:KAl(SO4)2·12H2O
D.苏打:Na2CO3
7.下列离子方程式书写正确的是
A.氯气与水反应 Cl2+H2O = 2H++Cl-+ClO-
B.Ca(OH)2溶液与少量NaHCO3溶液反应:
C.醋酸滴在大理石上:2H+ + CaCO3=Ca2+ + CO2↑+ H2O
D.向漂白粉溶液中通入足量二氧化碳 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
8.2021年,我国科学家实现了到淀粉的人工合成,该成果可以将空气中的捕集,用于合成淀粉。下列说法正确的是
A.可以用检验合成的淀粉
B.属于酸性氧化物,属于电解质
C.该科研成果为实现“碳中和”提供一种新思路
D.该成果的产业化可缓解温室效应,有效遏制酸雨的产生
9.限用硫酸、盐酸、醋酸、钠盐、钾盐、钡盐在溶液中反应,符合离子方程式2H++=H2O+SO2↑的化学方程式的个数有
A.3 B.4 C.8 D.12
二、填空题
10.现有下列物质:① 晶体② Zn ③ 固体 ④ 溶液⑤固体⑥盐酸⑦固体⑧无水酒精⑨氨气
(1)能导电的是_______(填序号,下同);属于电解质的是_______;属于非电解质的是_______。
(2)写出③在水溶液中的电离方程式:_______。
(3)写出Cu与④反应的离子方程式:_______。
(4)写出③和⑤在水溶液中反应的离子方程式:_______。
(5)请预测,在含、和HCl的溶液中加入适量②,首先置换出来的是_______
A.Fe B. C.Mg D.不能确定
11.根据要求填写下列空白:
(1)对于下列A~D涉及的反应,填写空白:
A.
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.
D.
①仅体现氧化性的反应是(填代号)_______。
②既体现氧化性又体现还原性的反应是(填代号)_______。
③上述反应说明、、氧化性由强到弱的顺序是:_______。
(2)已知甲、乙、丙是三种可溶性物质,其中甲是碱,乙、丙是盐,它们溶于水后电离产生的所有离子如下表所示:
阳离子 、、
阴离子 、、
①甲的化学式为_______。
②乙溶液与丙溶液反应可生成气体,该反应的离子方程式为_______。
③乙、丙溶液与甲溶液反应可分别生成白色沉淀和,其中可溶于稀硝酸。丙的化学式为_______;写出乙溶液与甲两溶液按溶质物质的量比反应的离子方程式:_______。
12.用烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和溶液,加热至液体呈透明的红褐色。发生反应:(胶体)。
(1)所得胶体分散质微粒直径的范围是_______,持续加热或搅拌会使胶体发生_______。
(2)用光束照射胶体,能产生_______效应,在光的传播过程中,光线照射到粒子时,如果粒子略小于入射光波长,则发生光的散射,这时观察到的是光波环绕微粒而向其四周放射的光,观察到光亮的“通路”,已知可见光波长为400~700nm,则下列分散系均能产生这种效应的是_______。
A.淀粉溶液、NaOH溶液、浊液
B.溶液、牛奶、漂白粉溶液
C.溶液、胶体、石灰乳
D.胶体、碘化银胶体、淀粉溶液
(3)利用半透膜分离胶体中的杂质分子或离子,提纯、精制胶体的方法称为渗析。将混有的胶体倒入火棉胶袋(半透膜)内,用线系紧密封,放入装有蒸馏水的烧杯内,过一段时间后,取烧杯中的溶液滴加硝酸银溶液,观察到的现象是_______,写出发生反应的离子方程式_______。
三、工业流程题
13.城市污水中含有一定量的、/等,可以通过如下三个阶段协同作用实现自养脱氮。
(1)第一阶段。向污水中加入菌体和溶液,控制温度和pH,繁殖菌体并进行富集。基态核外电子排布式为_______。
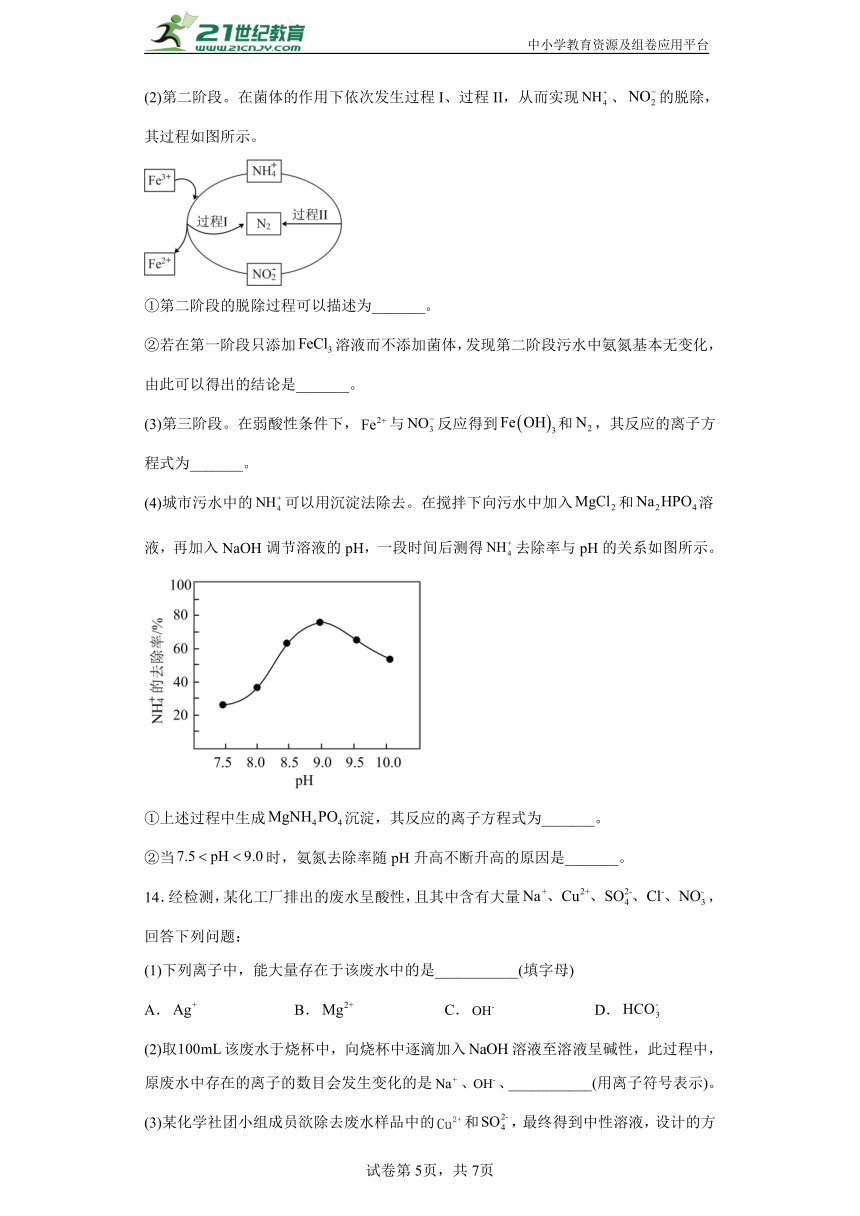
(2)第二阶段。在菌体的作用下依次发生过程I、过程II,从而实现、的脱除,其过程如图所示。
①第二阶段的脱除过程可以描述为_______。
②若在第一阶段只添加溶液而不添加菌体,发现第二阶段污水中氨氮基本无变化,由此可以得出的结论是_______。
(3)第三阶段。在弱酸性条件下,与反应得到和,其反应的离子方程式为_______。
(4)城市污水中的可以用沉淀法除去。在搅拌下向污水中加入和溶液,再加入NaOH调节溶液的pH,一段时间后测得去除率与pH的关系如图所示。
①上述过程中生成沉淀,其反应的离子方程式为_______。
②当时,氨氮去除率随pH升高不断升高的原因是_______。
14.经检测,某化工厂排出的废水呈酸性,且其中含有大量,回答下列问题:
(1)下列离子中,能大量存在于该废水中的是___________(填字母)
A. B. C. D.
(2)取该废水于烧杯中,向烧杯中逐滴加入溶液至溶液呈碱性,此过程中,原废水中存在的离子的数目会发生变化的是、、___________(用离子符号表示)。
(3)某化学社团小组成员欲除去废水样品中的和,最终得到中性溶液,设计的方案流程如图所示。
①试剂a、b分别为___________(写化学式):“溶液3”所含的溶质阴离子主要有,___________(写离子符号)。
②“分离操作”的名称是___________。
③向“溶液1”中加入过量试剂c后,发生反应的离子方程式为___________。
15.氢氧化镍[Ni(OH)2]常用于制备金属镍及镍的重要化合物。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高氢氧化镍的工艺流程如图:
已知:H2S的电离常数K1=1.3×10-7,K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6。
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,还原产物为N2,金属镍溶解的离子方程式是_____。
(2)“除铁”加入Na2CO3时,生成黄钠铁矾(NaFe3(SO4)2(OH)6)的离子方程式是____;“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾沉淀对后续操作较为有利,原因是____。
(3)“除铜”时,反应的离子方程式为H2S+Cu2+=CuS+2H+,该反应平衡常数K=____。
(4)“除钙镁”过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_____。
(5)“沉镍”前c(Ni2+)=1.0mol/L,加入少量浓NaOH溶液,若忽略加入浓NaOH溶液对溶液体积的影响,则开始沉淀时溶液的pH=____。
四、元素或物质推断题
16.有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子和五种阴离子中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是_______和_______。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时,产生蓝色沉淀,向该沉淀中滴入稀,沉淀部分溶解,剩余白色固体,则X为_______(填序号)。
A. B. C. D.
(3)将19.2gCu投入装有足量D溶波的试管中,Cu不溶解,再滴加稀,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式_______。
(4)E溶液能使KI-淀粉试纸变蓝,该反应的离子方程式为_______。
参考答案:
1.A
【来源】湖南省部分学校2022-2023学年高二上学期期中考试化学试题
【详解】A.铜是单质,既不属于电解质也不属于非电解质,A正确;
B.氯化钠是化合物,其水溶液或熔融状态都能导电,氯化钠是电解质,B错误;
C.硫酸钡是化合物,其熔融状态能导电,硫酸钡是电解质,C错误
D.一氧化碳是非电解质,D错误;
故选A。
2.D
【来源】四川省成都市第七中学2022-2023学年高二上学期期中考试(理科)化学试题
【详解】A 为弱酸根离子, 在强酸性溶液中因发生 而不能大量共存, 选项A错误;
B. 对 的分解具有催化作用, 则 和 不能大量共存, 选项B 错误;
C. 在盐酸溶液中, 该组离子因发生 , 而不能大量共存, 选项C错误;
D. 离子间彼此均不反应, 可以大量共存, 选项D正确;
答案选D。
3.C
【来源】安徽省六安第一中学2022-2023学年高三上学期第二次月考化学试题
【详解】A.氨水中的NH3·H2O是弱碱,不能溶解Al(OH)3,反应的离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3,A错误;
B.铁离子可以氧化碘离子,则将Fe3O4固体溶于HI溶液中发生的离子反应为:Fe3O4 +2I-+ 8H+ = 3Fe2+ +I2+ 4H2O,B错误;
C.反应符合事实,遵循物质的拆分原则,C正确;
D.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液,要以不足量的Ba(OH)2为标准,假设其物质的量是2 mol,反应生成BaSO4沉淀、Al(OH)3沉淀、NH3·H2O,离子方程式为:,D错误;
故合理选项是C。
4.C
【来源】北京市丰台区2022-2023学年高一上学期期中考试化学(B卷)试题
【详解】A.碳酸氢根离子、碳酸根离子均与盐酸反应生成二氧化碳,则溶液中不一定含有,故A错误;
B.溶液中含有硫酸根离子也可以生成硫酸银白色沉淀,则不一定含有Cl-,故B错误;
C.钠元素的焰色反应为黄色,说明含有钠离子,故C正确;
D.加入氯化钡也可能生成氯化银沉淀或碳酸钡沉淀等,不一定含有硫酸根离子,故D错误;
故选C。
5.A
【来源】重庆外国语学校2022-2023学年高一上学期期中测试化学试题
【详解】A.少量的NH4HSO4与KOH溶液发生反应为NH+H++2OH-=NH3·H2O+H2O,少量的NaOH溶液与NH4HSO4溶液发生反应为H++OH-=H2O,故A符合题意;
B.两个反应的离子方程式均为,故B不符合题意;
C.两个反应的离子方程式均为,故C不符合题意;
D.两个反应的离子方程式均为H++OH-=H2O,故D不符合题意;
故选A。
6.B
【来源】重庆外国语学校2022-2023学年高一上学期期中测试化学试题
【详解】A.NaHSO4在熔融状态下电离产生钠离子和硫酸氢根,电离方程式正确,A正确;
B.氢氧化铁为弱碱,水溶液中电离方程式用可逆符号,B错误;
C.明矾的化学式正确,C正确;
D.苏打是碳酸钠,D正确;
故选B。
7.B
【来源】湖北省沙市中学2022-2023学年高一上学期第二次月考化学试题
【详解】A.氯气与水反应生成盐酸和次氯酸,反应的离子方程式是Cl2+H2O = H++Cl-+HClO,故A错误;
B.Ca(OH)2溶液与少量NaHCO3溶液反应生成碳酸钙沉淀、氢氧化钠、水,反应的离子方程式为,故B正确;
C.醋酸滴在大理石上生成醋酸钙、二氧化碳、水,反应的离子方程式是2CH3COOH + CaCO3=Ca2+ + CO2↑+ H2O+2CH3COO-,故C错误;
D.向漂白粉溶液中通入足量二氧化碳生成碳酸氢钙、次氯酸,反应的离子方程式为ClO-+CO2+H2O=HCO+HClO,故D错误;
选B。
8.C
【来源】河南省安阳市2022--2023学年高一上学期期中考试化学试题
【详解】A.淀粉溶液遇碘单质变蓝,I-不能检验淀粉,故A错误;
B.CO2在水溶液和熔融状态下都不能导电,属于非电解质,故B错误;
C.二氧化碳合成淀粉可减少空气中二氧化碳的含量,能为实现“碳中和”提供一种新思路,故C正确;
D.二氧化碳气体会造成温室效应,但造成酸雨的气体是SO2等气体,不能有效遏制酸雨的产生,故D错误;
故选:C。
9.C
【来源】浙江省玉环市玉城中学2022-2023学年高一上学期第一次月考化学试题
【详解】亚硫酸的钾盐、钠盐、钡盐中,BaSO3不溶于水,离子方程式中不能用表示,其余在溶液中均可用表示;三种酸中,醋酸是弱酸,离子方程式中不能用H+表示,符合离子方程式2H++-═SO2↑+H2O,存在两种盐(钾盐、钠盐)与两种酸(盐酸、硫酸)可组合出4个反应,且离子方程式相同;此外硫酸氢钠、硫酸氢钾为强酸的酸式盐,完全电离,与亚硫酸钠、亚硫酸钾,可组合出4个反应,且离子方程式相同,共有8个离子方程式相同的反应,故选C。
10.(1) ②④⑥ ①③⑤⑦ ⑧⑨
(2)NaHCO3=Na++HCO
(3)
(4)HCO +H+=H2O+CO2↑
(5)B
【来源】重庆市杨家坪中学2022-2023学年高一上学期第一次月考化学试题
【分析】①晶体属于化合物,不导电、其水溶液或熔融状态能导电、因此属于电解质;
②Zn能导电、是单质,既不属于电解质也不属于非电解质
③固体属于化合物,不导电、其水溶液能导电、因此属于电解质;
④溶液能导电、是混合物,既不属于电解质也不属于非电解质
⑤固体属于化合物,不导电、其水溶液或熔融状态能导电、因此属于电解质;
⑥盐酸能导电、是混合物,既不属于电解质也不属于非电解质
⑦固体属于化合物,不导电、其水溶液或熔融状态能导电、因此属于电解质;
⑧无水酒精非电解质、不导电;
⑨氨气是非电解质、其水溶液能导电。
【详解】(1)能导电的是②④⑥;属于电解质的是①③⑤⑦;属于非电解质的是⑧⑨。
(2)③即NaHCO3在水溶液中完全电离为Na+、HCO电离方程式:NaHCO3=Na++HCO。
(3)Cu与④即溶液发生置换反应,离子方程式:。
(4)③和⑤在水溶液中反应,即与溶液反应生成硫酸钠、水和二氧化碳,离子方程式:HCO +H+=H2O+CO2↑。
(5)在含、和HCl的溶液中加入适量②即锌,存在亚铁离子、镁离子和氢离子均具有一定氧化性,则氧化性强的氢离子优先反应,则首先置换出来的是,选B。
11.(1) D C Ag2O > H2O2 > K2CrO4
(2) Ba(OH)2 2H++CO=H2O+CO2↑ Na2CO3 Ba2++OH-+H++SO=BaSO4↓+H2O
【来源】山东省枣庄市第八中学2022-2023学年高一上学期第一次月考化学试题
【详解】(1)A.Na2O2+2HCl=2NaCl+H2O2中无元素化合价变化,为非氧化还原反应;
B.Ag2O+H2O2=2Ag+O2↑+H2O中,H2O2中O元素的化合价升高,H2O2作还原剂;
C.2H2O2=2H2O+O2↑中O元素的化合价既升高又降低,则既体现氧化性又体现还原性;
D.3H2O2+Cr2 (SO4 )3+10KOH=2K2CrO4+3K2SO4+8H2O中,H2O2中只有O元素的化合价降低,则H2O2作氧化剂,体现氧化性;
①根据分析,H2O2仅体现氧化性的反应为D;
②根据分析可知,H2O2既体现氧化性又体现还原性的反应是C;
③由B反应可知,Ag2O为氧化剂,H2O2为还原剂,根据氧化剂的氧化性大于还原剂,即氧化性 Ag2O>H2O2;由C反应可知,H2O2为氧化剂,K2CrO4为氧化产物,根据氧化剂氧化性大于氧化产物,即氧化性H2O2>K2CrO4,综上分析可知,氧化性由强到弱的顺序是:Ag2O> H2O2>K2CrO4;
(2)由于Ba2+和、都不能大量共存,且甲是碱,故甲为Ba(OH)2,另外乙、丙是盐,根据电离出的阳离子和阴离子可知,乙和丙为Na2CO3和NaHSO4中的一种,据此分析;
①由上述分析可知,甲的化学式为Ba(OH)2;
②由分析可知,乙溶液与丙溶液反应即Na2CO3和NaHSO4反应,可生成气体为CO2,该反应的离子方程式为:2H++=H2O+CO2↑;
③乙、丙溶液与甲溶液反应可分别生成白色沉淀即BaCO3和BaSO4,其中B可溶于稀硝酸,则B为BaCO3,则丙的化学式为Na2CO3,乙为NaHSO4,故乙与甲两溶液按溶质物质的量比1:1反应的离子方程式为:Ba2++OH-++H+=BaSO4↓+H2O。
12.(1) 1~100nm 聚沉
(2) 丁达尔 D
(3) 白色沉淀
【来源】福建省南平市高级中学2022-2023学年高一上学期期中考试化学试题
【详解】(1)氢氧化铁胶体中分散质微粒直径范围是1-100nm;持续加热,胶体会发生聚沉;
(2)光束照射胶体,胶体能产生丁达尔效应;
A. 淀粉溶液为胶体,NaOH溶液、浊液不是胶体,A不符合;
B. 溶液、漂白粉溶液不是胶体,牛奶是胶体,B不符合;
C. 溶液、石灰乳不是胶体,胶体是胶体,C不符合;
D. 胶体、碘化银胶体、淀粉溶液全部是胶体,能产生丁达尔效应,D符合;
故选D;
(3)胶体不能通过半透膜,溶液能通过半透膜,故放置一段时间后,烧杯中含MgCl2,半透膜内为胶体,烧杯中滴加硝酸银溶液后,有白色沉淀,离子方程式为:。
13.(1)或
(2) 在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成 没有菌体,在本实验条件下与不会发生化学反应
(3)
(4) 随着pH的增大,转化为,使的浓度增大,生成沉淀的反应速率加快,导致的去除率不断升高
【来源】江苏省连云港市2022-2023学年高三上学期期中调研考试化学试题
【分析】第一阶段。向污水中加入菌体和溶液,控制温度和pH,繁殖菌体并进行富集。第二阶段,在菌体的作用下依次发生在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成,从而实现、的脱除,第三阶段。在弱酸性条件下,与反应得到和,最后得到净化水。
【详解】(1)铁是26号元素,基态核外电子排布式为或。故答案为:或;
(2)①第二阶段的脱除过程可以描述为在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成。故答案为:在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成;
②若在第一阶段只添加溶液而不添加菌体,发现第二阶段污水中氨氮基本无变化,由此可以得出的结论是没有菌体,在本实验条件下与不会发生化学反应。故答案为:没有菌体,在本实验条件下与不会发生化学反应;
(3)第三阶段。亚铁离子具有还原性,在弱酸性条件下,与反应得到和,其反应的离子方程式为。故答案为:;
(4)①加入NaOH调节溶液的pH,溶液中氢被中和,与镁离子结合生成沉淀,其反应的离子方程式为。故答案为:;
②当时,氨氮去除率随pH升高不断升高的原因是随着pH的增大,转化为,使的浓度增大,生成沉淀的反应速率加快,导致的去除率不断升高,故答案为:随着pH的增大,转化为,使的浓度增大,生成沉淀的反应速率加快,导致的去除率不断升高。
14.(1)B
(2)
(3) NaOH和 过滤
【来源】广东省珠海市第二中学2022-2023学年高一上学期11月期中考试化学试题
【分析】根据所得蓝色沉淀1,可知该蓝色沉淀为,所加试剂为NaOH溶液,其分离操作为过滤;除去常用钡盐,可用溶液,再用溶液除去多余的,过滤得到白色沉淀硫酸钡和碳酸钡,溶液2中含有NaOH和,用适量盐酸除去NaOH和调pH=7,即得到中性溶液。
【详解】(1)(1)A.与氯离子反应生成难溶的沉淀,不能共存,故A错误;
B.与均不反应,能共存,故B正确;
C.与反应生成难溶的沉淀,不能共存,故C错误;
D.与能反应,不能共存,故D错误;
故填B。
(2)(2) 取该废水于烧杯中,向烧杯中逐滴加入溶液至溶液呈碱性,除了、外,因与反应而使数目减少,故填;
(3)(3)①根据所得蓝色沉淀1,可知该蓝色沉淀为,所加试剂为NaOH溶液,其分离操作为过滤;除去常用钡盐,可用溶液;溶液3中除了含有外,因没有参与反应,还含有,故填NaOH和、
②分离操作后得到溶液和固体,所以该操作为过滤,故填过滤;
③试剂c主要用于除去多余的,试剂c为溶液,其反应的离子方程式为,故填。
15.(1)5Ni+12H++2NO=5Ni2++N2↑+6H2O
(2) Na++3Fe3++2SO+3H2O+3CO=NaFe3(SO4)2(OH)6↓+3CO2↑或Na++3Fe3++2SO+6H2O+6CO=NaFe3(SO4)2(OH)6↓+6HCO 沉降速率快,容易过滤等
(3)1.54×1014
(4)过量的F-生成氢氟酸会腐蚀陶瓷容器
(5)6.2
【来源】福建省莆田第一中学2022-2023学年高三上学期期中考试化学试题
【分析】废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入硫酸和硝酸酸溶,合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,溶解Ni,过滤除去废渣,滤液中加入过氧化氢,氧化亚铁离子为铁离子,加入碳酸钠调节溶液pH除去铁离子,过滤得到滤渣和滤液,滤液中加入H2S沉淀铜离子,过滤得到滤液中加入NaF用来除去镁离子和钙离子,过滤得到滤液中主要是镍离子,加入氢氧化钠溶液沉淀镍离子生成氢氧化镍固体,以此解答该题。
【详解】(1)镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平化学方程式为5Ni+12H++2NO=5Ni2++N2↑+6H2O,故答案为5Ni+12H++2NO=5Ni2++N2↑+6H2O;
(2)得到黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀离子方程式是Na++3Fe3++2SO+3H2O+3CO=NaFe3(SO4)2(OH)6↓+3CO2↑或Na++3Fe3++2SO+6H2O+6CO=NaFe3(SO4)2(OH)6↓+6HCO,沉淀颗粒较大,沉淀速率快且容易过滤,故答案为:Na++3Fe3++2SO+3H2O+3CO=NaFe3(SO4)2(OH)6↓+3CO2↑或Na++3Fe3++2SO+6H2O+6CO=NaFe3(SO4)2(OH)6↓+6HCO;沉淀速率快,容易过滤;
(3)“除铜”时,反应的离子方程式为H2S+Cu2+=CuS↓+2H+,该反应平衡常数,故答案为1.54×1014;
(4)NaF用量不宜过大,会有HF产生,腐蚀陶瓷容器,故答案为过量的F-生成氢氟酸会腐蚀陶瓷容器;
(5)沉镍”前c(Ni2+)=1.0mol/L,根据溶度积常数可知开始沉淀时溶液中氢氧根离子的浓度是,所以pH=14 7.8=6.2,故答案为6.2。
【点睛】本题以氢氧化镍的制备为背景,考查了学生有关氧化还原反应,物质分离提纯,沉淀溶解平衡,离子水解等内容,其中涉及平衡常数计算,pH计算。
16.(1) K2CO3 Ba(OH)2
(2)B
(3)3Cu+8H++2NO=3Cu2++2NO↑+4H2O
(4)2Fe3++2I﹣=2Fe2++I2
【来源】河南省许昌市建安区2022-2023学年高一上学期阶段测试(二)化学试题
【详解】(1)五种均为可溶性物质,所以必含有K2CO3,因CO与另外四种阳离子形成的物质都是难溶物;由此可知必含有Ba(OH)2,因OH-与另三种阳离子形成的物质都是难溶物;
(2)A与C混合产生的蓝色沉淀,则该沉淀必含氢氧化铜,该沉淀加入稀硝酸,沉淀部分溶于稀硝酸,且剩余一种不溶于稀硝酸的白色沉淀,则不溶的沉淀为硫酸钡,所以A为Ba(OH)2、C为CuSO4,则X为;
(3)由于Cu未溶解,加稀硫酸后管口附近有红棕色气体出现,说明该物质含有硝酸根离子,同时根据E溶液能使KI-淀粉试纸变蓝,E含有铁离子,所以D为Al(NO3)3,Cu和稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)E溶液能使KI-淀粉试纸变蓝,则E为FeCl3,铁离子可以氧化碘离子为碘单质,该反应的离子方程式2Fe3++2I-=2Fe2++I2。
试卷第6页,共7页
试卷第7页,共7页
第1章 第二节 离子反应 同步练习
一、单选题
1.下列物质既不属于电解质也不属于非电解质的是
A.Cu B.NaCl C.BaSO4 D.CO
2.下列指定溶液中离子一定能大量共存的是
A.在强酸性溶液中:、Na+、K+
B.在 溶液中:H2O2、、Na+
C.在稀硫酸溶液中:K+、、
D.在强碱性溶液中:Na+、、I-
3.下列离子方程式书写正确的是
A.明矾溶液与足量氨水反应:Al3++4NH3·H2O=AlO+2H2O+4NH
B.Fe3O4溶于HI溶液:Fe3O4 + 8H+ =Fe2+ + 2Fe3+ +4H2O
C.NaOH和Na2CO3等物质的量浓度混合溶液中加足量的盐酸:CO+ OH-+3H+=CO2↑ + 2H2O
D.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:
4.下列实验现象和结论相符的是
操作及现象 结论
A 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 溶液中一定含有
B 某溶液中加入硝酸银,产生白色沉淀 溶液中一定含有
C 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 溶液中一定有
D 向某溶液中加入溶液,有白色沉淀生成 溶液中一定含有
A.A B.B C.C D.D
5.下列各组中两稀溶液间的反应不可以用同一个离子方程式表示的是
A.少量的NH4HSO4与KOH溶液;少量的NaOH溶液与NH4HSO4溶液
B.少量的KHCO3溶液与Ca(OH)2溶液;少量的NaOH溶液与Ca(HCO3)2溶液
C.少量的Ba(OH)2与H2SO4溶液;少量的Ba(OH)2溶液与NaHSO4溶液
D.浓硝酸与NaOH溶液;KHSO4溶液与NaOH溶液
6.下列对应的化学用语错误的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na+ + HSO
B.Fe(OH)3在水溶中的电离方程式:Fe(OH)3=Fe3+ + 3OH-
C.明矾化学式:KAl(SO4)2·12H2O
D.苏打:Na2CO3
7.下列离子方程式书写正确的是
A.氯气与水反应 Cl2+H2O = 2H++Cl-+ClO-
B.Ca(OH)2溶液与少量NaHCO3溶液反应:
C.醋酸滴在大理石上:2H+ + CaCO3=Ca2+ + CO2↑+ H2O
D.向漂白粉溶液中通入足量二氧化碳 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
8.2021年,我国科学家实现了到淀粉的人工合成,该成果可以将空气中的捕集,用于合成淀粉。下列说法正确的是
A.可以用检验合成的淀粉
B.属于酸性氧化物,属于电解质
C.该科研成果为实现“碳中和”提供一种新思路
D.该成果的产业化可缓解温室效应,有效遏制酸雨的产生
9.限用硫酸、盐酸、醋酸、钠盐、钾盐、钡盐在溶液中反应,符合离子方程式2H++=H2O+SO2↑的化学方程式的个数有
A.3 B.4 C.8 D.12
二、填空题
10.现有下列物质:① 晶体② Zn ③ 固体 ④ 溶液⑤固体⑥盐酸⑦固体⑧无水酒精⑨氨气
(1)能导电的是_______(填序号,下同);属于电解质的是_______;属于非电解质的是_______。
(2)写出③在水溶液中的电离方程式:_______。
(3)写出Cu与④反应的离子方程式:_______。
(4)写出③和⑤在水溶液中反应的离子方程式:_______。
(5)请预测,在含、和HCl的溶液中加入适量②,首先置换出来的是_______
A.Fe B. C.Mg D.不能确定
11.根据要求填写下列空白:
(1)对于下列A~D涉及的反应,填写空白:
A.
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.
D.
①仅体现氧化性的反应是(填代号)_______。
②既体现氧化性又体现还原性的反应是(填代号)_______。
③上述反应说明、、氧化性由强到弱的顺序是:_______。
(2)已知甲、乙、丙是三种可溶性物质,其中甲是碱,乙、丙是盐,它们溶于水后电离产生的所有离子如下表所示:
阳离子 、、
阴离子 、、
①甲的化学式为_______。
②乙溶液与丙溶液反应可生成气体,该反应的离子方程式为_______。
③乙、丙溶液与甲溶液反应可分别生成白色沉淀和,其中可溶于稀硝酸。丙的化学式为_______;写出乙溶液与甲两溶液按溶质物质的量比反应的离子方程式:_______。
12.用烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和溶液,加热至液体呈透明的红褐色。发生反应:(胶体)。
(1)所得胶体分散质微粒直径的范围是_______,持续加热或搅拌会使胶体发生_______。
(2)用光束照射胶体,能产生_______效应,在光的传播过程中,光线照射到粒子时,如果粒子略小于入射光波长,则发生光的散射,这时观察到的是光波环绕微粒而向其四周放射的光,观察到光亮的“通路”,已知可见光波长为400~700nm,则下列分散系均能产生这种效应的是_______。
A.淀粉溶液、NaOH溶液、浊液
B.溶液、牛奶、漂白粉溶液
C.溶液、胶体、石灰乳
D.胶体、碘化银胶体、淀粉溶液
(3)利用半透膜分离胶体中的杂质分子或离子,提纯、精制胶体的方法称为渗析。将混有的胶体倒入火棉胶袋(半透膜)内,用线系紧密封,放入装有蒸馏水的烧杯内,过一段时间后,取烧杯中的溶液滴加硝酸银溶液,观察到的现象是_______,写出发生反应的离子方程式_______。
三、工业流程题
13.城市污水中含有一定量的、/等,可以通过如下三个阶段协同作用实现自养脱氮。
(1)第一阶段。向污水中加入菌体和溶液,控制温度和pH,繁殖菌体并进行富集。基态核外电子排布式为_______。
(2)第二阶段。在菌体的作用下依次发生过程I、过程II,从而实现、的脱除,其过程如图所示。
①第二阶段的脱除过程可以描述为_______。
②若在第一阶段只添加溶液而不添加菌体,发现第二阶段污水中氨氮基本无变化,由此可以得出的结论是_______。
(3)第三阶段。在弱酸性条件下,与反应得到和,其反应的离子方程式为_______。
(4)城市污水中的可以用沉淀法除去。在搅拌下向污水中加入和溶液,再加入NaOH调节溶液的pH,一段时间后测得去除率与pH的关系如图所示。
①上述过程中生成沉淀,其反应的离子方程式为_______。
②当时,氨氮去除率随pH升高不断升高的原因是_______。
14.经检测,某化工厂排出的废水呈酸性,且其中含有大量,回答下列问题:
(1)下列离子中,能大量存在于该废水中的是___________(填字母)
A. B. C. D.
(2)取该废水于烧杯中,向烧杯中逐滴加入溶液至溶液呈碱性,此过程中,原废水中存在的离子的数目会发生变化的是、、___________(用离子符号表示)。
(3)某化学社团小组成员欲除去废水样品中的和,最终得到中性溶液,设计的方案流程如图所示。
①试剂a、b分别为___________(写化学式):“溶液3”所含的溶质阴离子主要有,___________(写离子符号)。
②“分离操作”的名称是___________。
③向“溶液1”中加入过量试剂c后,发生反应的离子方程式为___________。
15.氢氧化镍[Ni(OH)2]常用于制备金属镍及镍的重要化合物。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高氢氧化镍的工艺流程如图:
已知:H2S的电离常数K1=1.3×10-7,K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6。
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,还原产物为N2,金属镍溶解的离子方程式是_____。
(2)“除铁”加入Na2CO3时,生成黄钠铁矾(NaFe3(SO4)2(OH)6)的离子方程式是____;“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾沉淀对后续操作较为有利,原因是____。
(3)“除铜”时,反应的离子方程式为H2S+Cu2+=CuS+2H+,该反应平衡常数K=____。
(4)“除钙镁”过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_____。
(5)“沉镍”前c(Ni2+)=1.0mol/L,加入少量浓NaOH溶液,若忽略加入浓NaOH溶液对溶液体积的影响,则开始沉淀时溶液的pH=____。
四、元素或物质推断题
16.有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子和五种阴离子中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是_______和_______。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时,产生蓝色沉淀,向该沉淀中滴入稀,沉淀部分溶解,剩余白色固体,则X为_______(填序号)。
A. B. C. D.
(3)将19.2gCu投入装有足量D溶波的试管中,Cu不溶解,再滴加稀,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式_______。
(4)E溶液能使KI-淀粉试纸变蓝,该反应的离子方程式为_______。
参考答案:
1.A
【来源】湖南省部分学校2022-2023学年高二上学期期中考试化学试题
【详解】A.铜是单质,既不属于电解质也不属于非电解质,A正确;
B.氯化钠是化合物,其水溶液或熔融状态都能导电,氯化钠是电解质,B错误;
C.硫酸钡是化合物,其熔融状态能导电,硫酸钡是电解质,C错误
D.一氧化碳是非电解质,D错误;
故选A。
2.D
【来源】四川省成都市第七中学2022-2023学年高二上学期期中考试(理科)化学试题
【详解】A 为弱酸根离子, 在强酸性溶液中因发生 而不能大量共存, 选项A错误;
B. 对 的分解具有催化作用, 则 和 不能大量共存, 选项B 错误;
C. 在盐酸溶液中, 该组离子因发生 , 而不能大量共存, 选项C错误;
D. 离子间彼此均不反应, 可以大量共存, 选项D正确;
答案选D。
3.C
【来源】安徽省六安第一中学2022-2023学年高三上学期第二次月考化学试题
【详解】A.氨水中的NH3·H2O是弱碱,不能溶解Al(OH)3,反应的离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3,A错误;
B.铁离子可以氧化碘离子,则将Fe3O4固体溶于HI溶液中发生的离子反应为:Fe3O4 +2I-+ 8H+ = 3Fe2+ +I2+ 4H2O,B错误;
C.反应符合事实,遵循物质的拆分原则,C正确;
D.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液,要以不足量的Ba(OH)2为标准,假设其物质的量是2 mol,反应生成BaSO4沉淀、Al(OH)3沉淀、NH3·H2O,离子方程式为:,D错误;
故合理选项是C。
4.C
【来源】北京市丰台区2022-2023学年高一上学期期中考试化学(B卷)试题
【详解】A.碳酸氢根离子、碳酸根离子均与盐酸反应生成二氧化碳,则溶液中不一定含有,故A错误;
B.溶液中含有硫酸根离子也可以生成硫酸银白色沉淀,则不一定含有Cl-,故B错误;
C.钠元素的焰色反应为黄色,说明含有钠离子,故C正确;
D.加入氯化钡也可能生成氯化银沉淀或碳酸钡沉淀等,不一定含有硫酸根离子,故D错误;
故选C。
5.A
【来源】重庆外国语学校2022-2023学年高一上学期期中测试化学试题
【详解】A.少量的NH4HSO4与KOH溶液发生反应为NH+H++2OH-=NH3·H2O+H2O,少量的NaOH溶液与NH4HSO4溶液发生反应为H++OH-=H2O,故A符合题意;
B.两个反应的离子方程式均为,故B不符合题意;
C.两个反应的离子方程式均为,故C不符合题意;
D.两个反应的离子方程式均为H++OH-=H2O,故D不符合题意;
故选A。
6.B
【来源】重庆外国语学校2022-2023学年高一上学期期中测试化学试题
【详解】A.NaHSO4在熔融状态下电离产生钠离子和硫酸氢根,电离方程式正确,A正确;
B.氢氧化铁为弱碱,水溶液中电离方程式用可逆符号,B错误;
C.明矾的化学式正确,C正确;
D.苏打是碳酸钠,D正确;
故选B。
7.B
【来源】湖北省沙市中学2022-2023学年高一上学期第二次月考化学试题
【详解】A.氯气与水反应生成盐酸和次氯酸,反应的离子方程式是Cl2+H2O = H++Cl-+HClO,故A错误;
B.Ca(OH)2溶液与少量NaHCO3溶液反应生成碳酸钙沉淀、氢氧化钠、水,反应的离子方程式为,故B正确;
C.醋酸滴在大理石上生成醋酸钙、二氧化碳、水,反应的离子方程式是2CH3COOH + CaCO3=Ca2+ + CO2↑+ H2O+2CH3COO-,故C错误;
D.向漂白粉溶液中通入足量二氧化碳生成碳酸氢钙、次氯酸,反应的离子方程式为ClO-+CO2+H2O=HCO+HClO,故D错误;
选B。
8.C
【来源】河南省安阳市2022--2023学年高一上学期期中考试化学试题
【详解】A.淀粉溶液遇碘单质变蓝,I-不能检验淀粉,故A错误;
B.CO2在水溶液和熔融状态下都不能导电,属于非电解质,故B错误;
C.二氧化碳合成淀粉可减少空气中二氧化碳的含量,能为实现“碳中和”提供一种新思路,故C正确;
D.二氧化碳气体会造成温室效应,但造成酸雨的气体是SO2等气体,不能有效遏制酸雨的产生,故D错误;
故选:C。
9.C
【来源】浙江省玉环市玉城中学2022-2023学年高一上学期第一次月考化学试题
【详解】亚硫酸的钾盐、钠盐、钡盐中,BaSO3不溶于水,离子方程式中不能用表示,其余在溶液中均可用表示;三种酸中,醋酸是弱酸,离子方程式中不能用H+表示,符合离子方程式2H++-═SO2↑+H2O,存在两种盐(钾盐、钠盐)与两种酸(盐酸、硫酸)可组合出4个反应,且离子方程式相同;此外硫酸氢钠、硫酸氢钾为强酸的酸式盐,完全电离,与亚硫酸钠、亚硫酸钾,可组合出4个反应,且离子方程式相同,共有8个离子方程式相同的反应,故选C。
10.(1) ②④⑥ ①③⑤⑦ ⑧⑨
(2)NaHCO3=Na++HCO
(3)
(4)HCO +H+=H2O+CO2↑
(5)B
【来源】重庆市杨家坪中学2022-2023学年高一上学期第一次月考化学试题
【分析】①晶体属于化合物,不导电、其水溶液或熔融状态能导电、因此属于电解质;
②Zn能导电、是单质,既不属于电解质也不属于非电解质
③固体属于化合物,不导电、其水溶液能导电、因此属于电解质;
④溶液能导电、是混合物,既不属于电解质也不属于非电解质
⑤固体属于化合物,不导电、其水溶液或熔融状态能导电、因此属于电解质;
⑥盐酸能导电、是混合物,既不属于电解质也不属于非电解质
⑦固体属于化合物,不导电、其水溶液或熔融状态能导电、因此属于电解质;
⑧无水酒精非电解质、不导电;
⑨氨气是非电解质、其水溶液能导电。
【详解】(1)能导电的是②④⑥;属于电解质的是①③⑤⑦;属于非电解质的是⑧⑨。
(2)③即NaHCO3在水溶液中完全电离为Na+、HCO电离方程式:NaHCO3=Na++HCO。
(3)Cu与④即溶液发生置换反应,离子方程式:。
(4)③和⑤在水溶液中反应,即与溶液反应生成硫酸钠、水和二氧化碳,离子方程式:HCO +H+=H2O+CO2↑。
(5)在含、和HCl的溶液中加入适量②即锌,存在亚铁离子、镁离子和氢离子均具有一定氧化性,则氧化性强的氢离子优先反应,则首先置换出来的是,选B。
11.(1) D C Ag2O > H2O2 > K2CrO4
(2) Ba(OH)2 2H++CO=H2O+CO2↑ Na2CO3 Ba2++OH-+H++SO=BaSO4↓+H2O
【来源】山东省枣庄市第八中学2022-2023学年高一上学期第一次月考化学试题
【详解】(1)A.Na2O2+2HCl=2NaCl+H2O2中无元素化合价变化,为非氧化还原反应;
B.Ag2O+H2O2=2Ag+O2↑+H2O中,H2O2中O元素的化合价升高,H2O2作还原剂;
C.2H2O2=2H2O+O2↑中O元素的化合价既升高又降低,则既体现氧化性又体现还原性;
D.3H2O2+Cr2 (SO4 )3+10KOH=2K2CrO4+3K2SO4+8H2O中,H2O2中只有O元素的化合价降低,则H2O2作氧化剂,体现氧化性;
①根据分析,H2O2仅体现氧化性的反应为D;
②根据分析可知,H2O2既体现氧化性又体现还原性的反应是C;
③由B反应可知,Ag2O为氧化剂,H2O2为还原剂,根据氧化剂的氧化性大于还原剂,即氧化性 Ag2O>H2O2;由C反应可知,H2O2为氧化剂,K2CrO4为氧化产物,根据氧化剂氧化性大于氧化产物,即氧化性H2O2>K2CrO4,综上分析可知,氧化性由强到弱的顺序是:Ag2O> H2O2>K2CrO4;
(2)由于Ba2+和、都不能大量共存,且甲是碱,故甲为Ba(OH)2,另外乙、丙是盐,根据电离出的阳离子和阴离子可知,乙和丙为Na2CO3和NaHSO4中的一种,据此分析;
①由上述分析可知,甲的化学式为Ba(OH)2;
②由分析可知,乙溶液与丙溶液反应即Na2CO3和NaHSO4反应,可生成气体为CO2,该反应的离子方程式为:2H++=H2O+CO2↑;
③乙、丙溶液与甲溶液反应可分别生成白色沉淀即BaCO3和BaSO4,其中B可溶于稀硝酸,则B为BaCO3,则丙的化学式为Na2CO3,乙为NaHSO4,故乙与甲两溶液按溶质物质的量比1:1反应的离子方程式为:Ba2++OH-++H+=BaSO4↓+H2O。
12.(1) 1~100nm 聚沉
(2) 丁达尔 D
(3) 白色沉淀
【来源】福建省南平市高级中学2022-2023学年高一上学期期中考试化学试题
【详解】(1)氢氧化铁胶体中分散质微粒直径范围是1-100nm;持续加热,胶体会发生聚沉;
(2)光束照射胶体,胶体能产生丁达尔效应;
A. 淀粉溶液为胶体,NaOH溶液、浊液不是胶体,A不符合;
B. 溶液、漂白粉溶液不是胶体,牛奶是胶体,B不符合;
C. 溶液、石灰乳不是胶体,胶体是胶体,C不符合;
D. 胶体、碘化银胶体、淀粉溶液全部是胶体,能产生丁达尔效应,D符合;
故选D;
(3)胶体不能通过半透膜,溶液能通过半透膜,故放置一段时间后,烧杯中含MgCl2,半透膜内为胶体,烧杯中滴加硝酸银溶液后,有白色沉淀,离子方程式为:。
13.(1)或
(2) 在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成 没有菌体,在本实验条件下与不会发生化学反应
(3)
(4) 随着pH的增大,转化为,使的浓度增大,生成沉淀的反应速率加快,导致的去除率不断升高
【来源】江苏省连云港市2022-2023学年高三上学期期中调研考试化学试题
【分析】第一阶段。向污水中加入菌体和溶液,控制温度和pH,繁殖菌体并进行富集。第二阶段,在菌体的作用下依次发生在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成,从而实现、的脱除,第三阶段。在弱酸性条件下,与反应得到和,最后得到净化水。
【详解】(1)铁是26号元素,基态核外电子排布式为或。故答案为:或;
(2)①第二阶段的脱除过程可以描述为在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成。故答案为:在菌体的作用下,污水中的将部分氧化成、,随后再将余下的氧化成;
②若在第一阶段只添加溶液而不添加菌体,发现第二阶段污水中氨氮基本无变化,由此可以得出的结论是没有菌体,在本实验条件下与不会发生化学反应。故答案为:没有菌体,在本实验条件下与不会发生化学反应;
(3)第三阶段。亚铁离子具有还原性,在弱酸性条件下,与反应得到和,其反应的离子方程式为。故答案为:;
(4)①加入NaOH调节溶液的pH,溶液中氢被中和,与镁离子结合生成沉淀,其反应的离子方程式为。故答案为:;
②当时,氨氮去除率随pH升高不断升高的原因是随着pH的增大,转化为,使的浓度增大,生成沉淀的反应速率加快,导致的去除率不断升高,故答案为:随着pH的增大,转化为,使的浓度增大,生成沉淀的反应速率加快,导致的去除率不断升高。
14.(1)B
(2)
(3) NaOH和 过滤
【来源】广东省珠海市第二中学2022-2023学年高一上学期11月期中考试化学试题
【分析】根据所得蓝色沉淀1,可知该蓝色沉淀为,所加试剂为NaOH溶液,其分离操作为过滤;除去常用钡盐,可用溶液,再用溶液除去多余的,过滤得到白色沉淀硫酸钡和碳酸钡,溶液2中含有NaOH和,用适量盐酸除去NaOH和调pH=7,即得到中性溶液。
【详解】(1)(1)A.与氯离子反应生成难溶的沉淀,不能共存,故A错误;
B.与均不反应,能共存,故B正确;
C.与反应生成难溶的沉淀,不能共存,故C错误;
D.与能反应,不能共存,故D错误;
故填B。
(2)(2) 取该废水于烧杯中,向烧杯中逐滴加入溶液至溶液呈碱性,除了、外,因与反应而使数目减少,故填;
(3)(3)①根据所得蓝色沉淀1,可知该蓝色沉淀为,所加试剂为NaOH溶液,其分离操作为过滤;除去常用钡盐,可用溶液;溶液3中除了含有外,因没有参与反应,还含有,故填NaOH和、
②分离操作后得到溶液和固体,所以该操作为过滤,故填过滤;
③试剂c主要用于除去多余的,试剂c为溶液,其反应的离子方程式为,故填。
15.(1)5Ni+12H++2NO=5Ni2++N2↑+6H2O
(2) Na++3Fe3++2SO+3H2O+3CO=NaFe3(SO4)2(OH)6↓+3CO2↑或Na++3Fe3++2SO+6H2O+6CO=NaFe3(SO4)2(OH)6↓+6HCO 沉降速率快,容易过滤等
(3)1.54×1014
(4)过量的F-生成氢氟酸会腐蚀陶瓷容器
(5)6.2
【来源】福建省莆田第一中学2022-2023学年高三上学期期中考试化学试题
【分析】废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入硫酸和硝酸酸溶,合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,溶解Ni,过滤除去废渣,滤液中加入过氧化氢,氧化亚铁离子为铁离子,加入碳酸钠调节溶液pH除去铁离子,过滤得到滤渣和滤液,滤液中加入H2S沉淀铜离子,过滤得到滤液中加入NaF用来除去镁离子和钙离子,过滤得到滤液中主要是镍离子,加入氢氧化钠溶液沉淀镍离子生成氢氧化镍固体,以此解答该题。
【详解】(1)镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平化学方程式为5Ni+12H++2NO=5Ni2++N2↑+6H2O,故答案为5Ni+12H++2NO=5Ni2++N2↑+6H2O;
(2)得到黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀离子方程式是Na++3Fe3++2SO+3H2O+3CO=NaFe3(SO4)2(OH)6↓+3CO2↑或Na++3Fe3++2SO+6H2O+6CO=NaFe3(SO4)2(OH)6↓+6HCO,沉淀颗粒较大,沉淀速率快且容易过滤,故答案为:Na++3Fe3++2SO+3H2O+3CO=NaFe3(SO4)2(OH)6↓+3CO2↑或Na++3Fe3++2SO+6H2O+6CO=NaFe3(SO4)2(OH)6↓+6HCO;沉淀速率快,容易过滤;
(3)“除铜”时,反应的离子方程式为H2S+Cu2+=CuS↓+2H+,该反应平衡常数,故答案为1.54×1014;
(4)NaF用量不宜过大,会有HF产生,腐蚀陶瓷容器,故答案为过量的F-生成氢氟酸会腐蚀陶瓷容器;
(5)沉镍”前c(Ni2+)=1.0mol/L,根据溶度积常数可知开始沉淀时溶液中氢氧根离子的浓度是,所以pH=14 7.8=6.2,故答案为6.2。
【点睛】本题以氢氧化镍的制备为背景,考查了学生有关氧化还原反应,物质分离提纯,沉淀溶解平衡,离子水解等内容,其中涉及平衡常数计算,pH计算。
16.(1) K2CO3 Ba(OH)2
(2)B
(3)3Cu+8H++2NO=3Cu2++2NO↑+4H2O
(4)2Fe3++2I﹣=2Fe2++I2
【来源】河南省许昌市建安区2022-2023学年高一上学期阶段测试(二)化学试题
【详解】(1)五种均为可溶性物质,所以必含有K2CO3,因CO与另外四种阳离子形成的物质都是难溶物;由此可知必含有Ba(OH)2,因OH-与另三种阳离子形成的物质都是难溶物;
(2)A与C混合产生的蓝色沉淀,则该沉淀必含氢氧化铜,该沉淀加入稀硝酸,沉淀部分溶于稀硝酸,且剩余一种不溶于稀硝酸的白色沉淀,则不溶的沉淀为硫酸钡,所以A为Ba(OH)2、C为CuSO4,则X为;
(3)由于Cu未溶解,加稀硫酸后管口附近有红棕色气体出现,说明该物质含有硝酸根离子,同时根据E溶液能使KI-淀粉试纸变蓝,E含有铁离子,所以D为Al(NO3)3,Cu和稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)E溶液能使KI-淀粉试纸变蓝,则E为FeCl3,铁离子可以氧化碘离子为碘单质,该反应的离子方程式2Fe3++2I-=2Fe2++I2。
试卷第6页,共7页
试卷第7页,共7页
