2-1-3.氧化还原反应
图片预览










文档简介
课件30张PPT。感受氧化还原反应的存在 刚削好的苹果放置30分钟以后的苹果刚泡好的绿茶放置2小时后的绿茶感受氧化还原反应的存在 感受氧化还原反应的存在 好吃的月饼幕后的英雄感受氧化还原反应的存在 铁生锈专题2 从海水中获得的化学物质◆◆◆第一单元 氯 溴 碘及其化合物◆◆◆§2-1-3. 氧化还原反应课堂练兵1.用化合价升降的观点去判断下面的反应哪些是氧化还原反应?①MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
②2KClO3 2KCl+3O2↑
③H2+ Cl2 2HCl
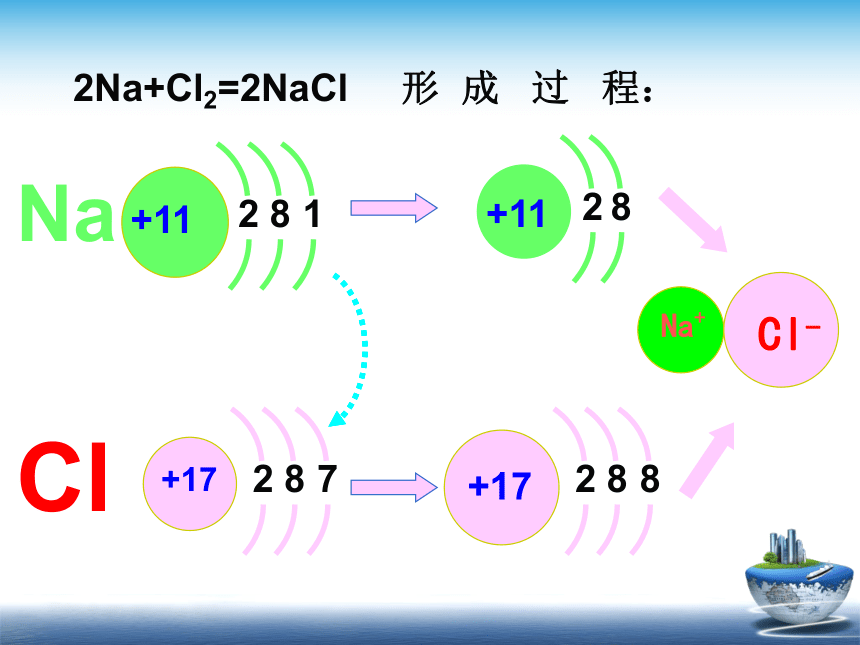
④NaCl固+H2SO4浓==NaHSO4+HClMnO2点燃+4-1+20+5-2-1000+1-1◆◆◆ §2-1-3.氧化还原反应◆◆◆2Na+Cl2=2NaCl 形 成 过 程:H2+Cl2=2HCl 的形成过程:◆◆◆ §2-1-3.氧化还原反应◆◆◆一.氧化还原反应1.定义:凡是有电子转移的化学反应,叫氧化还原反应2.特征:反应前后化合价发生变化(也是判断依据)3.实质:电子发生转移(得失或偏移)有电子转移的
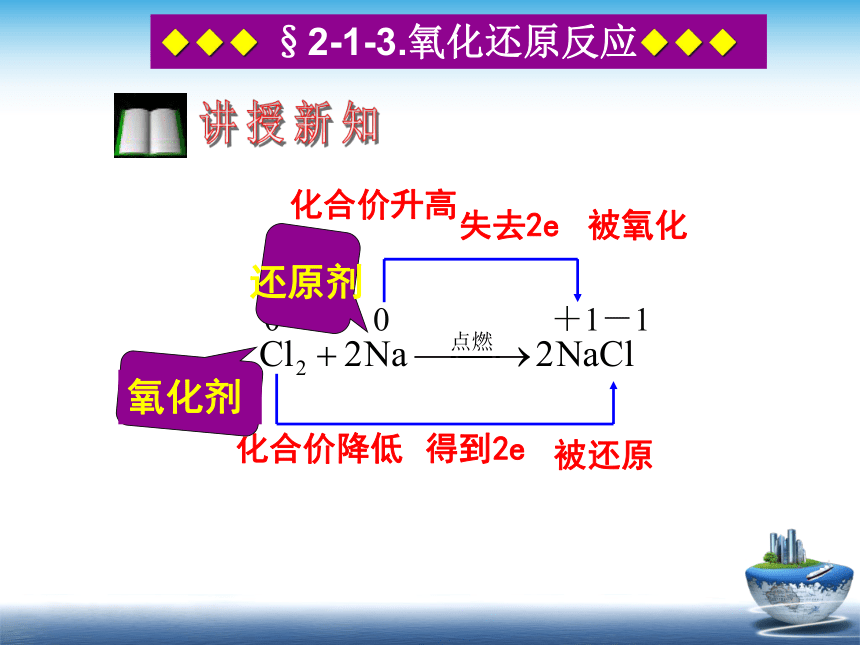
化学反应都是氧化还原反应。00+1-1 化合价降低被还原化合价升高被氧化失去2e得到2e还原剂◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知反应物中失去电子(元素化合价升高)的物质—被氧化◆◆◆ §2-1-3.氧化还原反应◆◆◆二.氧化剂和还原剂1. 定义:反应物中得到电子(元素化合价降低)的物质—被还原氧化剂:还原剂:◆◆◆ §2-1-3.氧化还原反应◆◆◆二.氧化剂和还原剂说明:①.氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。②.氧化剂本身被还原,发生还原反应,得到的产物是还原产物③.还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。氧化剂还原剂得到电子,被还原失去电子,被氧化◆◆◆ §2-1-3.氧化还原反应◆◆◆-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 ◆◆◆ §2-1-3.氧化还原反应◆◆◆2.化合价升降与得失电子的关系
例2:2HCl+Fe =FeCl2+H2↑
氧化剂 还原剂
元素被氧化 元素被还原 +1 0 +2 0课堂练兵HClFeFeCl◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知三.氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元 素化合价升高)生成物。
还原产物:氧化剂得到电子生成的物质—(元素化合价降低)生成物。还原剂氧化产物氧化剂还原产物◆◆◆ §2-1-3.氧化还原反应◆◆◆例3:MnO2+4HCl(浓) = MnCl2+Cl2 +2H2O
氧化剂 还原剂
被氧化 被还原
氧化产物 还原产物课堂练兵+4+2MnO2HClHClMnO2Cl2MnCl2◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知氧化剂+还原剂=氧化产物+还原产物化合价降低,得到电子,被还原,发生还原反应化合价升高,失去电子,被氧化,发生氧化反应◆◆◆ §2-1-3.氧化还原反应◆◆◆课堂练兵◆◆◆ §2-1-3.氧化还原反应◆◆◆四.氧化还原反应得失电子的表示方法——双线桥法例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑1.正确判断各反应物、生成物各元素的化合价及其变化。0 +1 +3 0◆◆◆ §2-1-3.氧化还原反应◆◆◆步骤:四.氧化还原反应得失电子的表示方法——双线桥法例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。0 +1 +3 0◆◆◆ §2-1-3.氧化还原反应◆◆◆步骤:四.氧化还原反应得失电子的表示方法——双线桥法例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑3.电子符号用“e-”来表示。
4.得失电子总数表示:原子个数 × 每个原子得失电子数。0 +1 +3 0化合价升高,失2 ×3e-化合价降低,得3 ×2e-◆◆◆ §2-1-3.氧化还原反应◆◆◆步骤:注意:反应中失去电子的总数等于得到电子的总数氧化还原反应的一些规律同种元素:低价高价……………………××氧化还原反应的一些规律-2 在H2S+H2SO4(浓)==S↓+SO2↑+2H2O反应中:
S→S,S→S,氧化产物是S,还原产物是SO2。故 ②正确。
另一个反应中KClO3+6HCl==KCl+3Cl2↑+3H2O,
Cl→Cl, Cl→Cl,氧化产物与还原产物均为Cl2,故②正确。-2+6+600000+4+4+5-1+5-1-1讲授新知(1)原子或离子的得电子能力越强,物质氧化性越强。
(2)原子或离子的失电子能力越强,物质还原性越强。◆◆◆ §2-1-3.氧化还原反应◆◆◆五. 氧化性、还原性强弱判断强调:物质氧化性或还原性的强弱由
得失电子难易决定,与得失电子多少无关讲授新知3.以反应物,产物之间的关系判断。
氧化剂+还原剂=还原产物+氧化产物。则
氧化性:氧化剂>氧化产物,
还原性:还原剂>还原产物。
◆◆◆ §2-1-3.氧化还原反应◆◆◆五. 氧化性、还原性强弱判断例:K2CrO7+14HCI(浓)=2KCI+CrCI3+CI2↑+7H2O 判断在酸条件下,
氧化性:K2CrO7 CI2 ,还原性:HCI CrCI3◆◆◆ §2-1-3.氧化还原反应◆◆◆巩固练习-1 0 +1 +3 +5 +7
Cl -- Cl -- Cl -- Cl --Cl -- ClHCl Cl2 HClO HClO3 KClO3 HClO4只能做还原剂只能做氧化剂既能做氧化剂,又能做还原剂◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知五. 氧化性、还原性强弱判断讲授新知(1)元素的(原子或离子)化合价处于最高价,只能作氧化剂,具有氧化性
(2)元素的(原子或离子)化合价处于最低价,只能作还原剂,具有还原化性
(3)元素的(原子或离子)化合价处于中间价,既可以作氧化剂,又可以作还原剂,既有氧化性,又有还原化性◆◆◆ §2-1-3.氧化还原反应◆◆◆五. 氧化性、还原性强弱判断单质的还原性越强,对应的离子的氧化性越弱单质的氧化性越强,对应的离子的还原性越弱金属活动性顺序还原性:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au氧化性:K+
②2KClO3 2KCl+3O2↑
③H2+ Cl2 2HCl
④NaCl固+H2SO4浓==NaHSO4+HClMnO2点燃+4-1+20+5-2-1000+1-1◆◆◆ §2-1-3.氧化还原反应◆◆◆2Na+Cl2=2NaCl 形 成 过 程:H2+Cl2=2HCl 的形成过程:◆◆◆ §2-1-3.氧化还原反应◆◆◆一.氧化还原反应1.定义:凡是有电子转移的化学反应,叫氧化还原反应2.特征:反应前后化合价发生变化(也是判断依据)3.实质:电子发生转移(得失或偏移)有电子转移的
化学反应都是氧化还原反应。00+1-1 化合价降低被还原化合价升高被氧化失去2e得到2e还原剂◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知反应物中失去电子(元素化合价升高)的物质—被氧化◆◆◆ §2-1-3.氧化还原反应◆◆◆二.氧化剂和还原剂1. 定义:反应物中得到电子(元素化合价降低)的物质—被还原氧化剂:还原剂:◆◆◆ §2-1-3.氧化还原反应◆◆◆二.氧化剂和还原剂说明:①.氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。②.氧化剂本身被还原,发生还原反应,得到的产物是还原产物③.还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。氧化剂还原剂得到电子,被还原失去电子,被氧化◆◆◆ §2-1-3.氧化还原反应◆◆◆-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 ◆◆◆ §2-1-3.氧化还原反应◆◆◆2.化合价升降与得失电子的关系
例2:2HCl+Fe =FeCl2+H2↑
氧化剂 还原剂
元素被氧化 元素被还原 +1 0 +2 0课堂练兵HClFeFeCl◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知三.氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元 素化合价升高)生成物。
还原产物:氧化剂得到电子生成的物质—(元素化合价降低)生成物。还原剂氧化产物氧化剂还原产物◆◆◆ §2-1-3.氧化还原反应◆◆◆例3:MnO2+4HCl(浓) = MnCl2+Cl2 +2H2O
氧化剂 还原剂
被氧化 被还原
氧化产物 还原产物课堂练兵+4+2MnO2HClHClMnO2Cl2MnCl2◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知氧化剂+还原剂=氧化产物+还原产物化合价降低,得到电子,被还原,发生还原反应化合价升高,失去电子,被氧化,发生氧化反应◆◆◆ §2-1-3.氧化还原反应◆◆◆课堂练兵◆◆◆ §2-1-3.氧化还原反应◆◆◆四.氧化还原反应得失电子的表示方法——双线桥法例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑1.正确判断各反应物、生成物各元素的化合价及其变化。0 +1 +3 0◆◆◆ §2-1-3.氧化还原反应◆◆◆步骤:四.氧化还原反应得失电子的表示方法——双线桥法例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。0 +1 +3 0◆◆◆ §2-1-3.氧化还原反应◆◆◆步骤:四.氧化还原反应得失电子的表示方法——双线桥法例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑3.电子符号用“e-”来表示。
4.得失电子总数表示:原子个数 × 每个原子得失电子数。0 +1 +3 0化合价升高,失2 ×3e-化合价降低,得3 ×2e-◆◆◆ §2-1-3.氧化还原反应◆◆◆步骤:注意:反应中失去电子的总数等于得到电子的总数氧化还原反应的一些规律同种元素:低价高价……………………××氧化还原反应的一些规律-2 在H2S+H2SO4(浓)==S↓+SO2↑+2H2O反应中:
S→S,S→S,氧化产物是S,还原产物是SO2。故 ②正确。
另一个反应中KClO3+6HCl==KCl+3Cl2↑+3H2O,
Cl→Cl, Cl→Cl,氧化产物与还原产物均为Cl2,故②正确。-2+6+600000+4+4+5-1+5-1-1讲授新知(1)原子或离子的得电子能力越强,物质氧化性越强。
(2)原子或离子的失电子能力越强,物质还原性越强。◆◆◆ §2-1-3.氧化还原反应◆◆◆五. 氧化性、还原性强弱判断强调:物质氧化性或还原性的强弱由
得失电子难易决定,与得失电子多少无关讲授新知3.以反应物,产物之间的关系判断。
氧化剂+还原剂=还原产物+氧化产物。则
氧化性:氧化剂>氧化产物,
还原性:还原剂>还原产物。
◆◆◆ §2-1-3.氧化还原反应◆◆◆五. 氧化性、还原性强弱判断例:K2CrO7+14HCI(浓)=2KCI+CrCI3+CI2↑+7H2O 判断在酸条件下,
氧化性:K2CrO7 CI2 ,还原性:HCI CrCI3◆◆◆ §2-1-3.氧化还原反应◆◆◆巩固练习-1 0 +1 +3 +5 +7
Cl -- Cl -- Cl -- Cl --Cl -- ClHCl Cl2 HClO HClO3 KClO3 HClO4只能做还原剂只能做氧化剂既能做氧化剂,又能做还原剂◆◆◆ §2-1-3.氧化还原反应◆◆◆讲授新知五. 氧化性、还原性强弱判断讲授新知(1)元素的(原子或离子)化合价处于最高价,只能作氧化剂,具有氧化性
(2)元素的(原子或离子)化合价处于最低价,只能作还原剂,具有还原化性
(3)元素的(原子或离子)化合价处于中间价,既可以作氧化剂,又可以作还原剂,既有氧化性,又有还原化性◆◆◆ §2-1-3.氧化还原反应◆◆◆五. 氧化性、还原性强弱判断单质的还原性越强,对应的离子的氧化性越弱单质的氧化性越强,对应的离子的还原性越弱金属活动性顺序还原性:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au氧化性:K+
