综合复习与测试-2022-2023学年九年级化学上册同步精品课堂(课件21页)(鲁教版)
文档属性
| 名称 | 综合复习与测试-2022-2023学年九年级化学上册同步精品课堂(课件21页)(鲁教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 10:50:36 | ||
图片预览






文档简介
(共21张PPT)
综合复习与测试
九年级化学上册
一、选择题
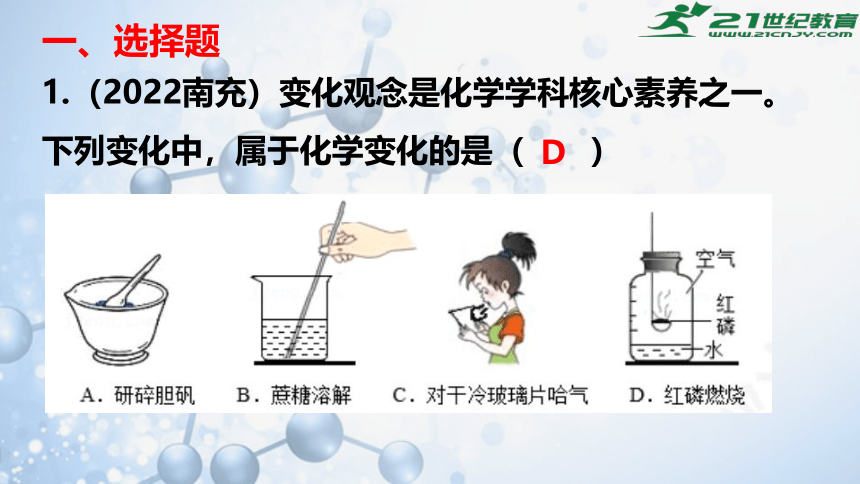
1.(2022南充)变化观念是化学学科核心素养之一。下列变化中,属于化学变化的是( )
D
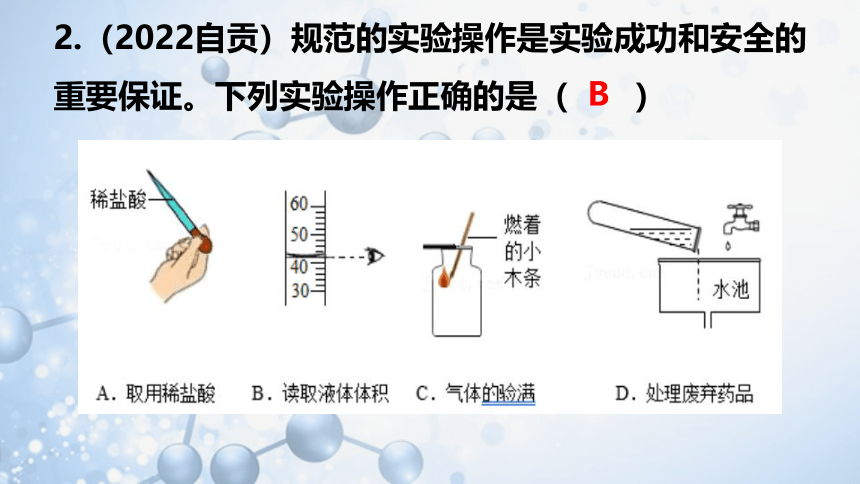
2.(2022自贡)规范的实验操作是实验成功和安全的重要保证。下列实验操作正确的是( )
B
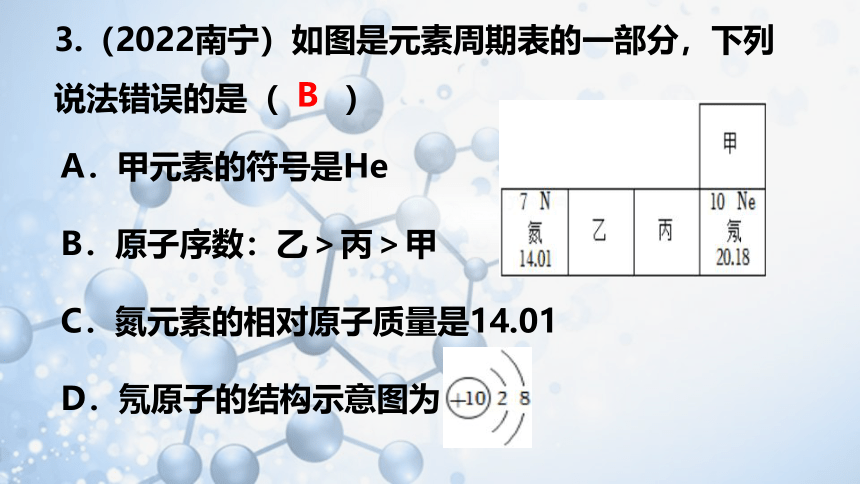
3.(2022南宁)如图是元素周期表的一部分,下列说法错误的是( )
A.甲元素的符号是He
B.原子序数:乙>丙>甲
C.氮元素的相对原子质量是14.01
D.氖原子的结构示意图为
B
4.(2022宜昌)下列各图中●和〇表示不同元素的原子,其中不能表示纯净物的是( )
A.
B.
C.
D.
5.(2022河北)2021年河北省PM2.5平均浓度同比下降15.3%,改善幅度为“十三五”以来最高。下列举措不能改善空气质量的是( )
A.开发利用新能源 B.推进低碳交通运输
C.提高森林覆盖率 D.增高炼铁厂的烟囱
B
D
6.(2022衡阳)大米、面粉、豆类等,在温度为30℃﹣80℃,相对湿度超过80%时,容易发生霉变,滋生黄曲霉菌,其衍生物约有20种。其中以黄曲霉素B1的毒性最大,致癌性最强。黄曲霉素B1的化学式为C17H12O6,下列有关该物质的说法正确的是( )
A.黄曲霉素B1由35个原子构成
B.黄曲霉素B1中碳元素、氢元素、氧元素的质量之比是17:12:6
C.黄曲霉素B1中氧元素的质量分数最小
D.黄曲霉素B1由三种元素组成
D
7.(2022昆明)2021年12月9口,航天员翟志刚、王亚平、叶光富在中国“天和号”空间站进行“天宫课堂”第一课。水球光学实验中打入的“人造空气”与我们身边的空气成分含量基本相同,“人造空气”中氧气含量约为( )
A.78% B.21% C.0.94% D.0.03%
8.(2022天津)下列对实验现象的描述正确的是( )
A.硫在空气中燃烧发出蓝紫色火焰
B.氢气在空气中燃烧产生淡蓝色火焰
C.磷在空气中燃烧生成五氧化二磷
D.铁丝伸入盛有氧气的集气瓶中剧烈燃烧
B
B
9.(2022海南)项目式学习小组制作的简易
净水器(如图),下列说法正确的是( )
A.能对水进行杀菌消毒 B.能除去水中可溶性杂质
C.能把硬水转化为软水 D.能除去水中颜色和异味
10.(2022长沙)全面推进乡村振兴,大力发展农业生
产,农业上常用溶质质量分数为16%的氯化钠溶液来选
种。下列有关溶液的说法正确的是( )
A.溶液是混合物
B.溶液一定是无色的
C.均一、稳定的液体一定是溶液
D.植物油和水可以形成溶液
D
A
11.(2022齐齐哈尔)利用催化剂将工厂废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2催化剂X+H2O,X的化学式为( )
A.C B.CH4 C.CH3OH D.CH2O
12.(2022扬州)制取、收集CO2并验证相关性质,下列做法不正确的是( )
A.检查装置气密性
B.加入石灰石
C.收集CO2
D.验证CO2不支持燃烧
C
B
二、填空题
13.(2022鸡西)请用化学用语填空:
(1)地壳中含量最高的金属元素 ;
(2)2个二氧化硫分子 ;
(3)与 对应的粒子符号 ;
(4)标出氧化镁中镁元素的化合价 ;
(5)2N2中的前面“2”表示 ;右下角“2”表示 。
Al
2SO2
Na+
MgO
两个氮分子
一个氮分子中有两个氮原子
+2
14.(2022湖北)图1是溴元素在元素周期表中的相关信息及原子结构示意图,图2是四种粒子的结构示意图。请回答:
(1)图1中x= 。
(2)图2中的粒子对应的元素共有 种。
(3)已知溴化镁由离子构成。根据以上信息,请写出溴化镁的化学式 。
18
12
MgBr2
15.(2022云南)2022年3月22日是第三十届“世界水日”,
其主题为“珍惜地下水,珍视隐藏的资源”。
(1)地下水是 (填“混合物”或“纯净物”)。
(2)实验室制取蒸馏水时,在烧瓶中加入几粒沸石或碎瓷片
的目的是 。实验结束,可加入 比较
水蒸馏前后的硬度变化。
(3)宇航员一部分生活用氧可通过电解水制得。如图1是电
解水的实验示意图,玻璃管 (填“a”或“b”)中的
气体能使带火星的木条复燃。该实验说明水是由 组成的。
(4)机场、车站等公共场所设有许多直
饮水机,能将自来水进一步净化处理得到
可直接饮用水,其处理水的过程如图2所
示。吸附罐中固体颗粒的主要作用是吸附
杂质,固体颗粒可选用 ,紫外线灯管照射的作用是 。
(5)图3是我国“国家节水标志”,用一句话谈谈你对该标志的理解或
得到的启示 。
混合物
防止暴沸
肥皂水
b
氢元素与氧元素
活性炭
杀菌消毒
“国家节水标志”,是由水滴、人手和地球变形而成。绿色的圆形代表地球,象征节约用水是保护地球生态的重要措施。标志留白部分像一只手托起一滴水,手是拼音字母JS的变形,寓意节水,表示节水需要公众参与,人人动手,节约每一滴水(合理即可)。
16.(2022金华)学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯
中分别加入50g、25g、5g同种固体
物质,充分溶解后,静置,现象如图
所示。回答下列问题:
(1)小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是 ;
(2)A、B、C三只烧杯中,溶液的溶质质量分数大小关系是 。
A烧杯中的固体物质没有完全溶解
A≥B>C
17.(2022黑龙江)如图,验证燃烧的条件、灭火原理和二氧化碳的性质实验。
(1)实验一,铜片上的白磷燃
烧而红磷不燃烧说明可燃物燃烧
需要的条件之一是 。
(2)实验二,A烧杯中蜡烛一段时间后熄灭,灭火的原理是
。
(3)实验三,A和B的软塑料瓶体积相同且充满CO2,将A瓶盖打开,加入体积约为塑料瓶容积的蒸馏水,旋紧瓶盖后充分振荡;向B中注入等体积的蒸馏水,充分振荡,观察到A瓶的实验现象是
,B瓶无明显变化,其原因是 。
温度达到可燃物的着火点
隔绝氧气
瓶子变瘪
1体积水约能溶解1体积的二氧化碳,瓶内压强保持不变
18.(2022宜昌)氧气是人类不可离开的物质。根据下列装置图回答问题。
(1)实验室用氯酸钾制氧气的化学方程式
为 ,其发生装置
可选用 (填字母序号,下同);用C
装置收集氧气前,将集气瓶内空气完全排尽
的方法是 。
(2)某同学欲按图F所示方法做细铁丝燃烧的实验,收集所需氧气最好选用的装置是
;做硫燃烧实验,收集所需氧气最好选用的装置是 。由此可见,选择气体的收集方法主要应考虑气体的性质,此外往往还要考虑 。
(3)如图所示,利用红磷与空气中的氧气反应验证质量守恒定律。
①用红热的玻璃管引燃红磷,其燃烧过程中能观察到的现象是
,反应的化学方程式为 。
②待红磷熄灭后再次称量,天平不再平衡,其原因可能是 。
A.装置漏气 B.用橡胶塞塞紧锥形瓶速度太慢
C.红磷太少 D.没有等锥形瓶冷却就再次称量
2KClO32KCl + 3O2↑
A
将集气瓶装满水
D
C
操作是否优化
产生大量白烟、放出热量、气球胀大
4P + 5O2 点燃 2P2O5
ABD
三、实验题
19.(2022永州)创新是社会进步的不竭动力。某化学兴趣小组设计了制取氧气和燃烧条件探究的创新实验。如图:
查阅资料:①白磷的着火点为40℃;
②P2O5+6NaOH═2Na3PO4+3H2O
请回答下列问题:
(1)仪器a的名称是 。
(2)按图连接好装置,将注射器内简
向外拉出一段距离,装置C(装有水)
中导管内立即形成一段水柱,片刻后观察到导管中的水柱不下降,这一操作的目的是检查装置的 性。
(3)向装置A中分别装入适量H2O2溶液和少量MnO2粉末,装置B中小试管装入一小颗白磷,装置C中装入适量NaOH溶液,连接好装置,缓慢推送注射器,向锥形瓶内注入H2O2溶液,立即观察到锥形瓶内产生气泡,装置B中白磷不燃烧。装置A中发生反应的化学方程式是 。
(4)向装置B的仪器a中注入90℃热水,片刻,可观察到白磷会
(填写实验现象)。
(5)装置C的作用是 。
烧 杯
气 密
2H2O2 MnO2 2H2O+O2↑
剧烈燃烧,产生大量的白烟
吸收P2O5,防止污染环境
20.(2022江西)根据下图回答有关问题:
(1)图一中仪器①的名称是______。
(2)实验室用高锰酸钾制氧气,可从
图一中选择的发生装置是______(填序
号);使用装置D收集氧气时应从导管
口______(选填“a”或“b”)通入。
(3)实验室制二氧化碳的化学方程式为 。图一中,与装置A相比,选用装置B制二氧化碳的优点是______
。将产生的二氧化碳通入图二装置,观察到试纸Ⅰ不变色而试纸Ⅱ变红,饱和澄清石灰水变浑浊,据玻璃管中的现象可知二氧化碳的化学性质是 ;若试管中导管口有连续均匀的气泡冒出,但饱和澄清石灰水未变浑浊的原因是 。
酒精灯
C
b
2HCl + CaCO = CaCl + H O + CO ↑
可以
控制反应速率
能与水反应生成酸
二氧化碳中混有氯化氢气体
21.(2022齐齐哈尔)疫情防控期间常用到一种免洗手消毒凝胶,其中含有正丙醇(化学式为C3H8O)。请回答下列问题:
(1)正丙醇的相对分子质量为 。
(2)正丙醇中碳元素和氢元素的质量比为 (写出最简整数比)。
(3)6g正丙醇中氧元素的质量为 g。
【解析】
(1)正丙醇的相对分子质量为12×3+1×8+16=60;
(2)正丙醇(化学式为C3H8O)中,碳、氢元素的质量比为(12×3):(1×8)=9:2;
(3)6g正丙醇中氧元素的质量6g×16/60×100%=1.6g。
四、计算题
22.(2022杭州)某火力发电厂用石灰石为原料吸收废气中的二氧化硫,以防止污染环境,发生反应的化学方程式为:2CaCO3+2SO2+O2═2CaSO4+2CO2。若每天需要吸收0.64吨二氧化硫,则该发电厂每个月(按30天计)需要含碳酸钙为90%的石灰石多少吨?(杂质不参与反应)
【解析】设每天需要消耗CaCO3的质量为x
2CaCO3+O2+2SO2═2CaSO4+2CO2,
200 128
x 0.64t
200/128 = x/0.64t
x = 1t
1t/90%×30 = 33.3t
答:该发电厂每个月需要含碳酸钙为90%的石灰石33.3t。
23.(2022恩施州)中国禽蛋生产和消费居全球之首。好奇的小明在自家养鸡场捡到一个与平常不一样的“软壳蛋”后,采用定量实验法探析其形成的可能原因。取软壳清洗并干燥后,称得质量为4g,并在学校实验室开展实验,实验结果如图所示。(假设蛋壳中其它成分不与盐酸反应;已知正常蛋壳中碳酸钙的质量分数≥90%)。
(1)计算该软壳蛋中碳酸钙的质量分数
(写出计算过程)。
(2)该软壳蛋形成的可能原因是 。
【解析】(1)设参加反应的碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.1g
100/44 = x/1.1g
X = 2.5g
2.5g/4g×100%=62.5%。
(2)鸡蛋壳的主要成分是碳酸钙,该软壳蛋形成的可能原因是母鸡缺钙(合理即可)。
答:(1)计算该软壳蛋中碳酸钙的质量分数为62.5%;
(2)母鸡缺钙(合理即可)。
综合复习与测试
九年级化学上册
一、选择题
1.(2022南充)变化观念是化学学科核心素养之一。下列变化中,属于化学变化的是( )
D
2.(2022自贡)规范的实验操作是实验成功和安全的重要保证。下列实验操作正确的是( )
B
3.(2022南宁)如图是元素周期表的一部分,下列说法错误的是( )
A.甲元素的符号是He
B.原子序数:乙>丙>甲
C.氮元素的相对原子质量是14.01
D.氖原子的结构示意图为
B
4.(2022宜昌)下列各图中●和〇表示不同元素的原子,其中不能表示纯净物的是( )
A.
B.
C.
D.
5.(2022河北)2021年河北省PM2.5平均浓度同比下降15.3%,改善幅度为“十三五”以来最高。下列举措不能改善空气质量的是( )
A.开发利用新能源 B.推进低碳交通运输
C.提高森林覆盖率 D.增高炼铁厂的烟囱
B
D
6.(2022衡阳)大米、面粉、豆类等,在温度为30℃﹣80℃,相对湿度超过80%时,容易发生霉变,滋生黄曲霉菌,其衍生物约有20种。其中以黄曲霉素B1的毒性最大,致癌性最强。黄曲霉素B1的化学式为C17H12O6,下列有关该物质的说法正确的是( )
A.黄曲霉素B1由35个原子构成
B.黄曲霉素B1中碳元素、氢元素、氧元素的质量之比是17:12:6
C.黄曲霉素B1中氧元素的质量分数最小
D.黄曲霉素B1由三种元素组成
D
7.(2022昆明)2021年12月9口,航天员翟志刚、王亚平、叶光富在中国“天和号”空间站进行“天宫课堂”第一课。水球光学实验中打入的“人造空气”与我们身边的空气成分含量基本相同,“人造空气”中氧气含量约为( )
A.78% B.21% C.0.94% D.0.03%
8.(2022天津)下列对实验现象的描述正确的是( )
A.硫在空气中燃烧发出蓝紫色火焰
B.氢气在空气中燃烧产生淡蓝色火焰
C.磷在空气中燃烧生成五氧化二磷
D.铁丝伸入盛有氧气的集气瓶中剧烈燃烧
B
B
9.(2022海南)项目式学习小组制作的简易
净水器(如图),下列说法正确的是( )
A.能对水进行杀菌消毒 B.能除去水中可溶性杂质
C.能把硬水转化为软水 D.能除去水中颜色和异味
10.(2022长沙)全面推进乡村振兴,大力发展农业生
产,农业上常用溶质质量分数为16%的氯化钠溶液来选
种。下列有关溶液的说法正确的是( )
A.溶液是混合物
B.溶液一定是无色的
C.均一、稳定的液体一定是溶液
D.植物油和水可以形成溶液
D
A
11.(2022齐齐哈尔)利用催化剂将工厂废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2催化剂X+H2O,X的化学式为( )
A.C B.CH4 C.CH3OH D.CH2O
12.(2022扬州)制取、收集CO2并验证相关性质,下列做法不正确的是( )
A.检查装置气密性
B.加入石灰石
C.收集CO2
D.验证CO2不支持燃烧
C
B
二、填空题
13.(2022鸡西)请用化学用语填空:
(1)地壳中含量最高的金属元素 ;
(2)2个二氧化硫分子 ;
(3)与 对应的粒子符号 ;
(4)标出氧化镁中镁元素的化合价 ;
(5)2N2中的前面“2”表示 ;右下角“2”表示 。
Al
2SO2
Na+
MgO
两个氮分子
一个氮分子中有两个氮原子
+2
14.(2022湖北)图1是溴元素在元素周期表中的相关信息及原子结构示意图,图2是四种粒子的结构示意图。请回答:
(1)图1中x= 。
(2)图2中的粒子对应的元素共有 种。
(3)已知溴化镁由离子构成。根据以上信息,请写出溴化镁的化学式 。
18
12
MgBr2
15.(2022云南)2022年3月22日是第三十届“世界水日”,
其主题为“珍惜地下水,珍视隐藏的资源”。
(1)地下水是 (填“混合物”或“纯净物”)。
(2)实验室制取蒸馏水时,在烧瓶中加入几粒沸石或碎瓷片
的目的是 。实验结束,可加入 比较
水蒸馏前后的硬度变化。
(3)宇航员一部分生活用氧可通过电解水制得。如图1是电
解水的实验示意图,玻璃管 (填“a”或“b”)中的
气体能使带火星的木条复燃。该实验说明水是由 组成的。
(4)机场、车站等公共场所设有许多直
饮水机,能将自来水进一步净化处理得到
可直接饮用水,其处理水的过程如图2所
示。吸附罐中固体颗粒的主要作用是吸附
杂质,固体颗粒可选用 ,紫外线灯管照射的作用是 。
(5)图3是我国“国家节水标志”,用一句话谈谈你对该标志的理解或
得到的启示 。
混合物
防止暴沸
肥皂水
b
氢元素与氧元素
活性炭
杀菌消毒
“国家节水标志”,是由水滴、人手和地球变形而成。绿色的圆形代表地球,象征节约用水是保护地球生态的重要措施。标志留白部分像一只手托起一滴水,手是拼音字母JS的变形,寓意节水,表示节水需要公众参与,人人动手,节约每一滴水(合理即可)。
16.(2022金华)学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯
中分别加入50g、25g、5g同种固体
物质,充分溶解后,静置,现象如图
所示。回答下列问题:
(1)小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是 ;
(2)A、B、C三只烧杯中,溶液的溶质质量分数大小关系是 。
A烧杯中的固体物质没有完全溶解
A≥B>C
17.(2022黑龙江)如图,验证燃烧的条件、灭火原理和二氧化碳的性质实验。
(1)实验一,铜片上的白磷燃
烧而红磷不燃烧说明可燃物燃烧
需要的条件之一是 。
(2)实验二,A烧杯中蜡烛一段时间后熄灭,灭火的原理是
。
(3)实验三,A和B的软塑料瓶体积相同且充满CO2,将A瓶盖打开,加入体积约为塑料瓶容积的蒸馏水,旋紧瓶盖后充分振荡;向B中注入等体积的蒸馏水,充分振荡,观察到A瓶的实验现象是
,B瓶无明显变化,其原因是 。
温度达到可燃物的着火点
隔绝氧气
瓶子变瘪
1体积水约能溶解1体积的二氧化碳,瓶内压强保持不变
18.(2022宜昌)氧气是人类不可离开的物质。根据下列装置图回答问题。
(1)实验室用氯酸钾制氧气的化学方程式
为 ,其发生装置
可选用 (填字母序号,下同);用C
装置收集氧气前,将集气瓶内空气完全排尽
的方法是 。
(2)某同学欲按图F所示方法做细铁丝燃烧的实验,收集所需氧气最好选用的装置是
;做硫燃烧实验,收集所需氧气最好选用的装置是 。由此可见,选择气体的收集方法主要应考虑气体的性质,此外往往还要考虑 。
(3)如图所示,利用红磷与空气中的氧气反应验证质量守恒定律。
①用红热的玻璃管引燃红磷,其燃烧过程中能观察到的现象是
,反应的化学方程式为 。
②待红磷熄灭后再次称量,天平不再平衡,其原因可能是 。
A.装置漏气 B.用橡胶塞塞紧锥形瓶速度太慢
C.红磷太少 D.没有等锥形瓶冷却就再次称量
2KClO32KCl + 3O2↑
A
将集气瓶装满水
D
C
操作是否优化
产生大量白烟、放出热量、气球胀大
4P + 5O2 点燃 2P2O5
ABD
三、实验题
19.(2022永州)创新是社会进步的不竭动力。某化学兴趣小组设计了制取氧气和燃烧条件探究的创新实验。如图:
查阅资料:①白磷的着火点为40℃;
②P2O5+6NaOH═2Na3PO4+3H2O
请回答下列问题:
(1)仪器a的名称是 。
(2)按图连接好装置,将注射器内简
向外拉出一段距离,装置C(装有水)
中导管内立即形成一段水柱,片刻后观察到导管中的水柱不下降,这一操作的目的是检查装置的 性。
(3)向装置A中分别装入适量H2O2溶液和少量MnO2粉末,装置B中小试管装入一小颗白磷,装置C中装入适量NaOH溶液,连接好装置,缓慢推送注射器,向锥形瓶内注入H2O2溶液,立即观察到锥形瓶内产生气泡,装置B中白磷不燃烧。装置A中发生反应的化学方程式是 。
(4)向装置B的仪器a中注入90℃热水,片刻,可观察到白磷会
(填写实验现象)。
(5)装置C的作用是 。
烧 杯
气 密
2H2O2 MnO2 2H2O+O2↑
剧烈燃烧,产生大量的白烟
吸收P2O5,防止污染环境
20.(2022江西)根据下图回答有关问题:
(1)图一中仪器①的名称是______。
(2)实验室用高锰酸钾制氧气,可从
图一中选择的发生装置是______(填序
号);使用装置D收集氧气时应从导管
口______(选填“a”或“b”)通入。
(3)实验室制二氧化碳的化学方程式为 。图一中,与装置A相比,选用装置B制二氧化碳的优点是______
。将产生的二氧化碳通入图二装置,观察到试纸Ⅰ不变色而试纸Ⅱ变红,饱和澄清石灰水变浑浊,据玻璃管中的现象可知二氧化碳的化学性质是 ;若试管中导管口有连续均匀的气泡冒出,但饱和澄清石灰水未变浑浊的原因是 。
酒精灯
C
b
2HCl + CaCO = CaCl + H O + CO ↑
可以
控制反应速率
能与水反应生成酸
二氧化碳中混有氯化氢气体
21.(2022齐齐哈尔)疫情防控期间常用到一种免洗手消毒凝胶,其中含有正丙醇(化学式为C3H8O)。请回答下列问题:
(1)正丙醇的相对分子质量为 。
(2)正丙醇中碳元素和氢元素的质量比为 (写出最简整数比)。
(3)6g正丙醇中氧元素的质量为 g。
【解析】
(1)正丙醇的相对分子质量为12×3+1×8+16=60;
(2)正丙醇(化学式为C3H8O)中,碳、氢元素的质量比为(12×3):(1×8)=9:2;
(3)6g正丙醇中氧元素的质量6g×16/60×100%=1.6g。
四、计算题
22.(2022杭州)某火力发电厂用石灰石为原料吸收废气中的二氧化硫,以防止污染环境,发生反应的化学方程式为:2CaCO3+2SO2+O2═2CaSO4+2CO2。若每天需要吸收0.64吨二氧化硫,则该发电厂每个月(按30天计)需要含碳酸钙为90%的石灰石多少吨?(杂质不参与反应)
【解析】设每天需要消耗CaCO3的质量为x
2CaCO3+O2+2SO2═2CaSO4+2CO2,
200 128
x 0.64t
200/128 = x/0.64t
x = 1t
1t/90%×30 = 33.3t
答:该发电厂每个月需要含碳酸钙为90%的石灰石33.3t。
23.(2022恩施州)中国禽蛋生产和消费居全球之首。好奇的小明在自家养鸡场捡到一个与平常不一样的“软壳蛋”后,采用定量实验法探析其形成的可能原因。取软壳清洗并干燥后,称得质量为4g,并在学校实验室开展实验,实验结果如图所示。(假设蛋壳中其它成分不与盐酸反应;已知正常蛋壳中碳酸钙的质量分数≥90%)。
(1)计算该软壳蛋中碳酸钙的质量分数
(写出计算过程)。
(2)该软壳蛋形成的可能原因是 。
【解析】(1)设参加反应的碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.1g
100/44 = x/1.1g
X = 2.5g
2.5g/4g×100%=62.5%。
(2)鸡蛋壳的主要成分是碳酸钙,该软壳蛋形成的可能原因是母鸡缺钙(合理即可)。
答:(1)计算该软壳蛋中碳酸钙的质量分数为62.5%;
(2)母鸡缺钙(合理即可)。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
