2022-2023学年高二上学期化学人教版(2019)选择性必修1-3.1.1 强电解质和弱电解质(2课时) 课件 (50张ppt)
文档属性
| 名称 | 2022-2023学年高二上学期化学人教版(2019)选择性必修1-3.1.1 强电解质和弱电解质(2课时) 课件 (50张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 43.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 10:37:21 | ||
图片预览








文档简介
第1节 电离平衡
第1课时:强电解质和弱电解质、
弱电解质 的电离平衡
第三章
强电解质和弱电解质
知识回顾
(1)什么叫电解质?
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态都不能导电的化合物。
(3)电解质的导电
(2)什么叫非电解质?
条件:
溶于水或熔融状态
本质 :
自由离子的定向移动
导电能力:
离子浓度、离子所带电荷
包括酸、 碱、 盐、活泼金属氧化物、水等。
包括大多数有机物、NH3、大部分非金属氧化物等。
【疑点突破】
(1)电解质、非电解质的前提必须为化合物,所以单质和混合物既不是电解质又不是非电解质。
(2)电解质必须是化合物本身能电离出离子,否则不属于电解质。
例如NH3、SO2、CO2
(3)电解质不一定导电,导电的不一定是电解质。
1、以下几种说法正确的是( )
A、石墨能导电、所以是电解质
B、虽然BaSO?难溶于水、但是属于电解质
C、盐酸能导电,所以盐酸是电解质
D、CO?、SO?、NH?溶于水能导电、所以均为电解质
盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
强电解质和弱电解质
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
强电解质和弱电解质
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
pH=1
pH≈3
强
弱
产生气泡速度较快
产生气泡速度较慢
结论:相同体积、相同浓度的盐酸和醋酸的电离程度不一样
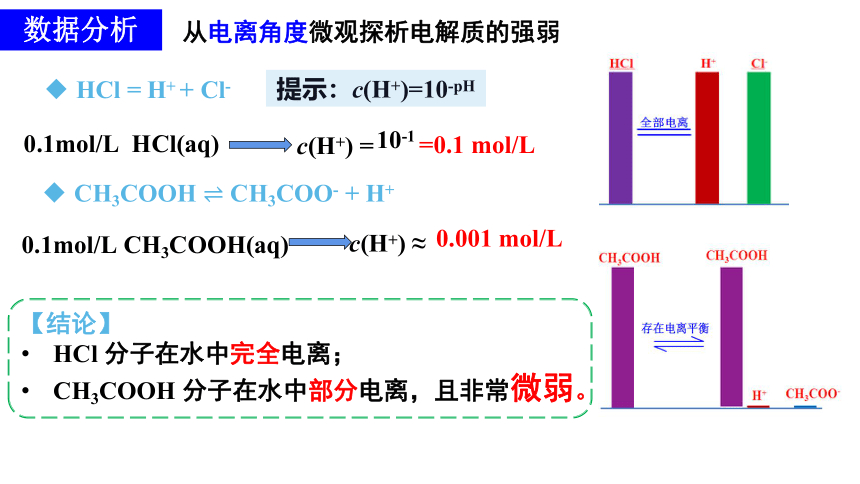
0.1mol/L HCl(aq)
c(H+) =
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+) ≈
0.001 mol/L
【结论】
HCl 分子在水中完全电离;
CH3COOH 分子在水中部分电离,且非常微弱。
从电离角度微观探析电解质的强弱
数据分析
HCl = H+ + Cl-
CH3COOH ? CH3COO- + H+
?
提示:c(H+)=10-pH
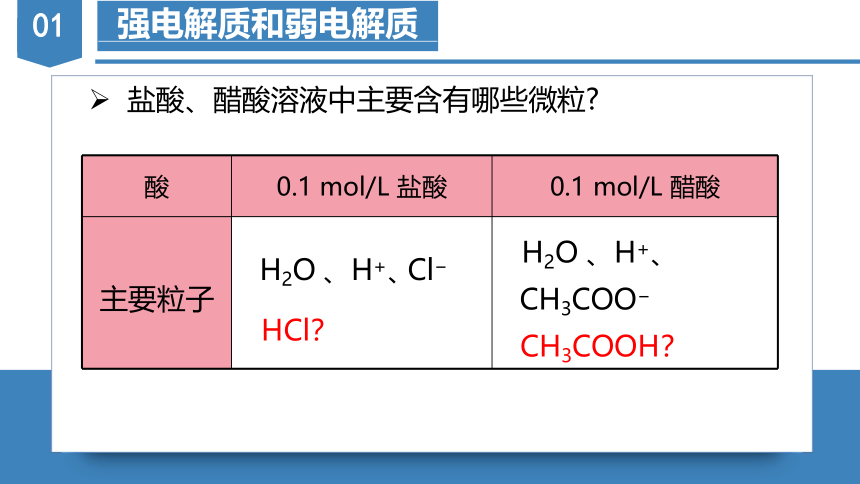
{5940675A-B579-460E-94D1-54222C63F5DA}酸
0.1 mol/L 盐酸
0.1 mol/L 醋酸
主要粒子
H2O
、H+、
CH3COO?
H2O
、H+、
Cl?
盐酸、醋酸溶液中主要含有哪些微粒?
HCl?
CH3COOH?
强电解质和弱电解质
强电解质和弱电解质
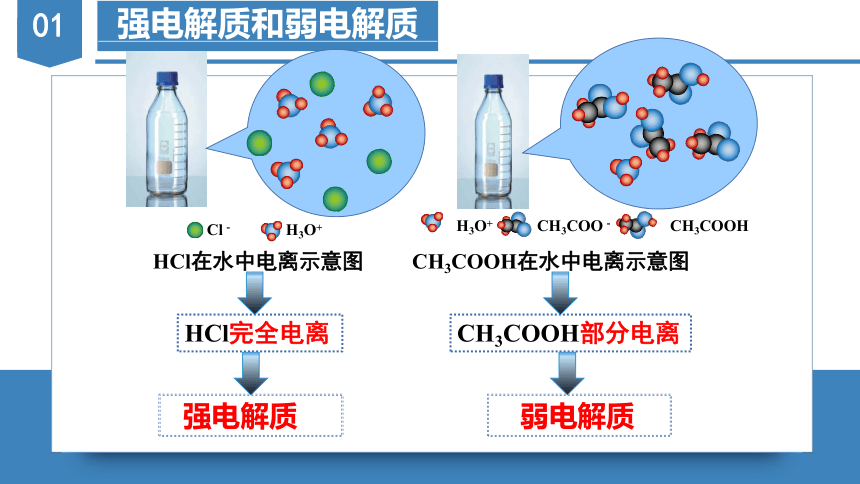
Cl- H3O+
HCl完全电离
CH3COOH部分电离
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
强电解质
弱电解质
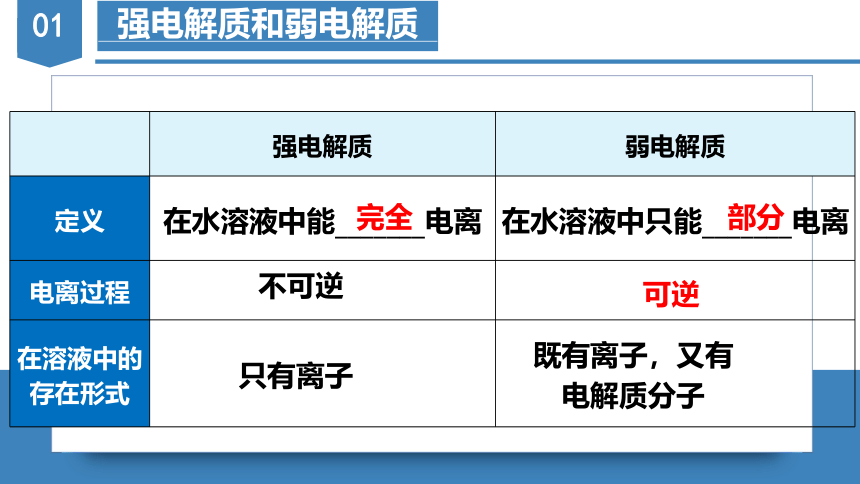
?
强电解质
弱电解质
定义
在水溶液中能_______电离
在水溶液中只能_______电离
电离过程
在溶液中的存在形式
完全
部分
不可逆
可逆
只有离子
既有离子,又有电解质分子
强电解质和弱电解质
强电解质和弱电解质
强电解质
在水溶液中能_______电离的电解质
①强酸(六大强酸)
HCl、HBr、HI、H?SO?、HNO?、HClO?
②强碱(四大强碱)
如KOH、Ba(OH)?、NaOH、Ca(OH)?
③大部分盐:如NaCl、BaSO4 (包括难溶性盐)
④活泼金属氧化物:如Na?O
【类别】
完全
强电解质和弱电解质
弱电解质
【类别】
弱酸:CH3COOH、HF、H?S、HClO、H?SO?、H?PO?等
弱碱:NH3·H2O、Al(OH)3、Cu(OH)?、Fe(OH)?等
水
在水溶液中只能_______电离的电解质
部分
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ = CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度。
学以致用
【例1】下列物质属于强电解质的是 ,
属于弱电解质的是______ 。
a. HCl b. NaCl
c. CH3COOH d. Na2SO4
e. NaOH f. Cu(OH)2
g. NH3.H2O h. H2O
c f g h
a b d e
怎样区分强弱电解质?
从物质分类角度区分
【例2】下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______。
a.铜丝 b.NaCl c.石墨 d.冰醋酸 e.HCl的水溶液 f.蔗糖 g.SO2 h.NaHCO3 i. BaSO4 j.氨水
a c e j
b h i
d
f g
能导电的:金属、石墨、熔融态的** 、电解质溶液、
电解质:酸、碱、盐、金属氧化物、水
非电解质:非金属氧化物、有机物
强电解质:强酸、强碱、盐、金属氧化物
弱电解质:弱酸、弱碱、水
化合物
电解质的强弱与其溶解性有何关系?
强电解质
弱电解质
能否根据溶液导电能力判断电解质的相对强弱?
无关
不能
思考与交流
难溶:BaSO4 Fe(OH)3
易溶:HCl CH3COOH
结论:电解质的强弱与其溶解性和导电能力无必然联系。
电离方程式的书写
强电解质
完全电离,符号用“=”,原子团不能拆。
强电解质
强酸
强碱
盐
正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl === H+ + Cl-
完全电离,如Ba(OH)2 === Ba2+ + 2OH-
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- ;HCO3- H++CO32-
NaHSO4 (熔融) =Na++H++SO42- (熔融态)
部分电离,符号选用“?”
电离方程式的书写
弱电解质
弱电解质
一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
碱式
酸式
两性氢氧化物双向电离
部分电离,CH3COOH?H++CH3COO-
部分电离,NH3·H2O?NH4+ + OH -
部分电离,H2O?H+ + OH -
H2CO3 ?H+ +HCO3?
;HCO3? ? H+ + CO32?
Cu(OH)2 ?Cu2+ + 2OH?
分步电离,一步写出
????++?????????????????+?????????????????????(????????)?????????????????++?????????????
?
分步电离,分步写出
1、写出下列物质在水中的电离方程式:
(2) H2SO3 :___________
(3) HClO :___________
(4) Fe(OH)3 :___________
(5) NaHSO? :___________
(7) Ba(OH)2 :___________
一、强、弱电解质的定义、物质类别与比较
?
强电解质
弱电解质
定义
在水溶液中能_______电离
在水溶液中只能_______电离
电离过程
在溶液中的存在形式
物质类别
完全
部分
不可逆
可逆
只有离子
既有离子,又有电解质分子
强酸,如HCl、HBr、HI、H?SO?、HNO?、HClO?
强碱,如KOH、Ba(OH)?、NaOH、Ca(OH)?
大部分盐,如NaCl、BaSO4 (包括难溶性盐)、活泼金属氧化物
弱酸,CH3COOH、HF、H?S、HClO、H?SO?、H?PO?等
弱碱,NH3·H2O、Al(OH)3、Cu(OH)?、Fe(OH)?等
水
【练一练】
下列物质中: ①NaOH溶液 ②NaCl ③盐酸 ④CO2
⑤CaCO3 ⑥ Fe ⑦硫酸 ⑧乙醇 ⑨融熔CaCl2 ⑩Na2O
能导电的物质是: ;
属于电解质的是: ;
属于非电解质的是: ;
①③⑥⑨
②⑤⑦⑨⑩
④⑧
弱电解质的电离平衡
设计实验
向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,充分搅拌后测pH。
(宏观现象)
溶液pH变大
(微观本质)
c(H+)减小
结论:
弱电解质分子在水溶液存在电离平衡
CH3COOH
CH3COO?
+ H+
pH升高,c(H+)下降
CH3COOH
CH3COO?
+ H+
实验结果:
任务二:研究弱电解质是如何部分电离的?
H+与CH3COO? 能结合
将冰醋酸(醋酸固体)加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
CH3COOH CH3COO - + H+
电离
结合
【思考】
①开始时,V电离 和 V结合怎样变化?
②当V电离 = V结合时,可逆过程达到什么状态?画出V~t图。
?
c(CH3COOH)
c(H+)
c(CH3COO-)
v(电离)
v(结合)
开始时
?
?
?
?
?
接着
?
?
?
?
?
最后
?
?
?
?
?
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
CH3COOH CH3COO - + H+
电离
结合
【问题一】
反应速率
弱电解质电离平衡状态建立示意图
时间
v(电离成离子)
v(结合成分子)
v(电离) = v(结合)
电离平衡状态
【问题二】
弱电解质的电离平衡
1、电离平衡
(2)用v-t图像描述
(1)定义:在一定条件下(如温度和浓度),当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率 相等 即( v(电离)= v(结合) ≠ 0 )时,电离过程就达到了电离平衡状态。
弱电解质的电离平衡
2、电离平衡的特征
动:电离平衡是一种动态平衡
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
定:平衡时分子、离子的浓度不再变化
弱:研究对象是弱电解质
平衡移动规律—勒夏特列原理
弱电解质的电离平衡
3、弱电解质电离的特点
不同温度下0.05 mol/L 醋酸的pH:
{5940675A-B579-460E-94D1-54222C63F5DA} 温度
20 ℃
24 ℃
pH
3.05
3.03
温度升高,pH减小,c(H+)增大
CH3COOH?CH3COO? + H+
?
1、电离是一个吸热过程,温度升高, 平衡正向移动,电离程度增大
ΔH >0
2、达到平衡时分子、离子共存
3、弱电解质的电离都是微弱的过程,一般来说,绝大数以分子的形式存在。如0.1mol/L的醋酸溶液中,c(H?)在0.001mol/L左右
弱电解质的电离平衡
4、电离平衡的影响因素
通常电解质越弱电离程度越小。
(1)内因:
弱电解质本身的性质。
(2)外因:
①温度
②浓度
③其他因素
当外界条件改变时符合“勒夏特列原理”
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
升高温度
CH3COO- + H+ ΔH >0
CH3COOH
→
↑
↑
↑
↑
↓
↑
(1)温度
【思考】升高温度,对化学平衡有什么影响,溶液中微粒有什么变化?
越热越电离
0.1 mol/L CH3COOH溶液中:
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
加HCl(g)
加CH3COONa(s)
←
↓
↑
↑
↓
↑
↑
←
↓
↓
↓
↑
↑
↑
(2)同离子效应
CH3COO- + H+ ΔH >0
CH3COOH
0.1 mol/L CH3COOH溶液中:
【思考】通入HCl气体或CH3COONa固体,对化学平衡有什么影响,溶液中微粒有什么变化?
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
加NaOH(s)
加入镁粉
→
↑
↓
↓
↑
↓
↑
→
↑
↓
↓
↑
↓
↑
(3)离子反应效应
CH3COO- + H+ ΔH >0
CH3COOH
0.1 mol/L CH3COOH溶液中:
【思考】加入镁粉或NaOH,对化学平衡有什么影响,溶液中微粒有什么变化?
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
加水稀释
加少量冰醋酸
→
↑
↑
↓
↓
↓
↓
α= —————————×100%
已电离的溶质分子数
溶质分子总数
→
↓
↑
↑
↑
↑
↑
(4)浓度
“越稀越电离”
CH3COO- + H+ ΔH >0
CH3COOH
0.1 mol/L CH3COOH溶液中:
【思考】加水稀释或加入少量冰醋酸,对化学平衡有什么影响,溶液中微粒有什么变化?
弱电解质的电离平衡
4、电离平衡的影响因素
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,将促进平衡,向正向移动。(同抑反促)
②浓度: 降低浓度,电离平衡向正向移动,因为离子相互碰撞结合为分子的几率减小。(越稀越电离)
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制平衡,向逆向移动。
c
c
bd
1.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示:
(3)a、b、c三点对应的溶液中CH3COOH电离程度最大的是______。
(4)若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是______(填序号)
① 加入H2O ②加入NaOH固体
③加入浓硫酸 ④ 加入Na2CO3固体
b>a>c
(1)“O”点不能导电的理由________________。
(2)a、b、c三点溶液c(H+)由大到小的顺序为______。
没有自由移动的离子
C
②④
书本P62
巩固练习
1.0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )①电离程度增大 ②c(NH3·H2O)增大 ③NH4+数目增多 ④c(OH-)增大 ⑤导电性增强A.①②③ B.①③⑤ C.①③ D.②④
C
2.下列事实不能用来判断醋酸为弱电解质的是( )A.常温下测定醋酸钠溶液的pHB.比较相同大小的镁条与相同浓度的盐酸与醋酸反应的速率大小C.比较相同体积、相同浓度的盐酸和醋酸分别与0.1 mol·L-1氢氧化钠溶液反应所消耗的氢氧化钠溶液的体积D.比较相同浓度的盐酸和醋酸的导电能力
C
电离平衡
电解质和
非电解质
强电解质和
弱电解质
平衡的建立与特征
影响因素:
弱电解质的电离平衡
内因——电解质本身
外因——温度、浓度
完全电离
部分电离
巩固练习
3.化合物HIn在水溶液中存在以下电离平衡:HIn(aq) H+(aq)+In-(aq)
(红色) (黄色)故可用作酸碱指示剂。现有浓度为0.02 mol·L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是( )A.①④⑤ B.②⑤⑥C.①④ D.②③⑥
C
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
升高温度
加CH3COONa(s)
加HCl(g)
加入镁粉
加NaOH(s)
加水稀释
加少量冰醋酸
分析改变下列条件对醋酸电离平衡的影响
CH3COO- + H+ ΔH >0
CH3COOH
→
↑
↑
↑
↑
↓
↑
→
↓
↑
↑
↑
↑
↑
←
↓
↑
↑
↓
↑
↑
←
↓
↓
↓
↑
↑
↑
→
↑
↓
↓
↑
↓
↑
→
↑
↓
↓
↑
↓
↑
→
↑
↑
↓
↓
↓
↓
α= —————————×100%
已电离的溶质分子数
原有溶质分子总数
思考:教科书第61页
2 mol/L 的盐酸和醋酸,
初始阶段的c(H+)分别为: 、 。
2 mol/L
小于 2 mol/L
与Mg条反应,初始阶段的反应速率: 。
问题分析:
盐酸 > 醋酸
HCl==H+ + Cl?
Mg
+
c(H+)下降更为明显
CH3COOH ? CH3COO? + H+
Mg
+
c(H+)下降,电离平衡正向移动
c(H+)下降幅度不如盐酸中明显
与Mg条化学反应速率的变化,盐酸的减小非常明显,醋酸的相对变化幅度小。
第三章 电离平衡
弱电解质的电离平衡
4、电离平衡的影响因素
(2)浓度
平衡向电离方向移动,电离程度增大
CH3COOH CH3COO- + H+
①加水稀释:
c(CH3COO-)和c(H+)怎样变化?
【总结】加水稀释,促进电离,电离程度增大,但离子浓度减小。
减小
0.1 mol/L CH3COOH溶液中:
【思考】n(CH3COO-)和n(H+)怎样变化?
增大
“越稀越电离”
实验测得:用水稀释冰醋酸时氢离子浓度随加水量的变化曲线
弱电解质的电离平衡
4、电离平衡的影响因素
(2)浓度
CH3COOH CH3COO- + H+
0.1 mol/L CH3COOH溶液中:
电离平衡正向移动。
②加少量冰醋酸:
c(CH3COOH)、c(CH3COO-)和c(H+)怎样变化?
【总结】增大弱电解质浓度:平衡向电离方向移动,电离程度减小。
增大
【思考】n(CH3COO-)和n(H+)怎样变化?
增大
弱电解质的电离平衡
4、电离平衡的影响因素
电离平衡逆向移动。
●加少量CH3COONa固体:
【思考】c(CH3COOH)、c(CH3COO-)怎样变化?
【总结】同离子效应:
在弱电解质溶液中,加入与弱电解质含有相同离子的易溶强电解质,抑制弱电解质电离,电离程度减小。
增大
c(H+)?
(3)同离子效应
CH3COOH CH3COO- + H+
0.1 mol/L CH3COOH溶液中:
“同抑异促”
弱电解质的电离平衡
4、电离平衡的影响因素
(4)加入能与离子反应的物质
CH3COOH CH3COO- + H+
0.1 mol/L CH3COOH溶液中:
电离平衡正向移动。
●加少量镁粉或NaOH:
【思考】c(CH3COOH)和c(H+)怎样变化?
【总结】 加入能与弱电解质电离产生的某种离子反应的物质时,减少了该离子的浓度,促进了弱电解质的电离,使电离平衡向电离方向移动,电离程度增大。
减小
c(CH3COO-)?
第1课时:强电解质和弱电解质、
弱电解质 的电离平衡
第三章
强电解质和弱电解质
知识回顾
(1)什么叫电解质?
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态都不能导电的化合物。
(3)电解质的导电
(2)什么叫非电解质?
条件:
溶于水或熔融状态
本质 :
自由离子的定向移动
导电能力:
离子浓度、离子所带电荷
包括酸、 碱、 盐、活泼金属氧化物、水等。
包括大多数有机物、NH3、大部分非金属氧化物等。
【疑点突破】
(1)电解质、非电解质的前提必须为化合物,所以单质和混合物既不是电解质又不是非电解质。
(2)电解质必须是化合物本身能电离出离子,否则不属于电解质。
例如NH3、SO2、CO2
(3)电解质不一定导电,导电的不一定是电解质。
1、以下几种说法正确的是( )
A、石墨能导电、所以是电解质
B、虽然BaSO?难溶于水、但是属于电解质
C、盐酸能导电,所以盐酸是电解质
D、CO?、SO?、NH?溶于水能导电、所以均为电解质
盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
强电解质和弱电解质
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
强电解质和弱电解质
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
pH=1
pH≈3
强
弱
产生气泡速度较快
产生气泡速度较慢
结论:相同体积、相同浓度的盐酸和醋酸的电离程度不一样
0.1mol/L HCl(aq)
c(H+) =
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+) ≈
0.001 mol/L
【结论】
HCl 分子在水中完全电离;
CH3COOH 分子在水中部分电离,且非常微弱。
从电离角度微观探析电解质的强弱
数据分析
HCl = H+ + Cl-
CH3COOH ? CH3COO- + H+
?
提示:c(H+)=10-pH
{5940675A-B579-460E-94D1-54222C63F5DA}酸
0.1 mol/L 盐酸
0.1 mol/L 醋酸
主要粒子
H2O
、H+、
CH3COO?
H2O
、H+、
Cl?
盐酸、醋酸溶液中主要含有哪些微粒?
HCl?
CH3COOH?
强电解质和弱电解质
强电解质和弱电解质
Cl- H3O+
HCl完全电离
CH3COOH部分电离
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
强电解质
弱电解质
?
强电解质
弱电解质
定义
在水溶液中能_______电离
在水溶液中只能_______电离
电离过程
在溶液中的存在形式
完全
部分
不可逆
可逆
只有离子
既有离子,又有电解质分子
强电解质和弱电解质
强电解质和弱电解质
强电解质
在水溶液中能_______电离的电解质
①强酸(六大强酸)
HCl、HBr、HI、H?SO?、HNO?、HClO?
②强碱(四大强碱)
如KOH、Ba(OH)?、NaOH、Ca(OH)?
③大部分盐:如NaCl、BaSO4 (包括难溶性盐)
④活泼金属氧化物:如Na?O
【类别】
完全
强电解质和弱电解质
弱电解质
【类别】
弱酸:CH3COOH、HF、H?S、HClO、H?SO?、H?PO?等
弱碱:NH3·H2O、Al(OH)3、Cu(OH)?、Fe(OH)?等
水
在水溶液中只能_______电离的电解质
部分
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ = CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度。
学以致用
【例1】下列物质属于强电解质的是 ,
属于弱电解质的是______ 。
a. HCl b. NaCl
c. CH3COOH d. Na2SO4
e. NaOH f. Cu(OH)2
g. NH3.H2O h. H2O
c f g h
a b d e
怎样区分强弱电解质?
从物质分类角度区分
【例2】下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______。
a.铜丝 b.NaCl c.石墨 d.冰醋酸 e.HCl的水溶液 f.蔗糖 g.SO2 h.NaHCO3 i. BaSO4 j.氨水
a c e j
b h i
d
f g
能导电的:金属、石墨、熔融态的** 、电解质溶液、
电解质:酸、碱、盐、金属氧化物、水
非电解质:非金属氧化物、有机物
强电解质:强酸、强碱、盐、金属氧化物
弱电解质:弱酸、弱碱、水
化合物
电解质的强弱与其溶解性有何关系?
强电解质
弱电解质
能否根据溶液导电能力判断电解质的相对强弱?
无关
不能
思考与交流
难溶:BaSO4 Fe(OH)3
易溶:HCl CH3COOH
结论:电解质的强弱与其溶解性和导电能力无必然联系。
电离方程式的书写
强电解质
完全电离,符号用“=”,原子团不能拆。
强电解质
强酸
强碱
盐
正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl === H+ + Cl-
完全电离,如Ba(OH)2 === Ba2+ + 2OH-
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- ;HCO3- H++CO32-
NaHSO4 (熔融) =Na++H++SO42- (熔融态)
部分电离,符号选用“?”
电离方程式的书写
弱电解质
弱电解质
一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
碱式
酸式
两性氢氧化物双向电离
部分电离,CH3COOH?H++CH3COO-
部分电离,NH3·H2O?NH4+ + OH -
部分电离,H2O?H+ + OH -
H2CO3 ?H+ +HCO3?
;HCO3? ? H+ + CO32?
Cu(OH)2 ?Cu2+ + 2OH?
分步电离,一步写出
????++?????????????????+?????????????????????(????????)?????????????????++?????????????
?
分步电离,分步写出
1、写出下列物质在水中的电离方程式:
(2) H2SO3 :___________
(3) HClO :___________
(4) Fe(OH)3 :___________
(5) NaHSO? :___________
(7) Ba(OH)2 :___________
一、强、弱电解质的定义、物质类别与比较
?
强电解质
弱电解质
定义
在水溶液中能_______电离
在水溶液中只能_______电离
电离过程
在溶液中的存在形式
物质类别
完全
部分
不可逆
可逆
只有离子
既有离子,又有电解质分子
强酸,如HCl、HBr、HI、H?SO?、HNO?、HClO?
强碱,如KOH、Ba(OH)?、NaOH、Ca(OH)?
大部分盐,如NaCl、BaSO4 (包括难溶性盐)、活泼金属氧化物
弱酸,CH3COOH、HF、H?S、HClO、H?SO?、H?PO?等
弱碱,NH3·H2O、Al(OH)3、Cu(OH)?、Fe(OH)?等
水
【练一练】
下列物质中: ①NaOH溶液 ②NaCl ③盐酸 ④CO2
⑤CaCO3 ⑥ Fe ⑦硫酸 ⑧乙醇 ⑨融熔CaCl2 ⑩Na2O
能导电的物质是: ;
属于电解质的是: ;
属于非电解质的是: ;
①③⑥⑨
②⑤⑦⑨⑩
④⑧
弱电解质的电离平衡
设计实验
向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,充分搅拌后测pH。
(宏观现象)
溶液pH变大
(微观本质)
c(H+)减小
结论:
弱电解质分子在水溶液存在电离平衡
CH3COOH
CH3COO?
+ H+
pH升高,c(H+)下降
CH3COOH
CH3COO?
+ H+
实验结果:
任务二:研究弱电解质是如何部分电离的?
H+与CH3COO? 能结合
将冰醋酸(醋酸固体)加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
CH3COOH CH3COO - + H+
电离
结合
【思考】
①开始时,V电离 和 V结合怎样变化?
②当V电离 = V结合时,可逆过程达到什么状态?画出V~t图。
?
c(CH3COOH)
c(H+)
c(CH3COO-)
v(电离)
v(结合)
开始时
?
?
?
?
?
接着
?
?
?
?
?
最后
?
?
?
?
?
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
CH3COOH CH3COO - + H+
电离
结合
【问题一】
反应速率
弱电解质电离平衡状态建立示意图
时间
v(电离成离子)
v(结合成分子)
v(电离) = v(结合)
电离平衡状态
【问题二】
弱电解质的电离平衡
1、电离平衡
(2)用v-t图像描述
(1)定义:在一定条件下(如温度和浓度),当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率 相等 即( v(电离)= v(结合) ≠ 0 )时,电离过程就达到了电离平衡状态。
弱电解质的电离平衡
2、电离平衡的特征
动:电离平衡是一种动态平衡
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
定:平衡时分子、离子的浓度不再变化
弱:研究对象是弱电解质
平衡移动规律—勒夏特列原理
弱电解质的电离平衡
3、弱电解质电离的特点
不同温度下0.05 mol/L 醋酸的pH:
{5940675A-B579-460E-94D1-54222C63F5DA} 温度
20 ℃
24 ℃
pH
3.05
3.03
温度升高,pH减小,c(H+)增大
CH3COOH?CH3COO? + H+
?
1、电离是一个吸热过程,温度升高, 平衡正向移动,电离程度增大
ΔH >0
2、达到平衡时分子、离子共存
3、弱电解质的电离都是微弱的过程,一般来说,绝大数以分子的形式存在。如0.1mol/L的醋酸溶液中,c(H?)在0.001mol/L左右
弱电解质的电离平衡
4、电离平衡的影响因素
通常电解质越弱电离程度越小。
(1)内因:
弱电解质本身的性质。
(2)外因:
①温度
②浓度
③其他因素
当外界条件改变时符合“勒夏特列原理”
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
升高温度
CH3COO- + H+ ΔH >0
CH3COOH
→
↑
↑
↑
↑
↓
↑
(1)温度
【思考】升高温度,对化学平衡有什么影响,溶液中微粒有什么变化?
越热越电离
0.1 mol/L CH3COOH溶液中:
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
加HCl(g)
加CH3COONa(s)
←
↓
↑
↑
↓
↑
↑
←
↓
↓
↓
↑
↑
↑
(2)同离子效应
CH3COO- + H+ ΔH >0
CH3COOH
0.1 mol/L CH3COOH溶液中:
【思考】通入HCl气体或CH3COONa固体,对化学平衡有什么影响,溶液中微粒有什么变化?
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
加NaOH(s)
加入镁粉
→
↑
↓
↓
↑
↓
↑
→
↑
↓
↓
↑
↓
↑
(3)离子反应效应
CH3COO- + H+ ΔH >0
CH3COOH
0.1 mol/L CH3COOH溶液中:
【思考】加入镁粉或NaOH,对化学平衡有什么影响,溶液中微粒有什么变化?
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
加水稀释
加少量冰醋酸
→
↑
↑
↓
↓
↓
↓
α= —————————×100%
已电离的溶质分子数
溶质分子总数
→
↓
↑
↑
↑
↑
↑
(4)浓度
“越稀越电离”
CH3COO- + H+ ΔH >0
CH3COOH
0.1 mol/L CH3COOH溶液中:
【思考】加水稀释或加入少量冰醋酸,对化学平衡有什么影响,溶液中微粒有什么变化?
弱电解质的电离平衡
4、电离平衡的影响因素
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,将促进平衡,向正向移动。(同抑反促)
②浓度: 降低浓度,电离平衡向正向移动,因为离子相互碰撞结合为分子的几率减小。(越稀越电离)
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制平衡,向逆向移动。
c
c
bd
1.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示:
(3)a、b、c三点对应的溶液中CH3COOH电离程度最大的是______。
(4)若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是______(填序号)
① 加入H2O ②加入NaOH固体
③加入浓硫酸 ④ 加入Na2CO3固体
b>a>c
(1)“O”点不能导电的理由________________。
(2)a、b、c三点溶液c(H+)由大到小的顺序为______。
没有自由移动的离子
C
②④
书本P62
巩固练习
1.0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )①电离程度增大 ②c(NH3·H2O)增大 ③NH4+数目增多 ④c(OH-)增大 ⑤导电性增强A.①②③ B.①③⑤ C.①③ D.②④
C
2.下列事实不能用来判断醋酸为弱电解质的是( )A.常温下测定醋酸钠溶液的pHB.比较相同大小的镁条与相同浓度的盐酸与醋酸反应的速率大小C.比较相同体积、相同浓度的盐酸和醋酸分别与0.1 mol·L-1氢氧化钠溶液反应所消耗的氢氧化钠溶液的体积D.比较相同浓度的盐酸和醋酸的导电能力
C
电离平衡
电解质和
非电解质
强电解质和
弱电解质
平衡的建立与特征
影响因素:
弱电解质的电离平衡
内因——电解质本身
外因——温度、浓度
完全电离
部分电离
巩固练习
3.化合物HIn在水溶液中存在以下电离平衡:HIn(aq) H+(aq)+In-(aq)
(红色) (黄色)故可用作酸碱指示剂。现有浓度为0.02 mol·L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是( )A.①④⑤ B.②⑤⑥C.①④ D.②③⑥
C
改变条件
平衡移动方向
电离
程度
n(H+)
c(H+)
c(CH3COO-)
c(CH3COOH)
导电
能力
升高温度
加CH3COONa(s)
加HCl(g)
加入镁粉
加NaOH(s)
加水稀释
加少量冰醋酸
分析改变下列条件对醋酸电离平衡的影响
CH3COO- + H+ ΔH >0
CH3COOH
→
↑
↑
↑
↑
↓
↑
→
↓
↑
↑
↑
↑
↑
←
↓
↑
↑
↓
↑
↑
←
↓
↓
↓
↑
↑
↑
→
↑
↓
↓
↑
↓
↑
→
↑
↓
↓
↑
↓
↑
→
↑
↑
↓
↓
↓
↓
α= —————————×100%
已电离的溶质分子数
原有溶质分子总数
思考:教科书第61页
2 mol/L 的盐酸和醋酸,
初始阶段的c(H+)分别为: 、 。
2 mol/L
小于 2 mol/L
与Mg条反应,初始阶段的反应速率: 。
问题分析:
盐酸 > 醋酸
HCl==H+ + Cl?
Mg
+
c(H+)下降更为明显
CH3COOH ? CH3COO? + H+
Mg
+
c(H+)下降,电离平衡正向移动
c(H+)下降幅度不如盐酸中明显
与Mg条化学反应速率的变化,盐酸的减小非常明显,醋酸的相对变化幅度小。
第三章 电离平衡
弱电解质的电离平衡
4、电离平衡的影响因素
(2)浓度
平衡向电离方向移动,电离程度增大
CH3COOH CH3COO- + H+
①加水稀释:
c(CH3COO-)和c(H+)怎样变化?
【总结】加水稀释,促进电离,电离程度增大,但离子浓度减小。
减小
0.1 mol/L CH3COOH溶液中:
【思考】n(CH3COO-)和n(H+)怎样变化?
增大
“越稀越电离”
实验测得:用水稀释冰醋酸时氢离子浓度随加水量的变化曲线
弱电解质的电离平衡
4、电离平衡的影响因素
(2)浓度
CH3COOH CH3COO- + H+
0.1 mol/L CH3COOH溶液中:
电离平衡正向移动。
②加少量冰醋酸:
c(CH3COOH)、c(CH3COO-)和c(H+)怎样变化?
【总结】增大弱电解质浓度:平衡向电离方向移动,电离程度减小。
增大
【思考】n(CH3COO-)和n(H+)怎样变化?
增大
弱电解质的电离平衡
4、电离平衡的影响因素
电离平衡逆向移动。
●加少量CH3COONa固体:
【思考】c(CH3COOH)、c(CH3COO-)怎样变化?
【总结】同离子效应:
在弱电解质溶液中,加入与弱电解质含有相同离子的易溶强电解质,抑制弱电解质电离,电离程度减小。
增大
c(H+)?
(3)同离子效应
CH3COOH CH3COO- + H+
0.1 mol/L CH3COOH溶液中:
“同抑异促”
弱电解质的电离平衡
4、电离平衡的影响因素
(4)加入能与离子反应的物质
CH3COOH CH3COO- + H+
0.1 mol/L CH3COOH溶液中:
电离平衡正向移动。
●加少量镁粉或NaOH:
【思考】c(CH3COOH)和c(H+)怎样变化?
【总结】 加入能与弱电解质电离产生的某种离子反应的物质时,减少了该离子的浓度,促进了弱电解质的电离,使电离平衡向电离方向移动,电离程度增大。
减小
c(CH3COO-)?
