2022-2023学年高一上学期化学鲁科版(2019)必修第一册第二章第三节第3课时氧化还原反应的规律和应用(28张ppt))
文档属性
| 名称 | 2022-2023学年高一上学期化学鲁科版(2019)必修第一册第二章第三节第3课时氧化还原反应的规律和应用(28张ppt)) |  | |
| 格式 | pptx | ||
| 文件大小 | 34.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 10:43:25 | ||
图片预览








文档简介
(共28张PPT)
鲁科版 必修一 第二章 第三节氧化还原反应
高一化学备课组
第3课时 氧化还原反应的规律和应用
学习目标
1.了解氧化还原反应的基本规律并能用规律解决问题。
2.能够对物质氧化性还原性进行比较。
3.能够利用氧化还原反应实现物质的转化。
氧化还原反应规律
电子守恒规律:
氧化剂得电子总数=还原剂失电子总数
元素化合价降低的总数=元素化合价升高的总数
应用:
氧化还原方程式的配平,氧化还原相关计算及正误判断
歧化规律:
某元素的中间价态在适宜条件下同时向较高和较低的价态转化
归中规律:
“只靠拢,不交叉”“就近变价”
价态规律:
元素处于最高价态时,只有氧化性
元素处于中间价态时,既有氧化性又有还原性
元素处于最低价态时,只有还原性
口诀:高价氧,低价还,中间价态两边转
应用:判断物质的氧化性,还原性
思考:为什么KMnO4做氧化剂?
1.某元素在化学反应中由化合态变成游离态,则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化也可能被还原
D.以上都不是
C
2.从氮元素的化合价判断,下列物质只能具有还原性的是 ( )
A.NH3 B.NO C.NO2 D.HNO3
A
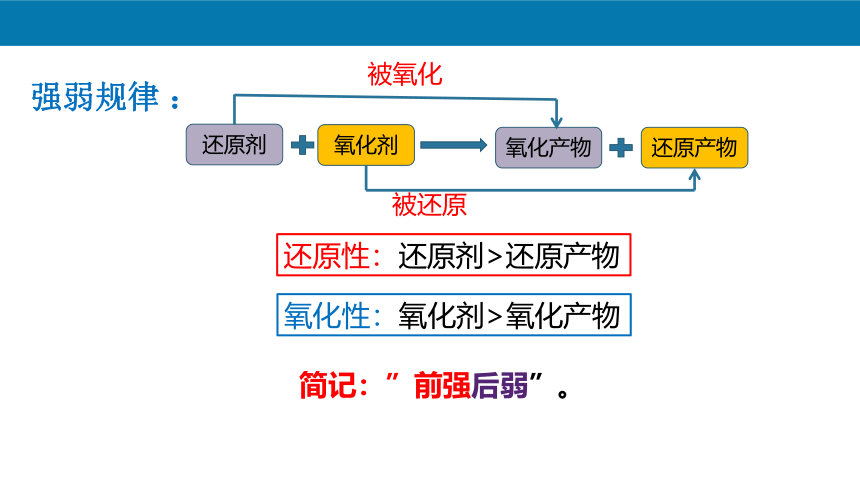
强弱规律 :
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
还原性:还原剂>还原产物
氧化性:氧化剂>氧化产物
简记:”前强后弱”。
应用:
比较物质氧化性或还原性的强弱
判断氧化还原反应能否进行
在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质
3.已知如下反应:2HI+H2SO4(浓)===I2+SO2↑+2H2O;I2+SO2+2H2O===2HI+H2SO4(稀)。有关上述反应的结论正确的是 ( )
A.上述两个反应是相互矛盾的
B.氧化性:浓硫酸>I2>稀硫酸
C.氧化性:I2>浓硫酸>稀硫酸
D.无法比较浓硫酸、I2、稀硫酸的氧化性
B
4.根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的( )
①2MnO2+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
②2FeCl3+2KI===2FeCl2+2KCl+I2
③2FeCl2+Cl2===2FeCl3
A.MnO2>Cl2>Fe3+>I2 B.Cl->Mn2+>I->Fe2+
C.MnO2>Cl2>I2>Fe3+ D.I->Fe2+>Cl->Mn2+
A
先后规律:
(1)同一种氧化剂与多种还原剂反应时,还原性强的还原剂先被氧化。
(2)同一种还原剂与多种氧化剂反应时,氧化性强的氧化剂先被还原。
谁强谁优先
应用:
判断物质的氧化性、还原性强弱
判断反应的先后顺序
5.在一定条件下,下列微粒的还原性由弱到强的顺序为Cl-由此判断,以下各反应在溶液中不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.2Fe2++Cl2=== 2Fe3++2Cl-
C.I2+SO2+2H2O===4H++SO42-+2I-
D.2Br-+4H++SO42-===Br2+SO2↑+2H2O
D
①根据反应原理判断
②依据金属、非金属的活动性顺序判断
如:Fe+CuSO4=FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
如:Cl2+2NaBr=2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物。
氧化性还原性强弱比较的方法
③依据反应条件和剧烈程度
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,反应越容易,该氧化剂氧化性就越强
如:MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
氧化性: KMnO4 MnO2
>
④依据相同条件下氧化还原反应的程度判断
不同氧化剂作用于同一还原剂,氧化产物价态高的氧化性越强
如:2Fe+3Cl2==2FeCl3, Fe+S==FeS,
氧化性:Cl2 S
>
物质的氧化性和还原性受以下因素的影响
(1)温度:
浓硫酸(热)的氧化性大于浓硫酸(冷)
(2)浓度:
H2SO4(浓) 的氧化性大于 H2SO4(稀)
(3)酸碱性:
点燃
△
KMnO4的氧化性随酸性增强而增强
活动 探究(一)
探究物质的氧化性或还原性
过氧化氢(H2O2)中氢元素的化合价为+1价,氧元素的化合价为-1价。过氧化氢是否具有氧化性或还原性呢?请你设计实验证明自己的预测。
实验用品
5% H2O2溶液,酸性KMnO4溶液,KI溶液,淀粉溶液;
试管,胶头滴管。
氧化还原反应的应用
实验内容 实验现象 实验结论
实验方案设计及实施
取少量KI溶液于试管中,滴入几滴淀粉溶液,再滴加5%的H2O2溶液。
溶液由无色变为蓝色
H2O2具有氧化性
取少量酸性KMnO4溶液小试管中,再滴加5%的H2O2溶液。
溶液的紫红色褪去并有气泡产生
H2O2具有还原性
学生思考:
1. 从氧化还原反应的角度,分析、归纳过氧化氢的性质。
氧元素常见价态为0价-1价-2价,过氧化氢中氧元素为-1价。所以氧元素价态有降低的趋势体现氧化性,也有升高的趋势体现还原性。
2. 证明过氧化氢具有氧化性或还原性的依据是什么?
过氧化氢可以把KI中I-氧化为I2,证明过氧化氢具有氧化性。
过氧化氢中-1价的氧元素被酸性KMnO4溶液氧化为O2,证明过氧化氢具有还原性。
非金属单质Cl2的制备
瑞典化学家舍勒(C.W.Scheele)是最早发现氯气的人。他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气。
MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
活动 探究(二)迁移应用
学生思考:
(1)用浓盐酸和二氧化锰制取氯气的反应属于氧化还原反应吗?如果属于氧化还原反应,请指出其中的氧化剂和还原剂;如果不属于氧化还原反应,请说明理由。
0
+4 -1
+2
化合价升高,氧化反应
化合价降低,还原反应
MnO2+ 4HCl(浓) MMnCl2 + Cl2 ↑ + 2H2O
氧化剂
还原剂
(2)在实验室制取氯气时,常使用NaOH溶液吸收尾气。写出相关反应的化学方程式,分析氯气在该反应中表现出什么性质。若想获得纯净的氯气,对该装置还要进行哪些改进?
Cl2 + 2NaOH ====NaCl + NaClO + H2O
化合价升高,氧化反应
化合价降低,还原反应
+1
0
-1
氧化性
还原性
氯气中可能存在的杂质气体为HCl气体、水蒸气
(三)实现物质转化与获得能量
1. 利用氧化还原反应实现物质的转化
① 金属的冶炼
热还原法
置换法
电解法
Fe2O3+3CO Fe+3CO2
Fe + CuSO4==== FeSO4 + Cu
2Al2O3 ==== 4Al+3O2↑
金红石(TiO2)、
碳单质、氯气
高温
TiCl4
镁、加热
氩气氛围
Ti
金属冶炼的实质:
将化合态的金属还原成单质
通电
SiO2、碳单质
高温
SiCl4
氢气
氯气
Si
单质硅的制备
粗硅
② 非金属单质制备
2C+SiO2===Si+2CO
Si+2CI2===SiCI4
SiCI4+2H2===Si+4HCI
高温
高温
高温
2. 利用氧化还原反应获得能量
① 利用氧化还原反应获得热能
可燃物
氧化剂
热量
② 利用氧化还原反应获得电能
6. 实验室制氯气时有如下操作步骤:
①连接好装置并检查其气密性
②缓缓加热,加快反应使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④向分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收试剂中
下列各步骤的顺序排列正确的是 ( )
A.①②③④⑤ B.①④③②⑤ C.④③①②⑤ D.①③④②⑤
D
7. 已知反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,若有44.8 L Cl2(已换算为标准状况)生成,求:
(1)被氧化的HCl为____________g,转移电子数目为___________。
(2)用“双线桥”和“单线桥”标出上述反应的电子转移方向和数目。
146
2.408×1024(或4NA)
氧化还原反应的应用
研究物质的性质
实现物质转化与获得能量
研究物质氧化性或还原性
比较氧化性或还原性的强弱
课堂总结
氧化还原反应的规律
(一)电子守恒规律
(二)歧化规律
(三)归中规律
(四)价态规律
(五)强弱规律
谢 谢 聆 听!请指教!
鲁科版 必修一 第二章 第三节氧化还原反应
高一化学备课组
第3课时 氧化还原反应的规律和应用
学习目标
1.了解氧化还原反应的基本规律并能用规律解决问题。
2.能够对物质氧化性还原性进行比较。
3.能够利用氧化还原反应实现物质的转化。
氧化还原反应规律
电子守恒规律:
氧化剂得电子总数=还原剂失电子总数
元素化合价降低的总数=元素化合价升高的总数
应用:
氧化还原方程式的配平,氧化还原相关计算及正误判断
歧化规律:
某元素的中间价态在适宜条件下同时向较高和较低的价态转化
归中规律:
“只靠拢,不交叉”“就近变价”
价态规律:
元素处于最高价态时,只有氧化性
元素处于中间价态时,既有氧化性又有还原性
元素处于最低价态时,只有还原性
口诀:高价氧,低价还,中间价态两边转
应用:判断物质的氧化性,还原性
思考:为什么KMnO4做氧化剂?
1.某元素在化学反应中由化合态变成游离态,则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化也可能被还原
D.以上都不是
C
2.从氮元素的化合价判断,下列物质只能具有还原性的是 ( )
A.NH3 B.NO C.NO2 D.HNO3
A
强弱规律 :
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
还原性:还原剂>还原产物
氧化性:氧化剂>氧化产物
简记:”前强后弱”。
应用:
比较物质氧化性或还原性的强弱
判断氧化还原反应能否进行
在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质
3.已知如下反应:2HI+H2SO4(浓)===I2+SO2↑+2H2O;I2+SO2+2H2O===2HI+H2SO4(稀)。有关上述反应的结论正确的是 ( )
A.上述两个反应是相互矛盾的
B.氧化性:浓硫酸>I2>稀硫酸
C.氧化性:I2>浓硫酸>稀硫酸
D.无法比较浓硫酸、I2、稀硫酸的氧化性
B
4.根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的( )
①2MnO2+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
②2FeCl3+2KI===2FeCl2+2KCl+I2
③2FeCl2+Cl2===2FeCl3
A.MnO2>Cl2>Fe3+>I2 B.Cl->Mn2+>I->Fe2+
C.MnO2>Cl2>I2>Fe3+ D.I->Fe2+>Cl->Mn2+
A
先后规律:
(1)同一种氧化剂与多种还原剂反应时,还原性强的还原剂先被氧化。
(2)同一种还原剂与多种氧化剂反应时,氧化性强的氧化剂先被还原。
谁强谁优先
应用:
判断物质的氧化性、还原性强弱
判断反应的先后顺序
5.在一定条件下,下列微粒的还原性由弱到强的顺序为Cl-
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.2Fe2++Cl2=== 2Fe3++2Cl-
C.I2+SO2+2H2O===4H++SO42-+2I-
D.2Br-+4H++SO42-===Br2+SO2↑+2H2O
D
①根据反应原理判断
②依据金属、非金属的活动性顺序判断
如:Fe+CuSO4=FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
如:Cl2+2NaBr=2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物。
氧化性还原性强弱比较的方法
③依据反应条件和剧烈程度
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,反应越容易,该氧化剂氧化性就越强
如:MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
氧化性: KMnO4 MnO2
>
④依据相同条件下氧化还原反应的程度判断
不同氧化剂作用于同一还原剂,氧化产物价态高的氧化性越强
如:2Fe+3Cl2==2FeCl3, Fe+S==FeS,
氧化性:Cl2 S
>
物质的氧化性和还原性受以下因素的影响
(1)温度:
浓硫酸(热)的氧化性大于浓硫酸(冷)
(2)浓度:
H2SO4(浓) 的氧化性大于 H2SO4(稀)
(3)酸碱性:
点燃
△
KMnO4的氧化性随酸性增强而增强
活动 探究(一)
探究物质的氧化性或还原性
过氧化氢(H2O2)中氢元素的化合价为+1价,氧元素的化合价为-1价。过氧化氢是否具有氧化性或还原性呢?请你设计实验证明自己的预测。
实验用品
5% H2O2溶液,酸性KMnO4溶液,KI溶液,淀粉溶液;
试管,胶头滴管。
氧化还原反应的应用
实验内容 实验现象 实验结论
实验方案设计及实施
取少量KI溶液于试管中,滴入几滴淀粉溶液,再滴加5%的H2O2溶液。
溶液由无色变为蓝色
H2O2具有氧化性
取少量酸性KMnO4溶液小试管中,再滴加5%的H2O2溶液。
溶液的紫红色褪去并有气泡产生
H2O2具有还原性
学生思考:
1. 从氧化还原反应的角度,分析、归纳过氧化氢的性质。
氧元素常见价态为0价-1价-2价,过氧化氢中氧元素为-1价。所以氧元素价态有降低的趋势体现氧化性,也有升高的趋势体现还原性。
2. 证明过氧化氢具有氧化性或还原性的依据是什么?
过氧化氢可以把KI中I-氧化为I2,证明过氧化氢具有氧化性。
过氧化氢中-1价的氧元素被酸性KMnO4溶液氧化为O2,证明过氧化氢具有还原性。
非金属单质Cl2的制备
瑞典化学家舍勒(C.W.Scheele)是最早发现氯气的人。他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气。
MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
活动 探究(二)迁移应用
学生思考:
(1)用浓盐酸和二氧化锰制取氯气的反应属于氧化还原反应吗?如果属于氧化还原反应,请指出其中的氧化剂和还原剂;如果不属于氧化还原反应,请说明理由。
0
+4 -1
+2
化合价升高,氧化反应
化合价降低,还原反应
MnO2+ 4HCl(浓) MMnCl2 + Cl2 ↑ + 2H2O
氧化剂
还原剂
(2)在实验室制取氯气时,常使用NaOH溶液吸收尾气。写出相关反应的化学方程式,分析氯气在该反应中表现出什么性质。若想获得纯净的氯气,对该装置还要进行哪些改进?
Cl2 + 2NaOH ====NaCl + NaClO + H2O
化合价升高,氧化反应
化合价降低,还原反应
+1
0
-1
氧化性
还原性
氯气中可能存在的杂质气体为HCl气体、水蒸气
(三)实现物质转化与获得能量
1. 利用氧化还原反应实现物质的转化
① 金属的冶炼
热还原法
置换法
电解法
Fe2O3+3CO Fe+3CO2
Fe + CuSO4==== FeSO4 + Cu
2Al2O3 ==== 4Al+3O2↑
金红石(TiO2)、
碳单质、氯气
高温
TiCl4
镁、加热
氩气氛围
Ti
金属冶炼的实质:
将化合态的金属还原成单质
通电
SiO2、碳单质
高温
SiCl4
氢气
氯气
Si
单质硅的制备
粗硅
② 非金属单质制备
2C+SiO2===Si+2CO
Si+2CI2===SiCI4
SiCI4+2H2===Si+4HCI
高温
高温
高温
2. 利用氧化还原反应获得能量
① 利用氧化还原反应获得热能
可燃物
氧化剂
热量
② 利用氧化还原反应获得电能
6. 实验室制氯气时有如下操作步骤:
①连接好装置并检查其气密性
②缓缓加热,加快反应使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④向分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收试剂中
下列各步骤的顺序排列正确的是 ( )
A.①②③④⑤ B.①④③②⑤ C.④③①②⑤ D.①③④②⑤
D
7. 已知反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,若有44.8 L Cl2(已换算为标准状况)生成,求:
(1)被氧化的HCl为____________g,转移电子数目为___________。
(2)用“双线桥”和“单线桥”标出上述反应的电子转移方向和数目。
146
2.408×1024(或4NA)
氧化还原反应的应用
研究物质的性质
实现物质转化与获得能量
研究物质氧化性或还原性
比较氧化性或还原性的强弱
课堂总结
氧化还原反应的规律
(一)电子守恒规律
(二)歧化规律
(三)归中规律
(四)价态规律
(五)强弱规律
谢 谢 聆 听!请指教!
