2.3.2气体摩尔体积2022-2023学年高一上学期化学人教版(2019)必修第一册(18张ppt)
文档属性
| 名称 | 2.3.2气体摩尔体积2022-2023学年高一上学期化学人教版(2019)必修第一册(18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 389.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 14:57:43 | ||
图片预览


文档简介
(共18张PPT)
第2课时 气体摩尔体积
第3节 物质的量
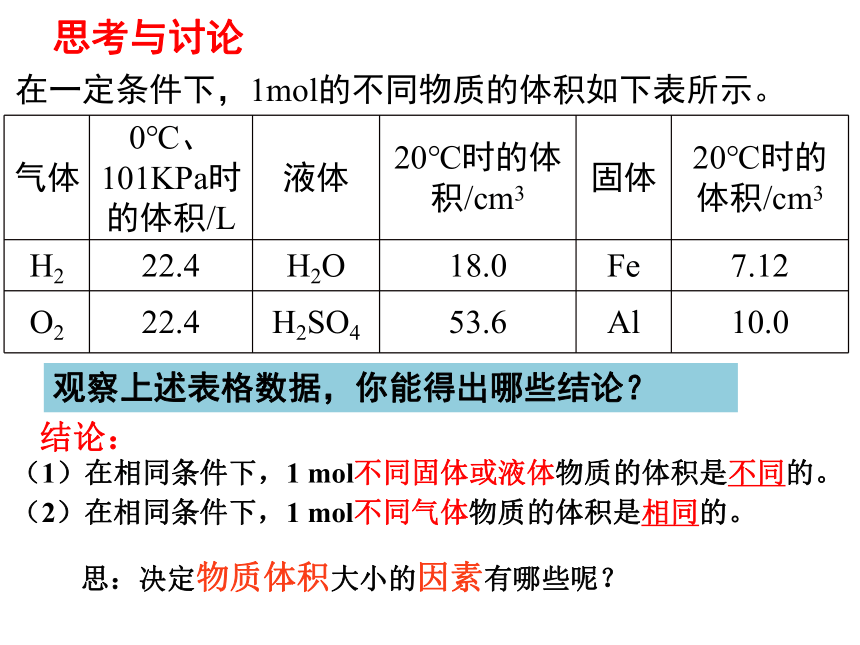
气体 0℃、101KPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
思考与讨论
观察上述表格数据,你能得出哪些结论?
在一定条件下,1mol的不同物质的体积如下表所示。
(1)在相同条件下,1 mol不同固体或液体物质的体积是不同的。
(2)在相同条件下,1 mol不同气体物质的体积是相同的。
思:决定物质体积大小的因素有哪些呢?
结论:
[思考]
50个乒乓球与100个乒乓球分别紧密堆积,哪个所占的体积更大呢?
50个乒乓球与50个篮球分别紧密堆积,哪个所占的体积更大呢?
50个乒乓球紧密堆积,50个乒乓球松散堆积,哪个所占的体积更大呢?
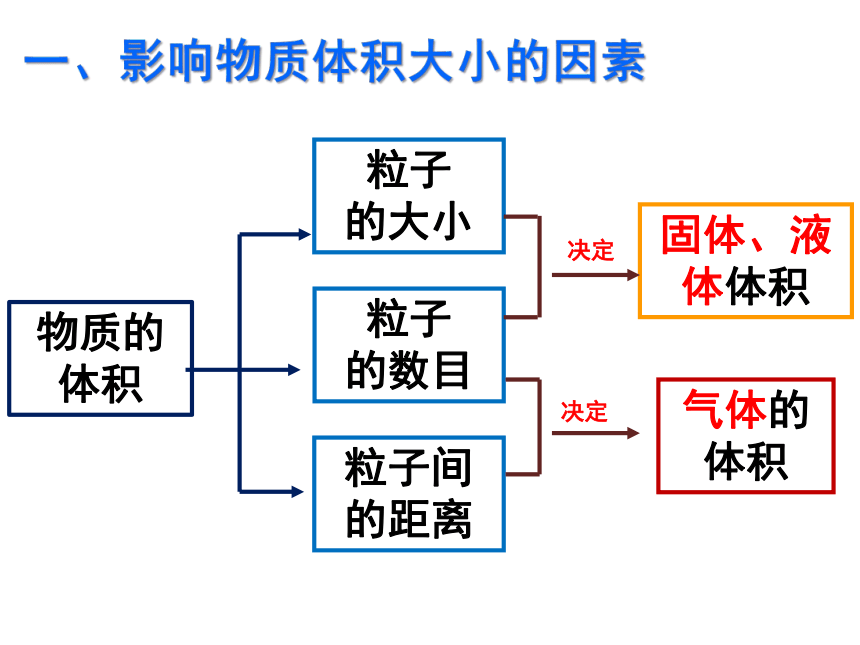
影响物质体积大小的因素:
(3)粒子间的距离
(2)粒子的大小(即直径)
(1)粒子的数目
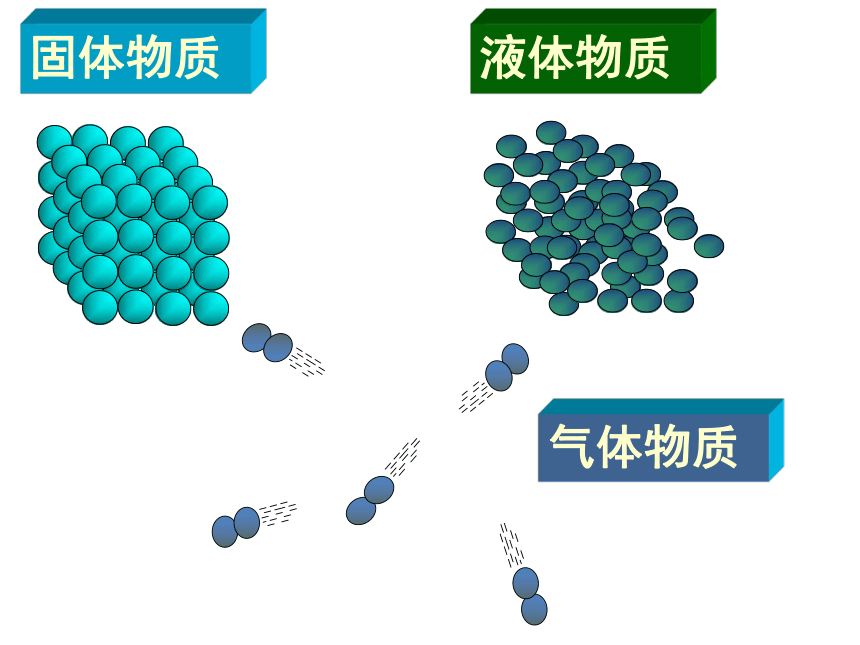
固体物质
液体物质
气体物质
固体、液体体积
物质的 体积
气体的
体积
粒子
的大小
粒子
的数目
粒子间
的距离
决定
决定
一、影响物质体积大小的因素
?
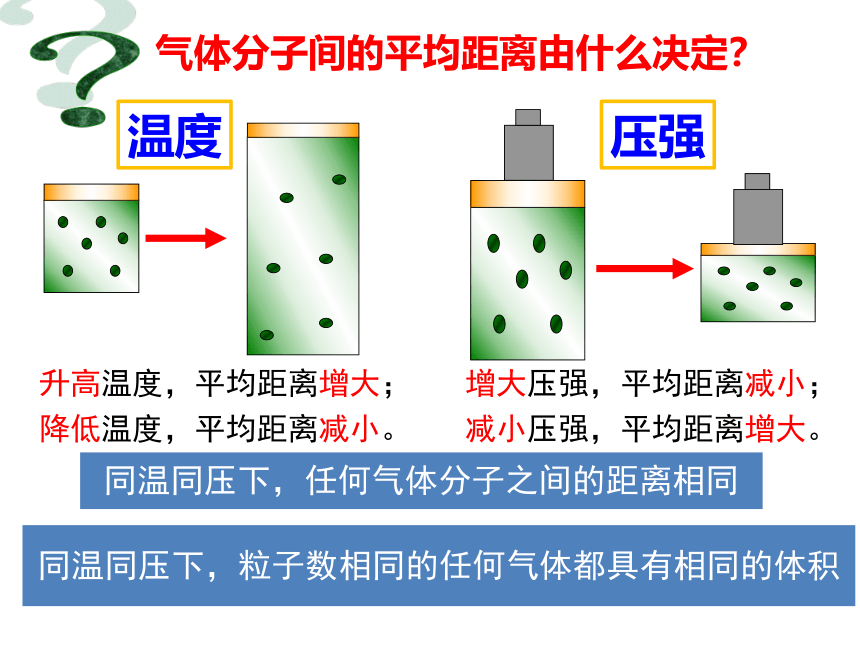
气体分子间的平均距离由什么决定?
温度
压强
同温同压下,任何气体分子之间的距离相同
升高温度,平均距离增大;
降低温度,平均距离减小。
增大压强,平均距离减小;
减小压强,平均距离增大。
同温同压下,粒子数相同的任何气体都具有相同的体积
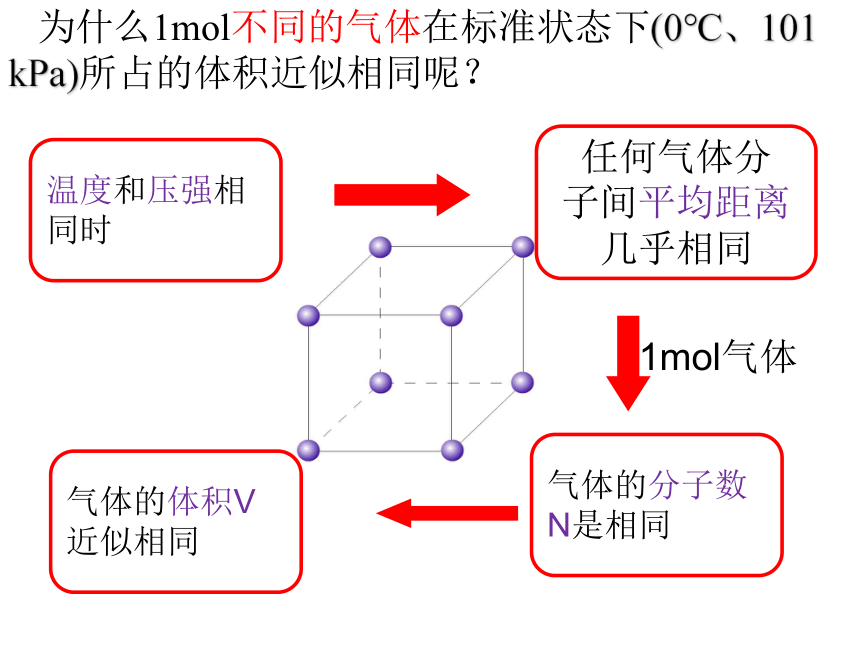
为什么1mol不同的气体在标准状态下(0℃、101 kPa)所占的体积近似相同呢?
温度和压强相同时
任何气体分 子间平均距离几乎相同
气体的体积V近似相同
气体的分子数N是相同
1mol气体
二、气体摩尔体积
5.对象:
1. 定义:
2. 符号:
4.计算公式:
3.单位:
单位物质的量的气体所占的体积。
Vm
L/mol 或 L·mol-1 ( 或m3 /mol )
任何气体(包括混合气体)
6.影响因素:
温度和压强
注:在给定温度和压强的条件下, Vm是常数。
(若条件改变时,Vm也随之改变;也就是说要指明Vm的数值,必须指明温度和压强)
标准状况下(0℃,101KPa),1mol 任何气体的体积都约是22.4L 。
7.标况下的气体摩尔体积:
即:在0℃、101 kPa的状况下,Vm约为 22.4L/mol
(1)条件:标准状况(0℃,101KPa)
(2)对象:任何气体(单一气体或混合不反应的气体)
(3)数值:Vm≈22.4L/mol
标准状况下不是气体的物质有SO3、苯、CCl4、Br2、H2O、NO2、HF等。
【思考】
是否只有在标准状况下气体摩尔体积才是22.4L/mol?
不是,非标况下Vm也可能是22.4L/mol,
如升温加压,降温减压
练习1、判断下列说法是否正确?
(1) 气体的摩尔体积为22.4L·mol-1
(2)1molCO2占有的体积为22.4L
(3)1molH2O在标况下的体积为22.4L
(4)标况下任何气体的体积都约为22.4L
(5)标准状况下,1mol任何物质体积为22.4L
(6)1molHCl在3.03×105Pa时的体积比22.4L小
(7)1LH2和1LO2在同温同压下所含分子数相同
(8)1gN2和1gO2所含分子数相同
(9)1molO2和1molN2所含分子数相同,所占体积相同
×
×
×
×
×
×
√
×
×
1、标准状况下, 2.1 g CO的体积是多少?
2、3.01×1022个 O2 在标准状况下的体积是多少?
4、标准状况下,67.2 L 某气体的质量为 192 g , 则其摩尔质量为多少 ?
3、标准状况下, 44.8L SO2的质量是多少?
5、标准状况下, 5.6LCH4中含有多少个H?
理清思路最重要、熟练公式为重点。
N、m、V之间的互算:
气体摩尔体积的计算
思考与讨论
1.在同温同压下,相同分子数的气体,其体积( )
2.在同温同压下,体积相同的气体,其分子数( )
3.在同温同压下,气体体积的大小与分子数目成( )比
相等
相等
正
三、阿伏加德罗定律
1、 定律:
2、适用范围:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
任何气体及气体混合物
理想气体状态方程:
PV=nRT
理解:“同温、同压、同体积、同分子数(同物质的量)”。
只要有任何的“三同”,必有第“四同”——“三同定一同”。
二同定比例
相同条件 结论 公式 语言叙述
同温同压 同温同压下,体积比等于物质的量之比,等于粒子数之比
同温同容 同温同容下,压强比等于物质的量之比,等于粒子数之比
同温同物 质的量 同温同物质的量下,压强比等于体积的反比
同温同压 同温同压下,密度比等于摩尔质量之比
同温同压 同体积 同温同压下,体积相同的气体,其摩尔质量与质量成正比
阿伏加德罗定律的推论
公式:pV = nRT
思考
1.相同体积的两个容器,一个盛放氧气,一个盛放氢气,在同温、同压下,两容器中气体分子的数目有何关系?
相等。
2.在同温同压下,1 L O2和1 L O3含有的原子数相同吗?为什么?
不相同;1 L O2和1 L O3含有的分子数相同,因O2和 O3中原子数不同。
1.同温同压下,质量相同的N2,CO2,Cl2,CH4,O 2五种气体所占的体积由大到小的顺序是( )
2.在同温同压下,下列气体密度最大的是( )
A.CO2 B.SO2 C.HCl D.O2
V( CH4 )>V( N2 )>V( O2 )>V( CO2 )>V( Cl2 )
B
检 测
检
练习3
第2课时 气体摩尔体积
第3节 物质的量
气体 0℃、101KPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
思考与讨论
观察上述表格数据,你能得出哪些结论?
在一定条件下,1mol的不同物质的体积如下表所示。
(1)在相同条件下,1 mol不同固体或液体物质的体积是不同的。
(2)在相同条件下,1 mol不同气体物质的体积是相同的。
思:决定物质体积大小的因素有哪些呢?
结论:
[思考]
50个乒乓球与100个乒乓球分别紧密堆积,哪个所占的体积更大呢?
50个乒乓球与50个篮球分别紧密堆积,哪个所占的体积更大呢?
50个乒乓球紧密堆积,50个乒乓球松散堆积,哪个所占的体积更大呢?
影响物质体积大小的因素:
(3)粒子间的距离
(2)粒子的大小(即直径)
(1)粒子的数目
固体物质
液体物质
气体物质
固体、液体体积
物质的 体积
气体的
体积
粒子
的大小
粒子
的数目
粒子间
的距离
决定
决定
一、影响物质体积大小的因素
?
气体分子间的平均距离由什么决定?
温度
压强
同温同压下,任何气体分子之间的距离相同
升高温度,平均距离增大;
降低温度,平均距离减小。
增大压强,平均距离减小;
减小压强,平均距离增大。
同温同压下,粒子数相同的任何气体都具有相同的体积
为什么1mol不同的气体在标准状态下(0℃、101 kPa)所占的体积近似相同呢?
温度和压强相同时
任何气体分 子间平均距离几乎相同
气体的体积V近似相同
气体的分子数N是相同
1mol气体
二、气体摩尔体积
5.对象:
1. 定义:
2. 符号:
4.计算公式:
3.单位:
单位物质的量的气体所占的体积。
Vm
L/mol 或 L·mol-1 ( 或m3 /mol )
任何气体(包括混合气体)
6.影响因素:
温度和压强
注:在给定温度和压强的条件下, Vm是常数。
(若条件改变时,Vm也随之改变;也就是说要指明Vm的数值,必须指明温度和压强)
标准状况下(0℃,101KPa),1mol 任何气体的体积都约是22.4L 。
7.标况下的气体摩尔体积:
即:在0℃、101 kPa的状况下,Vm约为 22.4L/mol
(1)条件:标准状况(0℃,101KPa)
(2)对象:任何气体(单一气体或混合不反应的气体)
(3)数值:Vm≈22.4L/mol
标准状况下不是气体的物质有SO3、苯、CCl4、Br2、H2O、NO2、HF等。
【思考】
是否只有在标准状况下气体摩尔体积才是22.4L/mol?
不是,非标况下Vm也可能是22.4L/mol,
如升温加压,降温减压
练习1、判断下列说法是否正确?
(1) 气体的摩尔体积为22.4L·mol-1
(2)1molCO2占有的体积为22.4L
(3)1molH2O在标况下的体积为22.4L
(4)标况下任何气体的体积都约为22.4L
(5)标准状况下,1mol任何物质体积为22.4L
(6)1molHCl在3.03×105Pa时的体积比22.4L小
(7)1LH2和1LO2在同温同压下所含分子数相同
(8)1gN2和1gO2所含分子数相同
(9)1molO2和1molN2所含分子数相同,所占体积相同
×
×
×
×
×
×
√
×
×
1、标准状况下, 2.1 g CO的体积是多少?
2、3.01×1022个 O2 在标准状况下的体积是多少?
4、标准状况下,67.2 L 某气体的质量为 192 g , 则其摩尔质量为多少 ?
3、标准状况下, 44.8L SO2的质量是多少?
5、标准状况下, 5.6LCH4中含有多少个H?
理清思路最重要、熟练公式为重点。
N、m、V之间的互算:
气体摩尔体积的计算
思考与讨论
1.在同温同压下,相同分子数的气体,其体积( )
2.在同温同压下,体积相同的气体,其分子数( )
3.在同温同压下,气体体积的大小与分子数目成( )比
相等
相等
正
三、阿伏加德罗定律
1、 定律:
2、适用范围:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
任何气体及气体混合物
理想气体状态方程:
PV=nRT
理解:“同温、同压、同体积、同分子数(同物质的量)”。
只要有任何的“三同”,必有第“四同”——“三同定一同”。
二同定比例
相同条件 结论 公式 语言叙述
同温同压 同温同压下,体积比等于物质的量之比,等于粒子数之比
同温同容 同温同容下,压强比等于物质的量之比,等于粒子数之比
同温同物 质的量 同温同物质的量下,压强比等于体积的反比
同温同压 同温同压下,密度比等于摩尔质量之比
同温同压 同体积 同温同压下,体积相同的气体,其摩尔质量与质量成正比
阿伏加德罗定律的推论
公式:pV = nRT
思考
1.相同体积的两个容器,一个盛放氧气,一个盛放氢气,在同温、同压下,两容器中气体分子的数目有何关系?
相等。
2.在同温同压下,1 L O2和1 L O3含有的原子数相同吗?为什么?
不相同;1 L O2和1 L O3含有的分子数相同,因O2和 O3中原子数不同。
1.同温同压下,质量相同的N2,CO2,Cl2,CH4,O 2五种气体所占的体积由大到小的顺序是( )
2.在同温同压下,下列气体密度最大的是( )
A.CO2 B.SO2 C.HCl D.O2
V( CH4 )>V( N2 )>V( O2 )>V( CO2 )>V( Cl2 )
B
检 测
检
练习3
